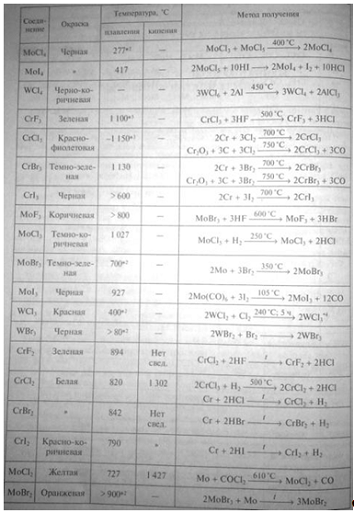
Соединения элементов VI Б-группы
Московская
государственная академия тонкой химической технологии им. М. В. Ломоносова
Кафедра
неорганической химии
Лекция
на тему:
«Соединения
элементов VIБ-
группы»
Выполнила: Купцова
Мария
Группа Х-41
Преподаватель: Рукк
Н.С.
Москва
2009
Хром. Физические и химические
свойства
В свободном виде - голубовато-белый металл с
кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39
°C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).
Хром является самым твердым металлом (твердость
по шкале Мооса 8.5).
Устойчив на воздухе. При 2000 °C сгорает с
образованием зелёного оксида хрома (III) Cr2O3,
обладающего амфотерными свойствами. Сплавляя Cr2O3 со
щелочами получают хромиты:
2O3
+ 2NaOH → 2NaCrO2 + H2O.
Непрокаленный оксид хрома (III) легко
растворяется в щелочных растворах и в кислотах:
2O3
+ 6HCl → 2CrCl3 + 3Н2О.
При термическом разложении карбонила хрома
Cr(СО)6 получают красный основной оксид хрома (II) CrO. Коричневый
или желтый гидроксид Cr(OH)2 со слабоосновными свойствами осаждается
при добавлении щелочей к растворам солей хрома (II).
При осторожном разложении оксида хрома(VI) CrO3
в гидротермальных условиях получают оксид хрома (IV) CrO2, который
является ферромагнетиком и обладает металлической проводимостью.
При взаимодействии концентрированной серной
кислоты с растворами дихроматов образуются красные или фиолетово-красные
кристаллы оксида хрома (VI) CrO3. Типичный кислотный оксид, при
взаимодействии с водой он образует сильные неустойчивые хромовые кислоты:
хромовую H2CrO4, дихромовую H2Cr2O7
и другие.
Известны галогениды, соответствующие разным
степеням окисления хрома. Синтезированы дигалогениды хрома CrF2,
CrCl2, CrBr2 и CrI2 и тригалогениды CrF3,
CrCl3, CrBr3 и CrI3. Однако, в отличие от
аналогичных соединений алюминия и железа, трихлорид CrCl3 и
трибромид CrBr3 хрома нелетучий.
Среди тетрагалогенидов хрома устойчив CrF4,
тетрахлорид хрома CrCl4 существует только в парах. Известен
гексафторид хрома CrF6.
Получены и охарактеризованы оксигалогениды хрома
CrO2F2 и CrO2Cl2.
Синтезированы соединения хрома с бором (бориды
Cr2B, CrB, Cr3B4, CrB2, CrB4
и Cr5B3), с углеродом (карбиды Cr23C6,
Cr7C3 и Cr3C2), c кремнием
(силициды Cr3Si, Cr5Si3 и CrSi) и азотом
(нитриды CrN и Cr2N).
В растворах наиболее устойчивы соединения
хрома(III). В этой степени окисления хрому соответствуют как катионная форма,
так и анионные формы, например, существующий в щелочной среде анион [Cr(OH)6]3−.
При окислении соединений хрома(III) в щелочной
среде образуются соединения хрома(VI):
2Na3[Cr(OH)6]
+ 3H2O2 → 2Na2CrO4 + 2NaOH +
8H2O.
Хрому(VI) отвечает ряд существующих только в
водных растворах кислот: хромовая H2CrO4, дихромовая H2Cr2O7,
трихромовая H3Cr3O10 и другие, которые
образуют соли - хроматы, дихроматы, трихроматы и т. д.
Вольфрам. Физические свойства
Вольфрам - светло-серый металл, имеющий самые
высокие температуры плавления и кипения.
Некоторые физические свойства приведены в
таблице (см. выше). Другие физические свойства вольфрама:
твердость по Бринеллю 488 кг/мм².
удельное электрическое сопротивление при
20 °C 55×10−9 Ом·м, при 2700 °C - 904×10−9
Ом·м.
скорость звука в отожжённом вольфраме 4290 м/с.
Вольфрам является одним из наиболее тяжелых и
самым тугоплавким металлом. В чистом виде представляет собой металл
серебристо-белого цвета, похожий на платину, при температуре около 1600 °C
хорошо поддается ковке и может быть вытянут в тонкую нить.
Валентность от 2 до 6. Наиболее устойчив
6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и
практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость:
при комнатной температуре не изменяется на воздухе; при температуре красного
каления медленно окисляется в оксид вольфрама VI; в соляной, серной и
плавиковой кислотах почти не растворим. В азотной кислоте и царской водке
окисляется с поверхности. В смеси азотной и плавиковой кислоты растворяется,
образуя вольфрамовую кислоту. Из соединений вольфрама наибольшее значение
имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные
соединения с общей формулой Me2WOX, а также соединения с
галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных
анионов, в том числе гетерополисоединений с включением других переходных
металлов.
Молибден. Физические свойства
Молибден - светло-серый металл с кубической
объемно-центрированной решёткой типа α-Fe (a = 3,14
Å; z = 2; пространственная группа Im3m),
парамагнитен. Механические свойства, как и у большинства металлов, определяются
чистотой металла и предшествующей механической и термической обработкой (чем
чище металл, тем он мягче). Обладает крайне низким коэффициентом теплового
расширения.
Химические свойства. При
комнатной температуре на воздухе Mo устойчив. Начинает окисляться при 400°C.
Выше 600°C быстро окисляется до триоксида МоО3. Этот оксид получают
также окислением дисульфида молибдена MoS2 и термолизом молибдата
аммония (NH4)6Mo7O24·4H2O.
Мо образует оксид молибдена (IV) МоО2
и ряд оксидов, промежуточных между МоО3 и МоО2.
С галогенами Mo образует ряд соединений в разных
степенях окисления. При взаимодействии порошка молибдена или МоО3 с
F2 получают гексафторид молибдена MoF6, бесцветную легкокипящую
жидкость. Mo (+4 и +5) образует твердые галогениды MoHal4 и MoHal5
(Hal = F, Cl, Br). С иодом известен только дийодид молибдена MoI2.
Молибден образует оксигалогениды: MoOF4, MoOCl4, MoO2F2,
MoO2Cl2, MoO2Br2, MoOBr3
и другие.
При нагревании молибдена с серой образуется
дисульфид молибдена MoS2, с селеном - диселенид молибдена состава MoSe2.
Известны карбиды молибдена Mo2C и MoC - кристаллические
высокоплавкие вещества и силицид молибдена MoSi2.
Особая группа соединений молибдена -
молибденовые сини. При действии восстановителей - сернистого газа, цинковой
пыли, алюминия или других на слабокислые (рН=4) суспензии оксида молибдена
образуются ярко-синие вещества переменного состава: Мо2О5·Н2О,
Мо4О11·Н2О и Мо8О23·8Н2О.образует
молибдаты, соли не выделенных в свободном состоянии слабых молибденовых кислот,
хН2О· уМоО3 (парамолибдат аммония 3(NH4)2O·7MoO3·zH2O;
СаМоО4, Fe2(МоО4)3 - встречаются в
природе). Молибдаты металлов I и III групп содержат тетраэдрические группировки
[МоО4].
При подкислении водных растворов нормальных
молибдатов образуются ионы MoO3OH-, затем ионы
полимолибдатов: гепта-, (пара-) Мо7О266-, тетра-(мета-)
Мо4О132-, окта- Мо8О264-
и другие. Безводные полимолибдаты синтезируют спеканием МоО3 с
оксидами металлов.
Существуют двойные молибдаты, в состав которых
входят сразу два катиона, например, М+1М+3(МоО4)2,
М+15М+3(МоО4)4. Оксидные
соединения, содержащие молибден в низших степенях окисления - молибденовые
бронзы, например, красная K0,26MoO3 и синяя К0,28МоО3.
Эти соединения обладают металлической проводимостью и полупроводниковыми
свойствами.
Соединения хрома молибдена и
вольфрама
ü Оксиды, гидроксиды, пероксиды
ü Карбиды,нитриды и бориды
ü Галогениды и оксогалогениды
ü Бронза вольфрама и молибдена
ü Сульфиды, селениды, теллуриды
Оксиды VI
Б группы
|
Степень
окисления
|
+6
|
Промежуточные
|
+4
|
+3
|
|
Cr
|
CrO3
|
Cr3O8, Cr2O5, Cr5O12 и
т.
д.
|
CrO2
|
Cr2O3
|
|
Mo
|
MoO3
|
Mo9O26, Mo8O23,
Mo5O14, Mo17O47, Mo4O11
|
MoO2
|
-
|
|
W
|
WO3
|
W49O119, W50O148,
W20O58, W18O49
|
WO2
|
Оксид хрома (III)
Оксид хрома (III)
- это самое устойчивое соединение хрома
Он обладает полупроводниковыми и
антиферромагнитными свойствами при температуре ниже 350С.
Cr2O3
-
наиболее устойчивый оксид хрома
(NH4)2Cr2O7
Ú Cr2O3
+ N2+4H2O
Полученный таким сухим методом Cr2O3
часто
химически инертен.Он легко растворяется в водных растворах кислот, демонстрируя
разнообразную химию катионов на основе иона [Cr(H2O)6]3+,
и щелочах с образованием сложных сильно гидролизуемых хроматов (III)
(«хромитов»).
Мелкий порошок Cr2O3
образуется
при сжигании тонко раздроб-ленного металла, дегидратации гидроксида нагревании
хромового ангидрида или хлористого сромила, сплавлении дихроматов с серой и
углем: t
K2Cr2O7
+ S = Cr2O3 + K2SO42Cr2O7
+ 2C = Cr2O3 + Na2CO3 + COh
Термическое разложение дихромата амммония:
(NH4)2Cr2O7
=
Cr2O3
+ N2
h + 4H2O
h
Если температуру разложения поддерживать
постоянной (250оС), то продуктом реакции будет черный оксид CrO2,
при 420оС он превращается в Cr2O3.
Для перевода Cr2O3
его
в растворимое состояние без изменения степени окисления использует хлорирование
в смеси с углем:
Cr2O3
+
3С +3CL2
= 2CrCl3
+ 3CO h
Сплавление с пиросульфатами:
Cr2O3+3
K2S2O7
= 3 K2SO4
+ Cr2(SO4)3
Карбонаты или гидроксидами щелочных металлов:
Cr2O3
+ Na2CO3
= 2NaCrO2
+ CO2
h
При сплавлении с окислителями (NaNO3,
O2,
Na2O2,
KClO3)
и карбонатами или гидроксидами щелочных металлов оксид хрома (III)
превращается в хроматы:
Cr2O3 + 3NaNO3
+ 2Na2CO3 = 2Na2CrO4+3NaNO2
+ 2CO h
Cr2O3 + 3O2
+8NaOH = 4Na2CrO4 + 4H2O
Оксиды хрома (IV),
молибдена (IV),
вольфрама (IV)
Диоксиды образуются как промежуточные продукты
при разложении в отсутствии кислорода или восстановлением M(VI)
в мягких условиях: они химически инертны по отношению к воде и щелочам, но
кислоты-окислители переводят их в соединения высшей степени окисления. Черный
оксид хрома (VI) обладает
металлической проводимостью, ферромагнитными свойствами и применяется в производстве
элементов памяти для компьютеров и бытовых радиоэлектронных приборов. Диоксиды
образуются как промежуточные продукты при разложении в отсутствие кислорода или
восстановлении соединений M(VI) в мягких условиях:
250oC;N2
3(NH4)2Cr2O7
ª 6CrO2
+2N2 + 9H2O + 2NH3
450oC3
+ H2 ª MoO2
+ H2O
600oC
WO3 + H2 ª
WO2+H2O
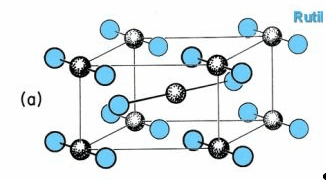
Диоксид хрома
CrO2
Черно-коричневый CrO2
,промежуточный
продукт разложения CrO3
до
Cr2O3.
CrO2 имеет
структуру рутила. Он обладает металлической проводимостью и
ферромагнитными свойствами. Его применяют для производства магнитных пленок для
записи.
Проявляет основные свойства и медленно переходит
в раствор под действием кислот:
CrO + 2HCl
= CrCl2
+ H2O
Он также является сильным восстановителем:
10000C
CrO + CO2
ª Cr2O3
+ CO
Нагревание в инертной атмосфере или в вакууме
приводит к диспропорционированию:
700оC
вакуум
CrO
ª Cr2O3
При температуре 1000оС водород
восстанавливает CrO
до металла.
Оксиды хрома (VI),
молибдена (VI),
вольфрама (VI)
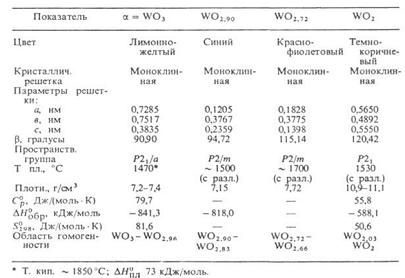
Оксид хрома (VI), или хромовый ангидрид, по
свойствам значительно отличается от высших оксидов молибдена и вольфрама (см.
табл. ниже)

Оксид CrO3 представляет собой
темно-красные призматические кристаллы, состоящие из тетраэдров [CrO4],
связанных вершинами в цепи. При температуре 197оС вещество плавится,
превращаясь в летучую темную жидкость, пары которой окрашены в красный цвет.
Разложение происходит в интервале 200 - 550 оС и заканчивается
образованием оксида хрома (III):
CrO3
= 2Cr2O3
+ 3O2#
CrO3
проявляет
сильные кислотные свойства и является ковалентным оксидом с температурой
плавления лишь 1970С. Его обычно называют «хромовой кислоты» и
получают добавлением концентрированной серной кислоты к насыщенному водному
раствору дихромата. CrO3
плавится
с частичным разложением, а при нагревании выше 220-2500С теряет
кислород, образуя ряд низших оксидов вплоть до зеленого Cr2O3
Белые кристаллы высшего оксида молибдена МоО3,
имеют слоистую структуру, в которой октаэдры [MoO6],
сильно искажены из-за неравноценности связей Мо - О, соединяются и вершинами, и
ребрами. При нагревании вещество желтеет, а при температуре 795 оС
плавится, превращаясь в подвижную жидкость.
Оксид вольфрама (VI) WO3 представляет
собой желтый кристаллический порошок. Его структура образована октаэдрами [WO6],
связанными между собой всеми вершинами. Такой структурный тип получил название
«структура типа ReO3» по первому исследованному веществу
аналогичного строения. Известны несколько модификаций WO3, в которых
атом вольфрама смещен из центра октаэдра, и возникающая деформация ведет к
понижению симметрии.
Гидроксиды, соли кислородосодержащих
кислот элементов шестой Б группы
Соединения хрома часто значительно отличаются по
свойствам от аналогичных соединений тяжелых металлов шестой группы - молибдена
и вольфрама, имеющих тенденцию в низших степенях окисления к образованию
кластеров, а в высшей степени окисления - изополи- и гетерополианионов.
С ростом степени окисления основные свойства
оксидов и гидроксидов постепенно сменяются кислотными, восстановительная
способность соединений убывает, а окислительная - возрастает. Так, соединения
хрома(II) (его,
Сг(ОН)2) имеют основный характер и являются сильными
восстановителями; высшему оксиду хрома СгОз соответствуют хромовая Н2СгО4 и
двухромовая Н2Сr207
кислоты, для них характерны окислительные свойства. Соединения хрома в
промежуточных степенях окисления, главным образом +3 (Cr20з,
Сг(ОН)3), амфотерны. Они наиболее устойчивы в водных растворах по
отношению как к окислению, так и к восстановлению.
Соединения, содержащие ионы М2+, характерны
лишь для хрома. Молибден и вольфрам в степени окисления +2 образуют кластеры,
например [М6Х8]4+. Соединения W(II)
менее характерны, например биядерный ацетат W(II) не существует, а структурный
аналог ацетата Сг(lI) - ацетат [Мo(СНзСОО)2]2
-исходный препарат для синтеза биядерных комплексов молибдена.
Пероксиды элементов шестой Б группы
Уже в середине XIX в. было известно, что при
действии пероксида водорода на подкисленный (рН 2-4) разбавленный раствор
дихромата калия возникает синее окрашивание, обусловленное образованием
нестабильного пероксида хрома CrO5(H20), имеющего
строение Сг(О2)2О(Н2О) (рис. а).
Эта реакция и сейчас используется для
качественного определения хрома. В индивидуальном виде пероксид хрома выделить
так и не удалось, но его устойчивость можно повысить экстракцией эфиром или
добавлением пиридина, анилина, бипиридила; при этом происходит замешение
молекулы воды на донорный лиганд (рис. б, в):
K2Cr2О7 + 4Н2О2
+ H2S04 + ру g 2СгО(О2)2(ру)
+ K2S04 + 5Н2О
В слабокислой или нейтральной среде (рН 4 - 7)
взаимодействие раствора дихромата с пероксидом водорода приводит к фиолетовому
окрашиванию, обусловленному ионами [Сг(О2)20(ОН)]-
(рис. г). Образование аналогичного окрашивания при действии на эфирный
раствор пероксида хрома небольшого количества аммиака или щелочи:
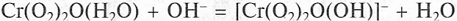
в индивидуальном виде вещество, содержащее такие
ионы, может быть получено в виде аммонийной соли действием пергидроля на
охлажденный раствор хромата аммония, подкисленный уксусной кислотой.
При добавлении к эфирному раствору пероксида
хрома избытка аммиака происходит восстановление хрома до степени окисления +4:
образовавшийся зеленовато-коричневый раствор содержит дипероксокомплекс Сr(О2)2(NНз)з
(рис д). Это вещество также может быть получено при действии на хромовый
ангидрид аммиака и крепкого раствора пероксида водорода.
В сильнощелочной среде образуются
красно-коричневые растворы, содержашие тетрапероксохромат-ионы [Сг+S(О2)4]З-
в форме кислородного додекаэдра (рис. е). Они входят в состав твердых солей,
например КзСгО8. Это вещество служит источником синглетного
кислорода. При низких температурах в нем происходит упорядочение по типу
антиферромагнетика.
Перекисные соединения хрома (а-е) и
молибдена (ж, з):
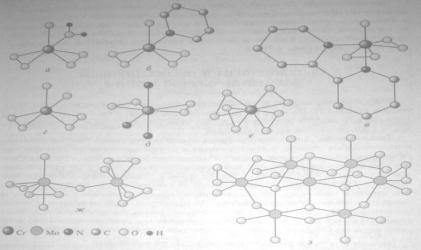
а - Cr(O2)2O(H20);
б - Сr(O2)2O(ру);
в - Cr(O2)2O(bipy);
г - [Cr(O2)2O(OH)]-;
д - Сr(O2)2(NН3)3;
е - [Сг(02)43-; ж - [Мо2Оз(O2(Н2О)22-;
з - [Мо7О22(O2)2]6-
(атомы водорода не показаны)
Карбиды, нитриды и бориды элементов
шестой Б группы
С углеродом хром, молибден и вольфрам, как и
другие d-металлы, образуют карбиды - твердые и высокоплавкие (температура
плавления 2400- 2800 oС)
соединения с делокализованной металлической связью. Получают их взаимодействием
соответствующих количеств простых веществ при высокой (1 000 - 2 000oС)
температуре, а также восстановлением оксидов углеродом, например:
МоОз + 7С = Мо2С
+ 6СО
Карбиды - нестехиометрические соединения с
широкой областью гомогенности. В карбидах типа М2С атомы металла
образуют гексагональную плотнейшую упаковку, в октаэдрические пустоты которой
статистически внедрены атомы углерода.
Нитриды MN и M2N получают
взаимодействием металлов с азотом или аммиаком, а фосфиды МР2, МР4,
М2Р - из простых веществ, также при нагревании галогенидов с фосфином.
Как и карбиды, это нестехиометрические, очень твердые, химически инертные и
тугоплавкие (температуры плавления 2 000 - 2 500 oС)
вещества.
Для молибдена и вольфрама характерны
тригалогенонитриды Х3М=N, в структуре которых плоские квадраты
объединены мостиковыми атомами галогена в слои. Их получают из карбонилов или
галогенидов:
6
+ [Hg2N]Br g ВгзW=N + 2HgBr2
Галогениды
Для элементов шестой группы известно большое
число соединений с галогенами (см.табл.). По мере роста степени окисления, а
также с уменьшение I порядкового номера металла возрастает ковалентность связи,
а следовательно, и кислотный характер галогенида.
|
Степень
окисления металла
|
СгХ"
|
МоХ"
|
WX"
|
|
+2
|
CrCl2, СrВr2,
CrI2
|
MoCl2, MoBr2, MoI2
|
WCI2,
WI2
|
|
+3
|
CrF3, CrCl3,CrBr3
|
MoF3, MoCl3, MoBr3, MoI3
|
WСlз,
WВГЗ, WIз
|
|
+4
|
CrF4, CrCl4, CrBr4
|
MoF4, MoCl4, MoBr4, MoI4
|
WF4,
WC14, WBr4, WI4
|
|
+5
|
CrF5
|
MoF5, MoCl5, MoBr5, MoI5
|
WFs,
WCls, WBr)
|
|
+6
|
CrF6
|
MoF6,MoCl6
|
WF6,
WCI6, WBr6
|
Известные галогениды хрома, молибдена и
вольфрама перечислены в таблице. Наблюдаемые закономерности соответствует
ожидаемым. Степень окисления (+5, +6) достигается хромом только в сочетании с
таким сильным окислителем, как фтор, и даже вольфрам не образует гексаонидов.
Для степени окисления +4 существование иодидов
сомнительно, либо они нестабильны. Аналогично для оксогалогенидов, только
вольфрам образует оксоиодид, и только хром получен оксофторид в низшей степени
окисления.

Дигалогениды
химический хром вольфрам оксид
Дигалогениды хрома представляют собой твердые
вещества с центральным атомом, расположенным в центре искаженного октаэдра, что
типично для иона с конфигурацией d4 вследствие эффекта Яна-Теллера.
Синтез этих соединений проводят либо восстановлением безводных тригалогенидов
водородом, либо взаимодействием хрома с галогеноводородами при температуре 1000
ос. Иодид (единственный из дигалогенидов) может быть получен прямым синтезом.
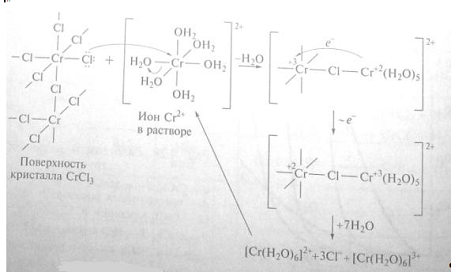
Все дигалогениды хрома растворимы в воде, где они присутствуют в виде
гексаакваионов. Их водные растворы на воздухе мгновенно окисляются, изменяя
ярко-синюю окраску на грязно-зеленую.
Соединения хрома(II)
являются сильными восстановителями, в противоположность дигалогенидам
молибдена, довольно устойчивым к действию окислителей.
Недавно в среде тетрагидрофурана (thf) получен
оксохлорид:
8CrC12 +LiOH· Н2О
+ 3C4H9Li + 4(thf) = 2Cr4OCl6(thf)4
+ 4LiCl+ 3C4HIO
Тригалогениды
Тригалогениды хрома, молибдена и вольфрама также
существенно различаются по строению и свойствам. Наиболее известен хлорид
хрома(III), или
хлорный хром, СгСlз, образующийся в виде фиолетовых чешуйчатых
кристаллов при хлорировании хрома или смеси его оксида углем. Это вещество
может быть сублимировано в токе хлора при температуре 600 ОС, но при
нагревании до этой температуры в инертной атмосфере или в вакууме частично
разлагается на дихлорид и хлор.


Тетрагалогениды
Из тетрагалогенидов наиболее устойчивы фториды,
известные для всех трех элементов. Хлорид и бромид хрома (IV)
существуют в газовой фазе в равновесии 2СгХз + Х2 D
2СгХ4.
В виде индивидуального вещества они не выделены,
хотя тетраэдрические молекулы CrCl4 стабилизированы в аргоновой
матрице.
Тетрахлорид молибдена MoC14 - черное
нелетучее вещество, разлагающееся при температуре выше 1300 C.
Он существует в виде нескольких модификаций. Известен также тетрабромид
молибдена. Все тетрагалогениды за исключением тетрафторидов легко гидролизуются
и при этом диспропорционируют:
2МХ4 + Н2О = МХЗ
+ МОХз + 2НХ
на воздухе окисляются. Частичный сольволиз
проходит также в метаноле:
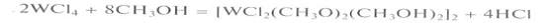
Из ацетонитрильных растворов WCl4
кристаллизуются молекулярные сольваты WСI4(СНзСN)2·
Пентагалогениды.
Пентафториды, известные для всех трех металлов,
представляют собой желтые (MoFs, WFs) или красные (CrFs)
легколетучие кристаллические вещества, изоструктурные соответствующим
галогенидам ниобия и тантала. Они построены из циклических молекул, в которых
четыре октаэдра связаны общими вершинами с помощью мостиков M--F-M (см. рис.
3.28, а). При небольшом нагревании пентафториды молибдена (165 ОС) и вольфрама
(30 ОС) испропорционируют:
MFs = МFб + MF4
С солями щелочных металлов они дают фторидные
комплексы. Среди пентахлоридов наиболее изучен MoCls, образующийся в
виде черных кристаллов, состоящих из димеров M02Cl1o в
виде двух октаэдров [MoC16], соединенных ребрами.
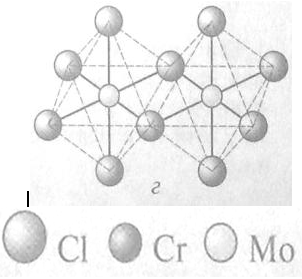
Среди пентахлоридов наиболее изучен Mo2Cl10,
образующийся в виде черных кристаллов, состоящих из димеров Мо2Cl10 в виде двух
октаэдров [MoCl6], соединенных ребрами.
Важнейшие оксохлориды молибдена и
вольфрама
Для всех трех элементов известны оксогалогениды,
но наиболее характерны они для молибдена и вольфрама. Часто оксогалогениды
выделяются в качестве побочных продуктов при синтезе безводных галогенидов.
Поскольку двойная связь М =0 очень прочна,
оксогалогениды образуются в присутствии даже незначительного количества
кислорода и водяного пара. Общим методом их синтеза служит галогенирование
оксидов хлором, хлористым тионилом, летучими хлоридами (см. табл. ):
1000 оC
Сr2O3
+ СгСlз g 3CrOCl
Низшие оксогалогениды могут быть также получены
восстановлением или разложением высших. Для хрома наиболее характерны высшие
диоксогалогениды СrО2Х2,
известные для всех галогенов, за исключением йода и астата.
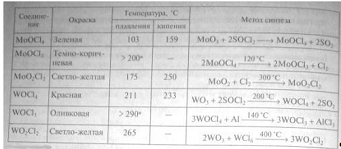
Из оксогалогенидов молибдена следует отметить
оксохлорид МоОCl3 - темно-коричневые игольчатые кристаллы, состоящие
из бесконечных цепей октаэдра [MoOCl5]2- (см. рис.) Эти
вещества получают также электрохимическим восстановлением гидратированного
оксида молибдена в солянокислом растворе или восстановлением молибдатов
иодоводородом в концентрированной НСl:
(МоОз· Н2О) + 8HCl + 4KCl
= 2K2[MoOCls] + C12 #
+ 6Н2О
Бронза вольфрама и молибдена
Среди кислородных соединений элементов шестой
группы интерес представляют вольфрамовые бронзы, названные так из-за
металлического блеска и специфической окраски. Они образуются при
восстановлении метавольфрамата натрия водородом при температуре красного
каления:
2Na6H2W12O40
+ 6H2
= 24Na0,5WO3
+ 8H2O
Или при нагревании смеси оксида вольфрама (VI)
с щелочным металлом:
WO3
+ 0,3Na = Na0,3WO3
Вольфрамовые бронзы Nax(W+6W+5)O3
имеют структуру типа перовскита
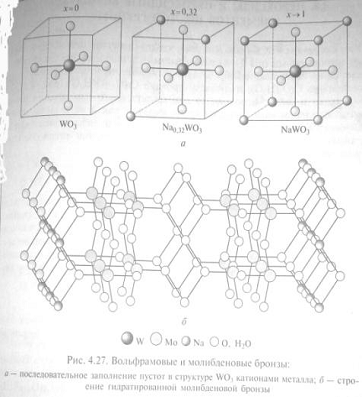
а -
последовательное заполнение пустот в структуре WO3
катионами металла, б - строение гидратированной молибденовой бронзы
Для Мо образование бронз не столь характерно.
Они менее устойчивы и получены восстановлением молибдатов при высоких (> 60
кбар) давлениях. Взаимодействие оксида молибдена (VI)
с дитионитом или боргидридом натрия в этиловом спирте приводит к образованию
гидратированных бронз, в которых катионы щелочного металла интеркалированы
между слоями в структуре МоО3:
2MoO3 + xNa2S2O4
+ 2nH2O=2Nax(H2O)nMoO3
+2xSO2#
Невысокая стабильность солибденовых бронз по
сравнению с вольфрамовыми может быть связана с большей склонностью Мо (VI)
к диспропорционированию.
Список литературы
1. Неорганическая
химия, под ред. Третьякова. Т.3:Химия переходных элементов. М., Издательский
центр «Академия», 2007.
. Гринвуд
Н.Н. Химия элементов: в 2 томах. Т. 2, Издатель: Бином. Лаборатория знаний, Год
издания - 2008
. Интернет-ресурс
Википедия.