|
Автор, год
|
T1
|
T2
|
T3
|
T4
|
N0
|
N1
|
N2
|
N3
|
M0
|
M1
|
MX
|
|
Ассоциация онкологов
России,2014
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
Вашакмадзе и соавт., 2001
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
Ганцев и соавт., 2009
|
|
|
X
|
X
|
|
X
|
X
|
|
|
|
|
|
Скоропад и соавт., 2009
|
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
Итак, на МРРЖ приходятся следующие стадии: T1-4N+M0 [17].
1.2 Подходы лечения МРРЖ по данным основных рандомизированных
исследований
Обязательным этапом лечении МРРЖ является радикальное удаление опухоли, с
возможными очагами местнорегионарного метастатического поражения. Однако, было
показано, что продолжительность жизни пациентов не изменилась без применения
дополнительных методов противоопухолевого лечения, это диктуют необходимость
разработки различных комбинированных подходов лечения рака желудка, которые
будут рассмотрены более подробно в этом параграфе [8].
В настоящее время наибольшее распространение получили следующие
направления в лечении местно-распространенного рака желудка:
1. Комбинированная адъювантная химиолучевая (АХЛТ) терапия рака желудка
(позиция MacDonald J.S.)
2. .Изолированно хирургическое лечение (считается приоритетным выбором
лечения рака желудка у Японских специалистов).
. Неоадъювантное химиотерапевтическое лечение в рамках
комбинированного подхода в лечении рака желудка (Позиция Cunningham) .
4. Рассмотрим каждый из этих методов лечения более подробно.
1.2.1 Комбинированная адъювантная химиолучевая (АХЛТ) терапия
рака желудка (позиция MacDonald J.S.)
На наряду с рассмотренной выше позицией, необходимо остановиться на
позиции MacDonald J.S., который придерживается
комбинированной неоадъювантной химиолучевой терапии при лечении МРРЖ.
По мнению Landry J., Tepper J.E. вероятность возникновения местного
рецидива или поражения региональных лимфатических узлов держится на высоком
уровне и регистрируется в> 40-65% случаев после R0 резекций, что привело к активному изучению
химиолучевой терапии для снижения уровня местных рецидивов [37].
Исследование MacDonald J.S. и соавт. «Intergroup 0116 ― SWOG 9008» вызвало значительный резонанс.
Было отобрано 603 пациента (T2-4/N+), которым проводилось радикальное
хирургическое лечение. В послеоперационном периоде планировалось проведение
5-ти курсов химиотерапии фторурацилом (425 мг/м2), лейковарином (20
мг/м2), а так же лучевая терапия в дозе 45 Гр за 25 фракций.
Токсичность химиотерапии привела к тому, что осложнения развились у 73% (41% -
осложнения 3 ст. тяжести; 32% - 4ст.тяжести), в связи с чем проведение
химиотерапии в полном объеме оказалось возможным лишь у 64% больных.
Данные исследования показали, что безрецидивная выживаемость в группе
больных с комбинированным и изолированно хирургическим лечением составила 48 и
30% (р<0,0001), а общая выживаемость - 50 и 40% (р=0,01). Были получены
достоверные данные о лучших показателях выживаемости больных с неблагоприятными
прогностическими факторами при проведении химиолучевой терапии. Данную схему
лечения ввели в стандарты.
Однако, необходимо отметить, что при аудите первичных материалов сами
авторы отметили значительные несоответствия предусмотренных протоколом
параметров лечения реально имевшим место. У 34% пациентов лучевая терапия была
проведена в значительных вариациях, а при проведении хирургического лечения у
54% больных лимфодиссекция была проведена в объеме D0.
Показатель 3-летней выживаемости в группе хирургического лечения составил
40%, т.е. был весьма низок, а выживаемость в группе с комбинированным лечением
(50%), соответствует сходным данным при проведении хирургического лечения и
лимфодиссекции в объеме D1 в
двух Европейских рандомизированных исследованиях, где выживаемость пациентов
составила 50 и 56%. Несмотря на это, послеоперационная схема химиолучевого
лечения настоящее время рассматривается как стандарт лечения больных
местно-распространенным раком желудка (T2-4/N+) на
Северо-Американском континенте ,но практически не применяется в Европе и Азии
из-за высокой токсичности.
В 2005 году в Южной Корее Kim S. и соавт.
провели похожее исследование с применением схемы химиолучевого
послеоперационного лечения, предложенную MacDonald J.S. и соавт., но
при оперативном вмешательстве всем пациентам была проведена лимфодиссекция в
объеме D2 [35].
Данное рандомизированное исследование включало 544 больных, получавших
комбинированное лечение и 446 хирургическое. Его результаты показали
статистически достоверно лучшие результаты общей выживаемость в группе больных
с комбинированным подходом лечения ( 95 мес.- 1 группа,63 мес.- 2 группа),
медиана безрецидивной выживаемости (76 и 53 мес.). Данные показали, что преимущества
химиолучевой терапии сохранялось на каждой из стадий - 2, 3А, 3В, 4 [39].
Следующим этапом в определении эффективности адъювантой химиолучевой
терапии стало исследование «ARTIST»,
в котором проводилось сравнение эффективности АХТ и АХЛТ после выполнения ГЭ D2.
Была применена схема химиотерапии XР (капецитабин в дозе 2000 мг/м2, 1-14 дни, и
цисплатин в дозе 60 мг/м2, 1 день; цикл повторялся каждые 3 недели),
всего было запланировано 6 циклов (1 группа).
В группе ХЛТ вначале проводилось 2 цикла химиотерапии по схеме XР, далее ―
лучевая терапия в СОД 45
Гр в течение 5 недель на фоне приема капецитабина в дозе 1650 мг/м2
в день, после чего ― вновь 2 цикла химиотерапии XР (2 группа). Поле лучевой терапии включало ложе опухоли,
зону анастомоза, культю двенадцатиперстной кишки, регионарные лимфатические
узлы, и по 2 см в проксимальном и дистальном направлении от границ резекции.
Полный объем запланированной химиотерапии оказалось возможным провести у
75% больных 1-ой группы и 82% больных 2-ой группы.
Осложнения, требовавшие изменения запланированного лечения (снижение
дозы, увеличение интервалов) имели место у 52% больных первой группы и 35%
больных второй группы.
Частота развития локо-регионарного рецидива (8,3 и 4,8%, р=0,35) и
отдаленных метастазов (24,6 и 20,4%, р=0,55) в группах сравнения не отличались.
Показатели 3-летней безрецидивной выживаемости составили - 74,2% в группе
химиотерапии и 78,2% в группе химиолучевой терапии (р=0,086). В то же время, в
подгруппе больных с метастатическим поражением регионарных лимфатических узлов
(86,5% больных), выживаемость в группе химиолучевой терапии была статистически
достоверно выше: 77,5 и 72,3% (р=0,036).
Авторами был сделан вывод, что АХЛТ достоверно более эффективный метод
лечения МРРЖ в сравнении с АХТ после радикальной операции с лимфодиссекцией D2 [44].
В 2012 году было проведено рандомизированное исследование «ARTIST-II», в которое были включены только больные с метастатическим
поражением регионарных лимфатических узлов [58].
Больные были разделены на 2 группы, всем пациентам была выполнена гастрэктомии D2, после чего следовал 4-ех недельный
перерыв.
Далее смеха лечения 1-ой группы была следующей: химиотерапия препаратами
фторурацил 400 мг/м2 и лейковорин 20 мг/м2 в течение 5
дней; далее ― лучевая терапия с модуляцией интенсивности пучка в СОД 45 Гр
за 5 недель с фторурацилом и лейковорином в течение первых 4 и последних 3 дней
курса; еще два 5-дневных цикла химиотерапии проводились через 4 недели после
завершения лучевой терапии.
Контрольная группа поучала такую же схему химиотерапии. Показатели
переносимости при проведении данной схемы химиотерапии показали хорошие
результаты , общее число токсических реакций оказалось несколько выше в
исследуемой группе, но разница является статистически не достоверной.
В исследовании были получены следующие результаты:
частота развития отдаленных метастазов в группах сравнения не отличалась
(24,2 и 26,7%, р=0,59). Общая 5-летняя выживаемость в группах сравнения не
различалась (49 и 42%, р=0,012), а безрецидивная выживаемость была достоверно
выше в исследуемой группе (45 и 36%, р=0,029).
Авторы сделали вывод о том, что предложенный режим АХТ и АХЛТ после D2 резекции хорошо переносится
больными, приводит к достоверному увеличению безрецидивной выживаемости, однако
не влияет на общую выживаемость [58].
.2.2 Изолированно хирургическое лечение МРРЖ
Как уже отмечалось, «золотым стандартом» лечения РЖ является радикальное
удаление первичной опухали с возможными очагами местнорегионального
метастатического поражениях.
Обязательным компонентом дооперационного обследования считается
морфологическая верификация строения первичной опухоли, а также определение
типа роста (по классификации Лаурена), что является необходимым объемом
информации для определения тактики и объема оперативного вмешательства [52,55].
Объём радикальной операции по поводу рака желудка должен включать:
удаление единым блоком поражённого желудка (или соответствующей̆ его части) с обоими сальниками,
клетчаткой̆ и лимфатическими узлами регионарных зон; пересечение органа на
расстоянии не менее 5 см от макроскопически определяемого края опухоли с
отграниченным (типы I-II по Borrmann) типом роста и не менее 6-7 см при раке
язвенно-инфильтративного и диффузного типов (типы III-IV по Borrmann)[18].
Для подтверждения радикальности операции выполняют срочное
морфологическое исследование краёв резекции по линии пересечения
органов, с целью определения остаточного опухолевого поражения :
R0:
после резекции желудка данных о наличии опухолевого поражения нет. R1 после резекции желудка имеются
микроскопические признаки опухоли. R2: после резекции желудка имеются макроскопические признаки опухоли.
Дистальная субтотальная резекция желудка (ДСРЖ) показана при раке
антрального отдела желудка при отсутствии очагов тяжёлой̆ дисплазии и рака in situ в
остающиеся части желудка. Допустимо выполнение дистальной субтотальной резекции у больных с низкими
функциональными резервами при распространении опухоли на нижнюю треть тела
желудка, если она имеет экзофитную или смешанную формы роста (I-II типы по
Borrmann);
Проксимальная субтотальная резекция желудка (ПСРЖ) показана при раке
кардиоэзофагеального перехода, а также при небольших опухолях верхней трети желудка экзофитной или смешанной формы роста.
Гастрэктомия (ГЭ) показана во всех остальных случаях, в том числе
является единственно возможным объемом хиругического вмешательства при
верифицировании перстневидноклеточной опухоли.[3,6]
Стандартным объемом при проведении хирургического лечения является
расширенная лимфодиссекция D2 [24]. Однако, к настоящему времени не существует
рандомизированных исследований, проведенных за пределами Японии, подтверждающих
целесообразность проведения лимфодиссекция D2, а в большинстве клиник
стандартным объемом вмешательства является гастрэктомия или субтотальная
резекция желудка с лимфодиссекцией D1, а D2 и D3 считаются расширенными
объемами хирургического вмешательства.
В 2012 году А. М. Карчун с соавт. провел исследование, в котором был
проведен анализ непосредственных и отдаленных результатов расширенных и
стандартных хиругических вмешательств у больных резектабельным раком желудка,
оценены непосредственные и отдаленные результаты хиругического лечения больных
МРРЖ [11].
В исследование было отобрано 1379 больных раком желудка, которым
выполнены R0-операции. Объем операции с лимфодиссекцией D1 были выполнены 814 пациентам, D2 - 542, D3 - 23 пациента.
Так же результаты хирургического исследования были изучены в группе
пациентов местнораспространенным раком желудка, в которую входило 446 пациента.
Больным данной группы в 340 случаях были выполнены радикальные комбинированные
операции, в 37 - паллиативные комбинированные вмешательства, в 69 -
симптоматические и эксполиативные операции.
Отдаленные результаты вмешательств, сопровождавшихся D1 диссекцией, оказались следующими: 5-летняя
выживаемость - 20,7±1,3%, медиана вы-
Из пациентов, которым выполнялась D2 лимфодиссекция, более 5 лет прожили
38,6±2,3% больных, а медиана выживаемости достигла 40 месяцев.
1. Данное исследование показало, что выполнение расширенных оперативных
вмешательств (D2) достоверно увеличивает показатели отдаленной выживаемости,
чем при выполнении стандартных D1
операций [12].
Однако, говоря о радикальном лечении рака желудка , необходимо
акцентировать внимание на том , что после хирургического этапа лечения,
особенно, после гастроэктомий, общесоматический статус пациентов ухудшается
из-за развития целого комплекса гастрэктомических синдромов и осложнений
связанных с химиотерапией.
В этой группе больных значительно снижения индекса массы тела в связи с
катаболическими процессами на фоне изменения трофологического статуса, анемии,
демпинг-синдрома, дисфагических проявлений после гастрэктомии. Поэтому, процент
пациентов, которые смогли перенести послеоперационный блок ХТ в полном объеме,
колеблется от 15 до 40%. Таким образом , необходимо учесть , что при ведении
таких больных должен использоваться индивидуальных подход и применяться
амбулаторная коррекции развивающихся осложнений после гастрэктомии для
сохранения удовлетворительного статуса пациента для завершения
послеоперационного блока химиотерапии.
Для оценки общесоматического статуса пациента с МРРЖ после гастрэктомии
необходимо учитывать следующие показатели: рост, вес, возраст больного до
начала комплексного лечения, оценка наличия синдрома кахексии, саркопении.
Необходимо проводить расчет суточного потребления калорий с учетом
физической активности и подбирать сопроводительную терапию с учетом полученных
данных. Проводя динамическое наблюдение за общесоматическим статусом, необходимо
брать во внимание такие клинико-инструментальные показатели как: уровень
альбумина и трасферрина крови, уровень лимфоцитов крови, С-реактивного белка,
объем мышечной массы, контроль индекса массы тела [9,48].
На протяжении длительного времени у больных с МРРЖ, перенесших
радикальное хирургическое вмешательство в объеме R0 c лимфаденэктомией
D2 обязательно строгое динамическое
наблюдение в следующем объеме: каждые 3-6 месяцев на протяжении 3-5 лет.
После 5 лет с момента операции визиты проводятся ежегодно или при
появлении жалоб. У больных с высоким риском рецидива перерыв между
обследованиями может быть сокращен.
.2.3 Неоадъювантное химиотерапевтическое лечение в рамках
комбинированного подхода в лечении рака желудка (Позиция Cunningham)
В исследовании Cunningham D., которое
длилось с 1994 г. по 2002 г., было отобрано 503 пациента, разделенных на 2
категории:
) получавших в предоперационном и послеоперационном периодах по 3 цикла
химиотерапии по протоколу ECF
(эпирубицин, цисплатин, 5-ФУ) (n=250),
) получавших только хирургическое лечение (n=253).
Послеоперационная химиотерапия начиналась через 6-12 недель после
хирургического лечения [29].
Около 50% пациентов получили всю запланированную химиотерапию в группе
комбинированного лечения (у 50% лечение было прервано в связи с состоянием
общесоматического статуса, связанным с послеоперационными и
химиотерапевтическими осложнениями).
Было отмечено увеличение общей выживаемости (Рис. 2), времени до
прогрессирования (Рис. 3), частоты R0 резекций, а также снижение стадии (Табл. 2) и послеоперационной
летальности в группе пациентов, получавших периоперационное лечение. Пятилетняя
выживаемость в группе пациентов, получавших периоперационное лечение, составила
36,3%, а в группе пациентов, получавших только хирургическое лечение - 23% (p<0,001).
Таблица 2. Понижение TN-стадии
(down-staging).
|
НАХТ
|
Операция
|
|
T1/T2
|
52%
|
38%
|
|
T3/T4
|
48%
|
62%
|
|
N0/N1
|
84%
|
71%
|
|
N2/N3
|
16%
|
29%
|
Местный рецидив был подтвержден у 14,4% пациентов в группе
периоперационного лечения, в группе хирургического лечения - 20,6%. Отдаленные
метастазы были обнаружены у 24,4% и 36,6% пациентов.
В 2013 году была показана необходимость в проведения адъювантной
химиотерапии после применения НАХТ и хирургического лечения (медиана
выживаемости пациентов, получивших «полное» лечение составила 14 месяцев, а в
группе пациентов, получивших только хирургическое лечение - 8 месяцев, p<0,004) [18] (Рис. 4).
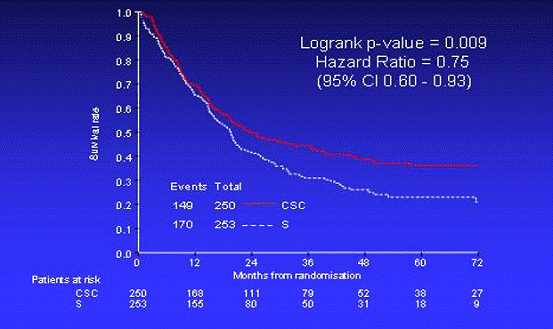
Рис. 2 - Общая выживаемость пациентов обеих групп
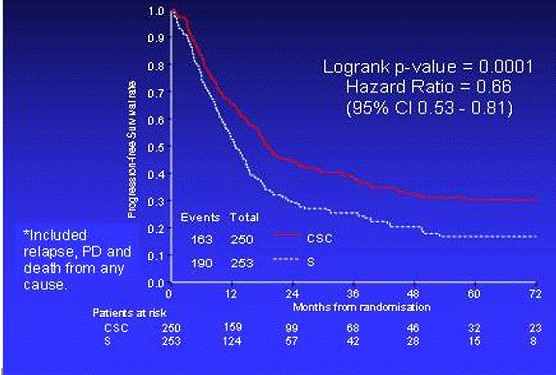
Рис. 3 - Время до прогрессирования в обеих группах
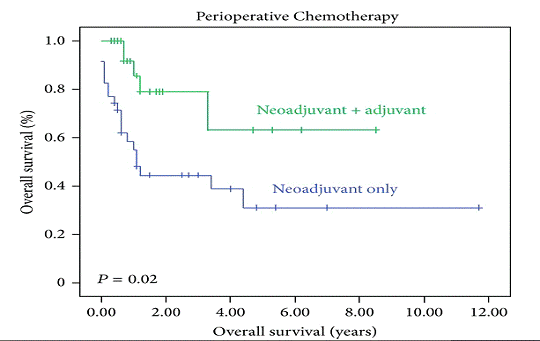
Рис. 4 - График общей выживаемости в зависимости от проведения только
НАХТ или НАХТ с последующим адьювантным лечением
F. и соавт., используя современные методы молекулярного анализа,
показали, что после проведения хирургического лечения опухолевые клетки
выявляются в крови у 33,3% больных в сравнении с 8,8% до операции (различие
является статистически значимым). Более того, частота обнаружения раковых
клеток закономерно возрастала с увеличением глубины прорастания опухолью стенки
желудка (Т1 -17%, Т2 - 58%, Т3 - 75%, Т4 - 100%).
Наблюдение показало, что рецидив заболевания встречается статистически
достоверно чаще у больных, у которых были обнаружены циркулирующие раковые
комплексы в крови, причем преобладали гематогенные метастазы. Полученные данные
подтверждают целесообразности и необходимость применения НАХТ у больных раком
желудка, особенно МРРЖ [34].
Во Французском проспективном рандомизированном исследовании были отобраны
224 больных раком желудка, которые получали НАХТ(n=113), либо только
хирургическое лечение (n=113).
До операции пациентам проводилась 2 цикла ФУ+цисплатин, а после операции,
при под- тверждении ответа на терапию, им проводили еще 4 таких же цикла.
Среди всех больных, 87% получили весь курс предоперационный ХТ и лишь 48% смогли закончить
послеоперационное химиотерапевтическое лечение. Пока- затели пятилетней, общей
и безрецидивной выживаемости оказались статистически значимо выше в группе
периоперационной ХТ (38% против 24% и 34% против 21% соответственно) [27].
В 2009 году было проведено исследование EORTC , в которое входило 144
больных РЖ или пищеводно-желудочного перехода. Группа неоадъювантной химиотерапии получила 3
предоперационных цикла (цисплатин, ФУ, ЛВ).
Данное исследование показала, что частота R0 резекций в группе больных,
получавших НАХТ оказалась достоверно выше, чем в группе больных только с
хиругическим лечением (82% против 67%), однако исследование не показало
достоверных различий в общей выживаемости больных в обеих группах[50,51].
Данные исследования показали, что НАХТ лучше переносится пациентами, чем
послеоперационная, НАХТ увеличивает частоту R0 резекции, но не влияла на
послеоперационную летальность, значимо увеличила 5-летнюю выживаемость.
Несмотря на эти данные реальная стратегия ведения пациентов при РЖ и раке
пищеводно-желудочного перехода в ряде странах различается. В США при III стадии
используется послеоперационная химиорадиотерапия, во Франции и Великобритании
при II и III стадиях применяют периоперационную химиотерапию, в Азии
адъювантная терапия S1 является стандартом.
1.2.4 Обоснование применения неоадъювантной химиотерапии при
МРРЖ
Как было отмечено раннее, исследования, проведенные Cunningham D и др. позволяют утверждать о следующих преимуществах НАХТ,
которые достоверно обосновывают необходимость ее применения в лечении МРРЖ :
) повышение резектабельности опухоли;
) возможность проведения эрадикации микрометастазов;
) определение чувствительности опухоли к химиопрепаратам с помощью
лекарственного патоморфоза;
) проведение down-staging больных из группы неблагоприятного
прогноза в группу благоприятного прогноза;
) раннее начало системного лечения;
) уменьшение интраоперационного метастазирования, путем снижения
биологического потенциала раковых клеток к адгезии и росту после
интраоперационной диссеминации [16,17]
Однако необходимо отметить и ряд недостатков НАХТ:
) сложность предоперационного стадирования МРРЖ;
) нецелесообразность проведения неоадъювантной терапии больным с
обструктивными или геморрагическими формами рака;
) невозможность проведения хирургического лечения больным, у которых
отмечается прогрессирование заболевания на фоне химиотерапии.
Однако, необходимо отметить что у этих больных, не будет отмечаться
увеличение продолжительности жизни после проведения резекции желудка [30, 36].
Необходимо отметить и тот факт, что среди больных раком желудка преобладает
пожилой контингент, в связи с чем, при выборе тактики лечения необходимо
учитывать общесоматический статус этих пациентов, т.к. токсические эффекты НАХТ
могут привести к их декомпенсации, приостановке курса НАХТ, невозможности
проведения хирургического этапа лечения или же увеличения рисков
послеоперационных осложнений.
Имеется прямая корреляция между выраженностью симптоматики и
удовлетворительным состоянием больного с продолжительностью жизни.
Больные функциональная активность по шкале ECOG 0 и 1 живут дольше, чем
более тяжелые больные (функциональная активность 2 и более), и результаты
химиотерапевтического лечения лучше независимо от других прогностических
факторов.
Таблица 3.Показатели общего состояния больного по шкале ECOG.
|
Оценка
|
|
|
0
|
Больной полностью активен,
способен выполнять все, как и до заболевания (90-100 баллов по шкале
Карновского)
|
|
1
|
Больной неспособен
выполнять тяжелую, но может выполнять легкую или сидячую работу (например,
легкую домашнюю или канцелярскую работу, 70-80 баллов по шкале Карновского)
|
|
2
|
Больной лечится
амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более
50% времени бодрствования проводит активно - в вертикальном положении (50-60
баллов по шкале Карновского)
|
|
3
|
Больной способен лишь к
ограниченному самообслуживанию, проводит в кресле или постели более 50%
времени бодрствования (30-40 баллов по шкале Карновского)
|
|
4
|
Инвалид, совершенно не
способен к самообслуживанию, прикован к креслу или постели (10-20 баллов по
шкале Карновского)
|
Это позволяет утверждать, что ответ на НАХТ может служить прогностическим
фактором дальнейшего течения заболевания.
В большинстве исследований неоадъювантное лечение показало преимущество
перед хирургическим лечением местно-распространенного рака желудка значительно
увеличив общую, 1-летнюю, 5-летнюю, безрецидивную выживаемость, частоту R0 резекций, down-staging TN-стадий при
умеренном риске осложнений.
.3 Режимы неоадъювантной химиотерапии
В настоящее время не разработаны стандарты химиотерапевтического лечения
РЖ, следовательно, имеется широкий спектр выбора схем лечения.
В связи с тем, что самой частой гистологической формой РЖ является
аденокарцинома, которая малочувствительна к химиотерапии, стандартом на
сегодняшний день является многокомпонентные схемы химиотерапии, перенести
которые легче в предоперационном периоде.
Наиболее распространённые схемы:
1). ECF
· эпирубицин 50 мг/м2 внутривенно каждые 3 недели;
· цисплатин 60 мг/м2 внутривенно каждые 3 недели;
· 5фторурацил в суточной дозе 200 мг/м2 постоянная внутривенно
инфузия в течение 18-21 недель.
2). Схема FOLFOX
· Оксалиплатин (100 мг/м2 в 1 день);
· Лейковорин (400 мг/м2 2-часовая инфузия в 1 день);
· Фторурацил (400 мг/м2 струйно + 3000 мг/м2 46-часовая
инфузия) каждые 14 дней.
3). DС (повторный курс каждые 3 недели)
· доцетаксел 75 мг/м2 внутривенно 1 день;
· цисплатин 75 мг/м2 внутривенно 1 день.
4). DСF
(проводится терапевтическими курсами каждые 4 недели)
· доцетаксел 75 мг/м2 внутривенно 1 день;
· цисплатин 75 мг/м2 внутривенно 1 день;
· 5фторурацил в суточной дозе 750 мг/м2 внутривенно инфузия 1-5
сутки.
Активно изучаются комбинации с фторпиримидинами, благодаря своим
фармакокинетическим свойствам имитирующими длительное воздействие 5фторурацила,
что позволяет заменить утомительные для персонала и пациента инфузии
5-фторурацила в составе ECF-программы на пероральный прием капецабина либо UFT
(депоформа, фторафура и урацил). Капецабин имеет хорошие показатели
свариваемости даже у пациентов с резекцией желудка. [60Wu A.W., Ji J.F. Neoadjuvant
chemotherapy for locally advanced ]
5) FLOT
· Доцетаксел 75 мг/м2 внутривенно капельно 1 день;
· Оксалиплатин 85 мг/м2 в 1 день;
· Лейковорин 200 мг/м2 2-часовая инфузия в 1 день;
· Цисплатин 75 мг/м2 внутривенно 1 день;
· 5фторурацил в суточной дозе 750 мг/м 2 внутривенно инфузия,
24 часа, 1-5 день. Повтор каждые 2 недели
Наибольшее практическое распространенные получили схемы, в состав которых
входят цисплатин, антрациклины и 5-фторурацил(ECF и CF).
Схема DCF (доцетаксел, цисплатин,
5-фторурацил) показала высокую эффективность у соматически сохранных пациентов
(ECOG 0-1), однако, является
высокотоксичной.
В этих схемах цисплатин и 5-фторурацил могут быть заменены на
оксалиплатин и кселоду (схемы EOX и EOF). У пожилых людей с
компрометированным соматическим статусом возможно применение схемы FLO (оксалиплатин и 5-фторурацил). При
обнаружении гиперэкспрессии или амплификации HER2/neu
необходимо добавить к проводимой схеме трастузумаб [2,53].
1.4 Методы оценки ответа опухоли на неоадъювантную
химиотерапию
Существуют различные методы оценки ответа опухоли на НАХТ.
) Патоморфологичекий регресс ( лечебный патоморфоз)
После начала химиотерапии развиваются последвовательные и прогнозируемые
изменения в тканях опухоли. Через 7 дней после начала лечения в опухолях,
внезависимости от их гистологической структуры, можно наблюдать типичные
дистрофические и альтеративные изменения паренхиматозных элементов на фоне
выраженных сосудистых изменений (резкое полнокровие, микротромбозы, плазмо- и
геморрагии) и воспалительную инфильтрацию. Через 2 недели и более от начала
неоадъювантной терапии очаги некроза окружаются волокнистой соединительной
тканью, образовывая заместительный склероз, гиалиноз. Вокруг групп опухолевых
клеток образуется лимфоцитарный периваскулярный валик. Следует обратить особое
внимание на градиентный характер альтеративных изменений в опухоли,
максимальное значение которых встречается в центре и убывает к периферии.
Описанные явления можно характеризовать как стереотипную динамическую
реакцию соединительной ткани на альтерацию опухолевой паренхимы, когда молодая
пролиферирующая соединительная ткань замещает очаги некрозов и кровоизлияний
(5-10-е сутки), а затем подвергается ремоделированию. Данные изменения и будут
являться патоморфологическим регрессом (лечебный патоморфоз), развивающимся в
опухоли на химиотерапию и имеют особое значение для определения эффективности
НАХТ [45].
Достоверная оценка лечебного патоморфоза должна включать гистологическое
исследование операционного материала.
Гистологическая оценка так же именуется - лечебным патоморфозом [5,4].
С целью повышения информативности оценки патоморфологического регресса
был разработан ряд гистологических систем, базирующихся на количественных или
качественных критериях, а также их комбинации. В основе всех систем
гистологической оценки регресса опухоли находится определение степени
клеточности опухоли и распространенности в ней некротических изменений.
Несмотря на методологические различия предложенных классификаций, все
авторы подчеркивают, что полный патоморфологический регресс означает полное
отсутствие опухолевых клеток в исследуемом материале.
Для первичной опухоли наиболее информативным является исследование
образцов резекции.
При оценке регресса опухоли также учитываются качественные изменения
опухолевых клеток, такие как вакуолизация и/или эозинофилия цитоплазмы, явления
пикноза ядер, некроз, а также степень воспалительной инфильтрации, в том числе
наличие гигантских клеток.
В РФ применяется классификация по I.D. Miller и соавторам, которая была
разработана с учетом показателей общей выживаемости пациентов, корелируя со
степенью патоморфологической регрессии опухоли, которая так же включается в
себя состояние лимфатических узлов [41].
• I
степень - малозаметные изменения отдельных опухолевых клеток без уменьшения их
числа;
• II степень - незначительное уменьшение количества опухолевых клеток, но в
целом клеточность опухоли остается высокой;
• III степень - сокращение числа опухолевых клеток вплоть до 90%;
• IV степень - на фоне выраженной (явной) регрессии опухоли выявляются лишь
единичные небольшие гнезда опухолевых клеток;
• V степень - опухолевые клетки отсутствуют в первичной опухоли и
лимфатических узлах.
Японским обществом исследований рака желудка (The Japanese Research Society for Gastric Cancer) разработана четырехуровневая система оценки патоморфологического
регресса для рака пищевода, которую так же применяют и для рака желудка, но с
несколько иными критериями группировки [24]:
• 1a - отсутствие резидуальных опухолевых
элементов;
• 1b - сохранено
менее 10% элементов опухоли;
• 2 -
сохранено 10-50% элементов опухоли;
• 3 - сохранено 50% и более объема опухолевой ткани.
При ее использовании в отношении к раку желудка было доказано, что
вероятность выживания значительно выше в случае регрессии опухоли более чем на ⅔
от первоначального размера [49].
Доминирующей морфологической особенностью при умеренной и слабой степени
лечебного патоморфоза после неоадъювантной терапии злокачественных
эпителиальных опухолей пищеварительной трубки является наличие больших площадей
жизнеспособных опухолевых элементов, чередующихся с зонами некроза, с
отсутствующими или незначительными участками фиброза. При высокой степени
лечебного патоморфоза с выраженными явлениями фиброза характерно резкое
уменьшение или полное исчезновение опухолевых элементов. Это позволило
выдвинуть концепцию, что некрозы опухолевой паренхимы, скорее всего,
связаны с недостаточным кровоснабжением опухоли, в то время как цитотоксические
эффекты химиотерапии реализуются с помощью других механизмов, таких как апоптоз
[47].
Основным гистологическим параметром регрессии опухоли на сегодня является
объемная доля сохранивших после ХТ жизнеспособных опухолевых элементов. Другие
параметры: выраженность некротических изменений, сосудистые изменения,
воспалительная инфильтрация, чаще всего рассматриваются в роли дополнительных
факторов и оценивают качественно или полуколичественно [14].
Таким образом, оценка регрессии опухоли подразумевает не только
определение эффективности терапии, но и прогнозирование течения заболевания,
что необходимо для планирования и коррекции последующих этапов лечения, а также
определения целесообразности оперативного лечения [28].
) Другим методом оценки НАХТ является определение объективного ответа
(ОО).
Для оценки ОО чаще всего используют лучевые методы, с помощью которых
регистрируют изменения размеров опухоли, а также могут быть использованы методы
выявления в крови онкомаркеров и ряда других показателей, таких как:
лактатдегидрогеназы, кальция, фосфора [10,13,21,22].
В 2008 г. была принята клиническая
классификация степеней ОО, которая представлена критериями оценки ответа
солидных опухолей (Response
Evaluation Criteria In Solid Tumors - RECIST),
в которой стали использовать двухмерные измерения вместо трехмерных, уменьшено
количество измеряемых очагов, сняты критерии прогрессии [31]. В
соответствии с этой классификацией различают:
• полный ответ (Complete Response-CR): исчезновение всех основных очагов. Любой из
увеличенных лимфатических узлов (основных или дополнительных) должен иметь
короткую ось менее 10 мм;
• частичный ответ (Partial Response-PR): уменьшение суммы диаметров основных очагов не менее
чем на 30%;
• прогрессирование заболевания (Progressive Disease -PD): увеличение
на 20% и более суммы диаметров основных очагов, которая в абсолютном выражении
составляет не менее 5 мм; появление одного или нескольких
новых очагов;
• SD: стабилизация заболевания (Stable Disease - SD):
исчезновение всех дополнительных очагов и нормализация уровня опухолевых
маркеров. Все лимфатические узлы должны иметь размер менее 10 мм по короткой оси; Так же должна проводиться оценка
дополнительных очагов (качественная):
• Non-CR/Non-PD: сохранение одного или нескольких основных очагов
и/или сохранение уровня опухолевого маркера выше нормы;
PD: однозначная прогрессия дополнительных очагов, появление одного или
нескольких новых очагов.
Однако возможности лучевых методов при оценке ОО ограничены в своей
способности обеспечить точную информацию о Т и N категориях, и при ответе, расцененном как полный лучевыми
методами, часто гистологически в операционном материале выявляются элементы
опухоли [37].
В ряде случаев после достижения хорошего ОО могут возникнуть рецидивы
опухоли и отдаленные метастазы, которые быстро развиваются и проявляют высокую
резистентность к терапии, это наталкивает на мысль, что целесообразно уделять
внимание биологическим свойствам резидуальных опухолевых клеток, выявляемых
иммуногистохимическими, молекулярными и генетическими маркерами [32].
Таким образом, на сегодняшний день лечение МРРЖ остается нерешенной
проблемой, как отмечалось ранее, показатели лекарственного патоморфоза и ОО
являются важным критериями в определении эффективности химиотерапии и
определении прогноза онкологического заболевания, в связи с этим актуальным
вопросом является необходимость проведения НАХТ.
Глава 2. Клинические исследования
2.1
Характеристика клинического материала и методов
В исследование включено 132 пациента МРРЖ. Оценка эффективности НАХТ
проводилась на базе
СПбГБУЗ «Городской Клинический Онкологический Диспансер».
Для решения поставленных цели и задач исследования, был проведен
ретроспективный анализ данных по ведению больных и гистологических заключений больных раком желудка по отчетным формам № 7, № 35 с 2003
года по 2017 год.
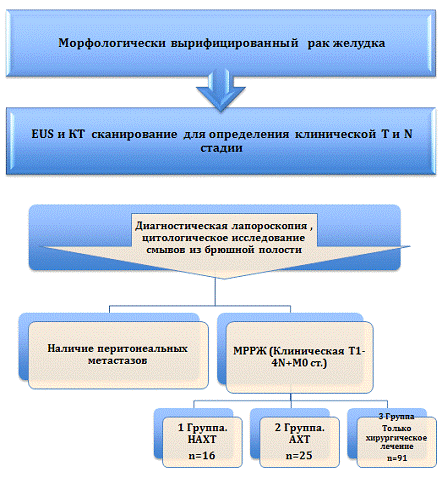
Рис.5 - Дизайн исследования
Были проанализированы данные 132 пациентов, получавших лечение в
химиотерапевтическом и хирургическом отделениях. Было выделено три основные
группы больных:
1 группа - 16 пациентов, получавших неоадъювантное химиотерапевтическое
лечение (НАХТ) по схеме FLOT.
Все больные получили по 3 цикла ХТ до хиругического лечения и по 3 цикла после
хирургического вмешательства (гастрэктомии , либо субтотальной гастрэктомии с
лимфодиссекцией D2).
В этой группе пациентов была проведена оценка объективного ответа и по
системе RECIST, а так же оценен лечебный
патоморфоз.
группа - 25 больных, получавшие только адъювантную химиотерапию (АХТ).
группа - 91 пациент, получавший только хирургическое лечение, по поводу
рака желудка в онкохирургическом отделении СПбГКОД. Оперативное вмешательство
проводилось по принятой стандартной методике.
Во всех трех группах после проведения хирургического вмешательства была
проведена оценка краев резекции.
Пациентам всех трех групп проводилось:
) стандартное обследование:
КТ ОБП и ОГК;
УЗИ ОБП;
УЗИ/МРТ (у женщин) малого таза;
ФГДС с биопсией, гистологическая верификация.
Определение показателя индекса пролиферативной активности Ki67
определение наличия мутации Her2/neu
- Больным получавшим НАХТ на втором этапе лечения (хирургическом) был
определен патоморфологический регресс.
2) выполнялась диагностическая лапароскопия, в ходе которой подтверждали
факт региональной опухолевой лимфаденопатии, оценивали состояния брюшины,
повреждение первичной опухолью серозного слоя желудка, забор смывов с брюшины
для цитологического исследования на предмет наличия свободных опухолевых
клеток.
Таблица 4. Общая характеристика больных МРРЖ при оценке НАХТ.
|
Группа 1
|
Группа 2
|
Группа 3
|
|
НАХТ (n=16)
|
АХТ (n=25)
|
Хир. Лечения (n=91)
|
|
Возраст
|
59 (37-69)
|
54 (28-84)
|
61 (31-75)
|
|
Пол
|
|
|
|
|
М
|
9 (56%)
|
13 (52%)
|
43 (47%)
|
|
Ж
|
7 (44%)
|
12 (48%)
|
48 (53%)
|
|
Локализация опухоли
|
|
Верхняя треть
|
5 (31,25%)
|
4 (16%)
|
20 (22%)
|
|
Средняя треть
|
2 (12,5%)
|
11 (44%)
|
29 (31.8%)
|
|
Нижняя треть
|
9 (56,25%)
|
10 (40%)
|
42 (46,2%)
|
|
Клиническая TNM
стадия
|
|
T2
|
4
|
9
|
29
|
|
T3
|
8
|
10
|
47
|
|
T4
|
5
|
15
|
|
N1
|
3
|
8
|
21
|
|
N2
|
7
|
9
|
53
|
|
N3
|
6
|
8
|
17
|
|
Объем хиругического
вмешательства
|
|
ГЭ +ЛД D2
|
7 (43%)
|
8 (32%)
|
36 (40%)
|
|
РЖ+ЛД D2
|
9 (57)
|
17 (68%)
|
55 (60%)
|
2.2
Статистическая обработка
Статистический анализ проводили на персональном компьютере с
использования программы MedCalc
12.0.
Статистический анализ качественных показателей проводился на основе
данных, сгруппированных в таблицы сопряженности, с применением критерия
согласия Пирсона (хи-квадрат).
Для оценки межгрупповых различий изучаемых показателей применяли
непараметрический критерий Манна-Уитни без использования поправки Йейца, т.к. группы состояли более
чем из 5 человек.
Критический уровень значимости (р) нулевой статистической гипотезы (об
отсутствии значимых различий) принимали равным 0,05.
Графическая обработка данных проводилась при помощи программы MicrosoftOfficeExcel 2010 и MedCalc.
Глава 3. Результаты собственного исследования
В ходе проведенного исследования, получены следующие результаты. Так, в
1-ой, 2-ой и 3-ей группах (132 пациентов) с морфологически подтвержденным
диагнозом РЖ возрастной разброс больных составил от 28 до 84 лет (средний
возраст - 56,8 лет). Гендерный показатель: мужчин - 65 (49,3%), женщин - 67 (50,7%). Полученные результаты
представлены на рисунке 6.
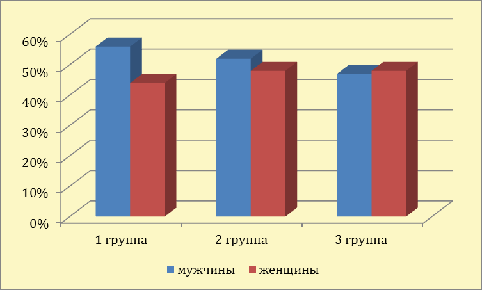
Рис. 6 - Гендерный состав больных с МРРЖ в 1-ой, 2-ой и 3-ей группах
обследуемых
У 54,4% (72 чел.) больных 1-ой,2-ой и 3-ей групп заболевание было
верифицировано как низкодифференцированная аденокарцинома,
перстневидно-клеточный РЖ выявлен у 21,5% пациентов (28 человек), умеренно
дифференцированная аденокарцинома обнаружена в 10,7% случаях (14 человек),
высоко дифференцированная в 13,4% (17 человек). Результаты представлены на
рисунке 6.
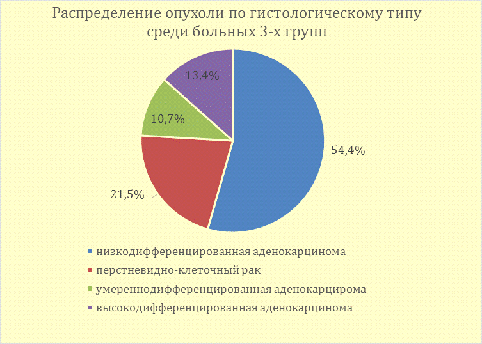
Рис. 7 - Распределение опухоли по гистологическому типу у больных 1-ой,
2-ой и 3-ей групп
Дальнейшему анализу была подвергнута локализация опухоли у исследуемых
больных. Так, наиболее частой локализацией является нижняя треть желудка 61
случаев (46,4%), средняя треть встречается у 42 больных (31,6%), а верхняя
треть у 29 больных (22%).

Рис. 8 - Локализация первичной опухоли желудка среди обследуемых
У 1 пациента обнаружена HER2/neu мутация в группе больных, которым
проводилась НАХТ (2,4%).
Данные показатели позволяют нам судить о клинико-морфологических
особенностях, однако для того, что оценить эффективность НАХТ необходимо
сравнить следующие показатели:
1)Оценить патоморфологический ответ, объективный ответ, частоту R0-
резекций при проведении неоадъювантной химиотерапии.
)Оценить длительность послеоперационного периода и частоту осложнений.
)Оценить безрецидивную выживаемость в различных группах больных с МРРЖ.
)Оценить однолетнюю выживаемость в трех группах больных МРРЖ.
В группе больных, получавших НАХТ при проведении 2 этапа комплексного
лечения (хирургического этапа лечения) у всех пациентов была проведена оценка
патоморфологического регресса, объективного ответа, а так же оценены края
резекции. Были получены следующие результаты: из 16 пациентов, у 5 (31,25%)
процесс был верифицирован патоморфологами как 1 по классификации лечебного
патоморфоза, у 3 пациентов (18,75%) - 2 , у 2 (12,5%) - 3, а у 6 пациентов
(37,5%) - процесс был верифицирован как 4, т.е. как полной патоморфологический
регресс.(Табл.5)
Таблица 5. Оценка патоморфологического регресса у больных МРРЖ,
получавших НАХТ.
|
Патоморфологический регресс
|
Количество больных
|
|
1
|
5 (31,25%)
|
|
2
|
3 (18,75%)
|
|
3
|
1 (12,5%)
|
|
4
|
6 (37,5%)
|
При оценке ОО группы больных, получавших НАХТ, были получены следующие
результаты, представленные в табл.6.
Таблица 6. Показатели ОО у больных, получавших НАХТ.
|
Показатель ОО
|
Количество больных
|
|
PD
|
4 (25%)
|
|
PR
|
7 (43,75%)
|
|
CR
|
2 (12,5%)
|
|
SD
|
3 (18,75%)
|
Оценка ОО проводилась по классификации RECIST:
• полный
ответ (Complete Response-CR)
• частичный ответ (Partial Response-PR)
• прогрессирование заболевания (Progressive Disease -PD)
SD: стабилизация заболевания (Stable Disease - SD)
Частота R0- резекций в 1-ой, 2-ой и 3-ей группе больных составила 100% .
Общий показатель ОО (overall response
rate) отображает сумма PR, CR, который равен 56,25% (9 больных).
Показатель контроля заболевания (Disease control rate) оценивается суммой SD,PR,CR и составляет 75% .
Во всех трех группах больных проводилась оценка длительности
послеоперационного периода и частота послеоперационных осложнений .
Средняя длительность послеоперационного периода в 1-ой, 2-ой и 3-ей
группах больных составила 10 дней.
Послеоперационных осложнений во 2-ой и 3-ей группах больных зафиксировано
не было , в то время как в 1-ой группе больных у 1 пациента развился
подпеченочные абсцесс, что составляет 6,25%. Тем не менее, различия в данных
показателях являются статистически не достоверными.(p>0,05).
За период динамического одногодичного наблюдения в 1 группе больных
(получавших НАХТ) прогрессирование было зарегистрировано в 5 случаях, среднее
значение безрецидивной выживаемости (БВ)составило 9,8 мес. ( средняя ошибка 1,
95) . За период динамического наблюдения 1 пациент умер , что составляет 6,25%.
Во второй группе больных (получавших АХТ) ср. БВ составило 5 мес.
(средняя ошибка 1,08). Различия в БВ между этими группами является
статистическими достоверными, рассчет проводился при использлвании
непараметрического критерия Манна-Уитни, р < 0,05 (0,0397).
В группе больных, получавших АХТ, за время динамического наблюдения 6
пациентов умерли, что составляет 24 %.
В группе пациентов, получивших только хирургический метод лечения в
первый год динамического наблюдения умер 31 больной , что составляет 34% .
Таким образом, однолетняя выживаемость групп больных с МРРЖ составила
93,75%;76%;66 % соответственно.
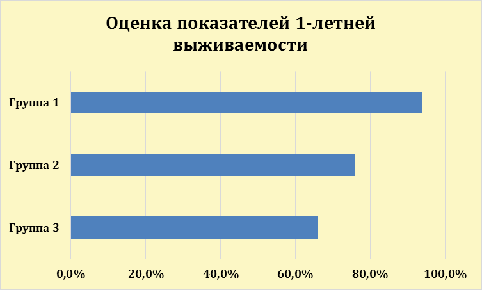
Рис.9 -Оценка показателей 1-летней выживаемости больных МРРЖ
Показатели достоверности при изучении 1-летней выживаемости имеют
следующие значения (применялся критерий согласия Пирсона):
При сравнении 1 и 2 групп р> 0,2 (0,1406)
При сравнении 1 и 3 групп p<0,03
(0,0250). Показатель статистически достоверный.
При сравнении 2 и 3 групп p>0,3
(0,3388)
Таблица 7. Сопоставительная таблица показателей в различных группах
больных МРРЖ.
|
Показатель
|
1 Группа
|
2 группа
|
3 группа
|
Показатель достоверности
|
|
Длительность
послеоперационного периода
|
10 дней
|
10 дней
|
10 дней
|
|
|
Частота R0
резекций
|
100%
|
100%
|
100%
|
|
|
Безрецидивная выживаемость
|
9,8+/-
1,95
|
5+/- 1,08
|
|
р < 0,05 (0,0397)
|
|
1-летняя выживаемость
|
94%
|
76%
|
66%
|
При сравнении 1 и 3 гр. p<0,03
(0,0250).
|
В группе пациентов РЖ было проведено клиническое стадирование (cTMN) заболевания перед началом лечения.
После проведения хирургического этапа лечения по результатам
патоморфологического исследования производилось рестадирование (pTMN).
При анализе данных результатов в группе больных, получавших НАХТ, можно
судить об эффективности НАХТ, оценив дестадирование (down-staging)
процесса.
Результаты стадирования и рестадирования представлены в таблице 8.
Таблица 8.Сравнительная таблица cTMN и рTMN в 1 группе больных.
|
Стадия
|
Число больных
|
Процентный показатель
|
Число больных2
|
Проц. Показатель
|
|
сТMN
|
|
pTMN
|
|
|
T0
|
0
|
|
0
|
|
|
T1
|
0
|
|
3
|
18,75%
|
|
T2
|
4
|
25%
|
6
|
37,50%
|
|
T3
|
5
|
50%
|
5
|
31,25%
|
|
T4
|
4
|
25%
|
2
|
12,50%
|
|
N1(1-2 ЛУ)
|
3
|
19%
|
4
|
25%
|
|
N2(3-6 ЛУ)
|
7
|
43,75%
|
9
|
56,25%
|
|
N3(7-8 ЛУ)
|
6
|
37,50%
|
3
|
18,75%
|
Статистический анализ результатов проводился при использовании критерия
согласия Пирсона, результаты показателей достоверности представлены в таблице
9.
Таблица 9.Показатели статистической достоверности (р) при анализе
результатов рестадирования больных МРРЖ, получавших НАХТ.
|
Сопоставление между
стадиями
|
Показатель стат.
Достоверности (р)
|
Результат
|
|
Т2-Т3
|
p>0,5 (0,5509)
|
Результат статистически не
достоверный
|
|
Т3-Т4
|
p>0,6
(0,6887)
|
Результат статистически не
достоверный
|
|
N1-N2
|
p>0,1
(0,1753)
|
Результат статистически не
достоверный
|
|
N2-N3
|
p>0,7
(0,7968)
|
Результат статистически не
достоверный
|
|
N1-N3
|
p>0,1
(0,1336)
|
Результат статистически не
достоверный
|
Как видно, при анализе результатов рестадирования, не было получено
достоверных данных, в пользу того, что НАХТ приводит к дестадированию
заболевания. Однако, при сравнении показателей рестадирования групп больных,
имевших N2 и N3 стадии - значение p>0,1, что свидетельствует о значимой тенденции к снижению стадии, а
результаты могли оказаться не достоверными с вязи с малой группой выборки.
Заключение
Проблемы лечения больных МРРЖ до сих пор остается нерешенной. Высокий
процент заболеваемости, поздняя выявляемость, раннее метастазирование, высокие
показатели смертности от этой формы онкологического заболевания диктуют
необходимость более детального подхода в изучении тактики ведения больных.
Наиболее оптимальным методом решения большинства проблем, имеющих
отношение к эффективности лечения, является персонализация проводимой терапии.
Путем определения наиболее перспективных групп с позиции прогноза заболевания, возможно
получение максимального эффекта в виде значительного улучшения качества и
продолжительности жизни больных.
В данной работе, получено несколько значимых выводов.
Была произведена оценка ОО у больных, получавших НАХТ, которая показала,
что ОО был получен более
чем у половины пациентов.
Частота R0- резекций при проведении неоадъювантной химиотерапии составила
100 %, как и в группах с АХТ и изолированно хирургического лечения.
Длительность послеоперационного периода во всех группах составила 10 дней,
а частота послеоперационных осложнений не имеет статистически достоверных
различий, это позволяет утверждать, что НАХТ не влияет на течение
послеоперационного периода.
Изучив безрецидивную выживаемость, были получены результаты, позволяющие
сделать выводы о достоверно лучших результатах лечения в группе НАХТ в
сравнении с АХТ.
Показатели однолетней выживаемости в группе больных, получавших НАХТ
достоверно значимо выше однолетней выживаемости в группе больных, получавших
изолированно хирургическое лечение.
Полученные результаты лечения при проведении НАХТ при МРРЖ позволяют
расценить данную программу как эффективный метод.
Проведенное эмпирическое исследование по поводу НАХТ при МРРЖ позволяет
сделать следующие выводы:
. При изучение клинико-морфологических особенностей пациентов МРРЖ
были сделаны следующие выводы: возрастные вариации были значимы и приходились
на цифры от 28 до 84 лет, средний возраст пациентов составил 56,8 лет; наиболее
частой формой РЖ, которая была морфологически верифицирована у 72 пациентов
стала низкодифференцированная аденокарцинома (54,4% больных); самой встречаемой
локализацией опухоли оказалась нижняя треть желудка, которая встречалась у 61
человека (46,4%).
2. Полный патоморфологический регресс после НАХТ был получен у 6
пациентов. Полный патоморфологический ответ позволяет верифицировать группу
больных с более низким риском местно-регионарного рецидивирования, в нашей
группе этот процент составляет 37,5%.
Общий показатель ОО (overall response
rate) отображает сумма PR, CR, который равен 56,25% (9 больных).
Показатель контроля заболевания (Disease control rate) оценивается суммой SD,PR,CR и составляет 75% . Что позволяет
утверждать, что у 56,25% пациентов был получен ответ на проведенную НАХТ.-
резекций при проведении неоадъювантной химиотерапии составила 100 %.
. Длительность послеоперационного периода во всех группах составила
10 дней, а частота послеоперационных осложнений не имеет статистически
достоверных различий, это позволяет утверждать, что НАХТ не влияет на течение
послеоперационного периода.
4. Безрецидивная выживаемость в 1-ой группе больных с МРРЖ,
получавших НАХТ составила 7,85- 11,75 мес., а во 2-ой группе больных (АХТ) 3,93
- 6,08 мес; полученные данные, позволяют сделать вывод о достоверно лучших
результатах лечения в группе НАХТ в сравнении с АХТ (P<0.04).
. Показатели однолетней выживаемости в группе больных, получавших
НАХТ и АХТ составили 94% и 76% соответственно ( р> 0,2 (0,1406)), что не
является статистически достоверным, однако, прослеживается динамика повышения
показателя 1-летней выживаемости в группе больных, получавших НАХТ в сравнении
с АХТ.
НАХТ достоверно значимо повышает уровень однолетней выживаемости в
сравнении с данным показателем в группе больных, получавших изолированно
хирургическое лечение. В 1-ой группе показатель однолетней выживаемости
составил 94%, в 3-ей группе - 66%. Разница является статистически достоверной
р<0,03 (0,0250 ).
Список использованной литературы
1.Бесова
Н.С., Бяхов М.Ю. и соавторы. Общероссийский союз общественных объединений ассоциация онкологов России:
клинические рекомендации по диагностике и лечению больных раком желудка. Москва
2014.
. Бяхов
М.Ю., Бесова Н.С., Владимирова Л.Ю., Волков Н.М., Левченко Е.В., Сакаева Д.Д. и
соавт. Практические рекомендации по лекарственному лечению рака желудка.
Злокачественные опухоли. 2015; 4, спецвыпуск; С. 210-213.
3. Вашакмадзе
Л.А, Бутенко А.В. Место циторедуктивных операций в лечении больных раком желудка IV стадии. МНИОИ им. П.А. Герцена,
Москва. Клиническая статья. 2001.
4. Волков
Н.М., Суспицын Е.Н., Иевлева А.Г. и др. Выбор терапии у больных раком
желудка на основе молекулярно- генетических маркеров // Материалы XIV Российского онкологического конгресса. М.,
2010. С. 161-165.
5. Галахин
К.А., Курик Е.Г. (2000) Лечебный патоморфоз злокачественных опухолей
пищеварительного тракта. Киев.: Книга-плюс, 176 с.
6. Ганцев
Ш.Х., Арыбжанов Д.Т., Кулакеев О.К., Юнусметов И.Р. Результаты лечения больных
раком желудка IV стадии. Сибирский онкологический журнал. 2009; 2(32); 67-69.
7. Давыдов
М.И., Аксель Е.М. Заболеваемость злокачествеными новобразованиями населения
России и стран СНГ в 2006г. // Вестник РОНЦ им. Н. Н. Блохина РАМН. 2008 г. Т.
19 №2. (прил. 1 ). С. 52-90
. Давыдов
М.И., Тер-Ованесов М.Д. // Современная стратегия хирургического лечения рака
желудка // Современная онкологи. 200. Т.2, №1. С. 4-10
. Давыдов
М.И., Тер-Ованесов М.Д., Абдихакимов А.Н., Марчук В.А. // Рак желудка:
операционное обследование и актуальные аспекты стадирования // Российский
онкологический научный центр им. Н.Н. Блохина, Москва. Практическая онкология
№3(7) (снтябрь) 2001 г.
10. Журкина
О.В. Лактатдегидрогеназа крови и мочи при доброкачественных и злокачественных
новообразованиях почки // Казанский медицинский журнал, 2007. - № 3. - С.
241-243.
11. Каприн
А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2012 году.
М.: ФГБУ «МНИОИ им. П.А. Герцена» Минздравсоцразвития России; 2013. 232 с.
12. Карачун
А. М. Дифференцированная хирургическая тактика лечения больных раком желудка.
Дисс. … док. мед. наук. - Санкт-Петербург. 2014.-397 с.
13. Кондратьев
В.Б. Метастазы в кости: осложненные формы, гиперкальциемия, синдром компрессии
спинного мозга, медикаментозное лечение. Практическая онкология, 2000. - № 2. -
С. 41-45.
14. Лушников
Е.Ф. (1977) Лучевой патоморфоз опухолей человека. М.: Медицина, 328с.
15. Мерабишвили В. М. Рак желудка : эпидемиология, профилактика, оценка
эффективности лечения на
популяционном уровне / В. М. Мерабишвили // Практическая
онкология. - 2001. - № 3 (7) - С. 1-6.
16. Мозеров
С.А., Комин Ю.А., Мозерова Е.С., Красовитова О.В. Морфологические и клинические
изменения рака желудка после неоадъювантной химиолучевой терапии (обзор
литературы) // Международный журнал прикладных и фундаментальных исследований.
- 2016. - № 6-1. - С. 59-
17. Орлова
Р.В.,Рыков И.В., Наталенко К.Е. Неоадъювантная химиотерапия
местно-распространенного рака желудка ФГБУЗ Клиническая больница № 122 им. Л.Г.
Соколова ФМБА России. 2016 год . - № 6-. - С. 597-
18. Орлова
Р.В., Кащенко В.А. Рак желудка: практические рекомендации ФГБОУ ВПО
Санкт-Петербургский Государственный университет ФГБУЗ Клиническая больница №
122 им. Л.Г. Соколова ФМБА России. 2014 год.
19. Роман
Л.Д., Карачун А.М., Самсонов Д.В., Шостка К.Г., Богородский Д.Ю., Павленко А.Н.
Отдаленные результаты хирургического лечения больных
местно-распространенным раком желудка, 2010 УДК 616.33-006.6-089.168.1
20. Cайт Федеральной службы
государственной статистики. - Режим доступа : www.gks.ru
21. Семенова
А.И. (2006) Гиперкальциемия и синдром распада опухоли. Практическая онкология,
7(2): 101-104.
22. Степанов
И.В., Завьялова М.В., Григорьева Е.С. и др. Клинико-морфологические и
молекулярно-генетические особенности интестинального и диффузного типа карцином
желудка // Сибирский онкологический журнал. 2010. No 4 (40). С. 55-66.
23. Чиссов
В.И., Старинский В.В., Петрова Г.В.. Злокачественные заболевания в России в
2011 году (заболеваемость и смертность) - М.: ФГБУ «МНИОИ им. П.А. Герцена»
МинздраваРоссии, 2013. - 289 с.
24. AJCC
cancer stafing handbook. TNM classification of malignant tumors. 7th ed.
Spinger; 2009.
25. Bang
Y-J, Cutsem E, et al. The Lancet 2010; 376: 687-697;
26. Bataille
F, Rümmele P, Dietmaier W, et al.
Alterations in p53 predict response to preoperative high dose chemotherapy in
patients with gastric cancer. Mol Pathol. 2003; 56; 286-292.
27.
Boige, V. and Pignon, J. P. Final results of a randomized trial comparing
preoperative 5-fluorouracil (F)/cisplatin (P) to surgery alone in
adenocarcinoma of stomach and lower esophagus (ASLE): FNLCC ACCORD07-FFCD 9703
trial. Proceedings of the ASCO 2007 Annual Meeting.
28. Bollschweiler
E., Hölscher A.H, Metzger R. (2010)
Histologic tumor type and the rate of complete response after neoadjuvant
therapy for esophageal cancer. Future Oncology, 6 (1): 25-35.
29. Cunningham
D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJ, Nicolson M, Scarffe JH,
Lofts FJ, Falk SJ, Iveson TJ, et al. Perioperative chemotherapy versus surgery
alone for resectablegastroesophageal cancer. N Engl J Med. 2006; 355:11-20.
30. D'Ugo
D, Rausei S, Biondi A, Persiani R. Preoperative treatment and surgery in
gastric cancer: friends or foes? Lancet Oncol. 2009; 10; 191-195.
. Eisenhauer
E.A., Therasse P., Bogaerts J. et al. (2009) New response evaluation criteria
in solid tumours: Revised RECIST guideline (version 1.1). European journal of
cancer, 45: 228-247.
32. Fearon
K, Strasser F, Anker SD, et al. Definition and classification of cancer cachexia: an
international consensus. Lancet Oncol. 2011; 12(5):489-95.
. Ferlay
J., Shin H.R., Bray F., Forman D., Mathers C. and Parkin D.M. GLOBOCAN 2008,
Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 10 [Internet].
Lyon, France: International Agency for Research on Cancer; 2010. Available
from.
34. Karpen
M.S., Kelsen D.P.,Teppes J.A., et al. Cancer of the stomach in «Cancer
Principles a Practice of Oncology», 6 ed. 2001, 1092-1126.
. Kim
S., Lim D.H., Lee J. et al. An observational study suggesting clinical benefit
for adjuvant postoperative chemoradiation in a population of over
500 cases after gastric resection with D2 nodal dissection for adenocarcinoma
of the stomach // Int. J. Radiat. Oncol. Biol. Phys. ― 2005. ― Vol.
63. ― Р.
1279-1285.
. Kumagai
K, Rouvelas I, Tsai JA, Mariosa D, Lind PA, Lindblad M, Ye W, Lundell L,
Schuhmacher C, Mauer M, et al. Survival benefit and additional value of
preoperative chemoradiotherapy in resectable gastric and gastro-oesophageal
junction cancer: a direct and adjusted indirect comparison meta-analysis. Eur J
Surg Oncol. 2015; 41; 282-294.
. Kwok
H., Bissett I.P, Hill G.L. (2007) Preoperative staging of rectal cancer. Int J
Colorectal Dis, 15: 9-20.
38. Landry
J, Tepper JE, Wood WC, Moulton EO, Koerner F, Sullinger J. Patterns of failure
following curative resection of gastric cancer. Int J Radiat Oncol Biol Phys
1990; 191; 1357-1362.
. Lee
J., Lim do H., Kim S. et al. Phase III trial comparing capecitabine plus
cisplatin versus capecitabine plus cisplatin with concurrent capecitabine
radiotherapy in completely resected gastric cancer
with D2 lymph node dissection: the ARTIST trial // J. Clin. Oncol. ―
2012. ―Vol. 30. ― P. 268-273.
40. Luinetti
O, Fiocca R, Villani L, Alberizzi P, Ranzani GN, Solcia E. Genetic pattern,
histological structure and cellular phenotype in early and advanced gastric
cancers: evidence for structure-related genetic subsets and for loss of
glandular structure during progression of some tumors. Hum Pathol. 1998; 29;
702-709.
. Miller
I.D., Payne S., Ogston K.N. (2002) A new histological grading system to assess
response of breast cancer to primary chemotherapy. Int J Oncol., 20 (4):
791-796.
42. Orditura
M, De Vita F, Muto P, et al. Adjuvant chemoradiotherapy in patients with stage
III or IV radically resected gastric cancer: a pilot study. Arch Surg. 2010;
145; 233-238.
43. Ott
K, Sendler A, Becker K, et al. Neoadjuvant chemotherapy with cisplatin, 5-FU
and leucovorin (PLF) in locally advanced gastric cancer: a prospective phase II
study. Gastric Cancer. 2003; 6; 159-167.
.
Park S.H., Sohn T.S., Lee J. et al. Phase III Trial to Compare Adjuvant
Chemotherapy With Capecitabine and Cisplatin Versus Concurrent
Chemoradiotherapy in Gastric Cancer: Final Report of the Adjuvant
Chemoradiotherapy in Stomach Tumors Trial, Including Survival and Subset
Analyses // J. Clin. Oncol. ― 2015. ―
Vol. 33. ― Р. 3130-3136. doi: 10.1200/JCO.2014.58.3930.
. Pawlik
T.M., Scoggins C.R., Zorzi D. et al. (2005) Effect of surgical margin status on
survival and site of recurrence after hepatic resection for colorectal
metastases. Ann Surg., 241 (5): 715-722. discussion 722-724.
46. Proc.
ASCO 2000, abs. 957, 1030, 1031, 1058, 1074, 1087, 1130, 1147, 1194, 1280.
. Rubbia-Brandt
L., Giostra E., Brezault C. et al. (2007) Importance of histological tumor
response assessment in predicting the outcome in patients with colorectal liver
metastases treated with neo-adjuvant chemotherapy followed by liver surgery.
Ann Oncol., 18 (2): 299-304.
48. Sano
T., Sasako M., Yamamoto S., Nashimoto A., Kurita A., Hi- ratsuka M. et al.
Gastric cancer surgery: morbidity and mortality results from a prospective
randomized controlled trial comparing D2 and extended para-aortic lymphadenectomy
- Japan Clinical Oncology Group study 9501. J. Clin. Oncol. 2004; 22: 2767-73.
. Schneider
P., Baldus S., Metzger R. et al. (2005) Histomorphologic tumor regression and
lymph node metastases determine prognosis following neoadjuvant
radiochemotherapy for esophageal cancer: implications for response
classification. Ann. Surg., 242: 684-692.
50. Schuhmacher
C, Gretschel S, Lordick F, Reichardt P, Hohenberger W, Eisenberger CF, Haag C,
Mauer ME, Hasan B, Welch J, et al. Neoadjuvant chemotherapy compared with
surgery alone for locally advanced cancer of the stomach and cardia: European
Organisation for Research and Treatment of Cancer randomized trial 40954. J
Clin Oncol. 2010; 28; 5210-5218.
51.
Schuhmacher, C., Schlag, P., Lordick, F., Hohenberger, W., Heise, J. and Haag,
C. Neoadjuvant chemotherapy versus surgery alone for locally advanced
adenocarcinoma of the stomach and cardia: Randomized EORTC phase III trial
#40954. In: Proceedings of the ASCO 2009 Annual Meeting.
52. Suh
YS, Yang HK. Screening and Early Detection of Gastric Cancer. Surgical Clinics
of North America 2015; 95(5); 1053-1066.
53. Tanner
M et al. Amplification of HER-2 in gastric carcinoma: association with
Topoisomerase IIa gene amplification, intestinal type, poor prognosis and
sensitivity to trastuzumab. Ann Oncol 2005; 16: 273-8.
54.
Tzanakis
N.E., Peros G., Karakitsos P. et al. Prognostic sig- nificance of p53 and Ki67
proteins expression in Greek gastric cancer patients // Acta Chir. Belg. 2009.
Vol. 109 (5). P. 606-611.
55. van
Hagen P, Hulshof MC, van Lanschot JJ, Steyerberg EW, van Berge Henegouwen MI,
Wijnhoven BP, Richel DJ, Nieuwenhuijzen GA, Hospers GA, Bonenkamp JJ, et al.
Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J
Med. 2012; 366; 2074-2084.
56. Wu
A.W., Ji J.F. Neoadjuvant chemotherapy for locally advanced gastric cancer: With or
without radiation. World J. Gastrointest. Surg. 2012; 4 (2). Р. 27-31
57. Yoshida
S., Yamaguchi H., Saito D., Kido M. Endoscopic diagnosis: latest trends//
Gastric Cancer/ Nishi M., Ichikawa H. et al. (eds.). - Springer-Verlag, 1993. -
P. 246-262.
58. Zhu W.G., Xua D.F., Pu J.
et al. A randomized, controlled, multicenter study comparing
intensity-modulated radiotherapy plus concurrent chemotherapy with chemotherapy
alone in gastric cancer patients with D2 resection // Radiother. Oncol. ―
2012. ― Vol. 104. ― P. 361-366.