Теория горения и взрыва
МИНОБРНАУКИ
РОССИИ
ФГБОУ ВО
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСИЙ УНИВЕРСИТЕТ (ПЕНЗГТУ)
ФАКУЛЬТЕТ
БИОМЕДИЦИНСКИХ И ПИЩЕВЫХ
ТЕХНОЛОГИЙ И
СИСТЕМ
КАФЕДРА
«БИОТЕХНОЛОГИИ И ТЕХНОСФЕРНАЯ БЕЗОПАСНОСТЬ»
ИТОГОВАЯ
КОНТРОЛЬНАЯ РАБОТА
ДИСЦИПЛИНА:
«ТЕОРИЯ ГОРЕНИЯ И ВЗРЫВА»
Выполнила: студентка группы 14ЗТ1бп
Кондрашова А.О.
Проверил: доцент кафедры БТБ
Борисков Д.Е.
Пенза 2016
г.
Задания на контрольную работу
|
Номер
задания
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Номер
по варианту
|
9
|
0
|
1
|
2
|
3
|
2
|
5
|
Рассчитать коэффициент горючести нитробензола
С6Н5NО2 и сероуглерода CS2.
Для расчета коэффициента горючести можно
использовать сле- дующую формулу:
K = 4n(C) ++
4n(S)++
n(H)++
n(N) -2n(O)--2n(Cl)-3n(F)-5n(Br) (1)
где n(C), n(S), n(H), n(N), n(O), 2 n(Cl), n(F),
n(Br) - число атомов соот- ветственно углерода, серы, водорода, азота,
кислорода, хлора, фтора и брома в молекуле вещества. Если коэффициент горючести
К больше или равен единице (К ³ 1), то вещество является
горючим. При значении К меньше единицы (К < 1) - вещество негорючее. 1. В
молекуле нитробензола содержится атомов: углерода n(C) = 6; водорода n(Н) = 5;
кислорода n(О) = 2, азота n(O)=1.
Подставляя количество атомов в формулу , имеем К = 4·6 +1∙5+1∙1 -
2·2 = 26. К > 1, следовательно, нитробензол - горючее вещество.
В молекуле сероуглерода содержится атомов:
углерода n(C) = 1; серы n(O)=2
Подставляем количество атомов в формулу:
К=4∙1+4∙2=12
К > 1, следовательно, сероуглерод - горючее
вещество.
Рассчитать объём воздуха и продуктов горения (в
об. %), образующихся при сгорании 10 кг вещества , если горение происходит при
заданных условиях и коэффициенте избытка воздуха a. Объём
продуктов горения считать приведённым к заданным условиям.
Табл.2
|
Номер
варианта
|
Название
вещества
|
Химическая
формула
|
Температура
t
°С
|
Давление
P,
кПа
|
a
|
|
9
|
Пропилацетат
|
С5Н10О2
|
50
|
115,0
|
1
|
реакция
горение толуол газ
Решение.
Составляем уравнение реакции горения
пропилацетата в воздухе:
С5Н10О2 + 6,5 (О2 + 3,76 N2)
= 5CО2 + 5Н2О + 6,5×3,76
N2
Объём воздуха, необходимый для сгорания 1 кг
пропилацетата рассчитываем по формуле:
 ,
,
Где Мгв= 5∙12+1∙10+2∙16=102
кг/кмоль
учитывая при этом, что масса одного
киломоля пропилацетата составляет 102 кг/кмоль. Так как горение происходит при
заданных условиях, для определения объема, который занимает 1 кмоль
воспользуемся уравнением идеальных газов:
 ,
,
 ,
,
 (м3/кг)
(м3/кг)
 (м3/кг)
(м3/кг)
Действительный объём воздуха,
необходимый для сгорания 1 кг пропилацетата рассчитывается с учётом
коэффициента избытка воздуха a:
 (м3/кг)
(м3/кг)
Избыток воздуха составит:
 (м3/кг)
(м3/кг)
Теоретический объём продуктов
горения рассчитываем по формуле:
 (м3/кг)
(м3/кг)
 (м3/кг)
(м3/кг)
Объём воздуха практически
необходимого для сгорания 10 кг пропилацетата составит соответственно 70,7 м3
(7,07 × 10), при
этом выделится 7,87 м3 продуктов сгорания.
Рассчитываем процентный состав
продуктов сгорания.В этом случае по уравнению реакции определяем объем СО2, Н2О
и N2.(СО2) = 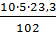
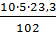 = 11,4 м3(Н2О) =
= 11,4 м3(Н2О) =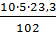
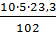 = 11,4 м3(N2) =
= 11,4 м3(N2) = 
 = 55,81 м3ИЗБ= 0 м3
= 55,81 м3ИЗБ= 0 м3
Объемная концентрацию каждого компонента смеси
рассчитываем следующим образом:
jоб (СО2) =  =
=
 = 14,55 %об (Н2О) =
= 14,55 %об (Н2О) =  =
= 
 = 14,55 %об (N2) =
= 14,55 %об (N2) =  =
= 
 = 70,9 %
= 70,9 %
Ответ: на сгорание 10 кг
пропилацетата необходимо 70,7 м3 воздуха, при этом образуется 78,7 м3 продуктов
горения, из которых СО2 - 14,55%, Н2О - 14,55 %, N2 - 70,9 %.
Рассчитать объём воздуха и продуктов
горения при сгорании горючего газа (табл. 3) объёма V при заданных условиях
(табл. 3), если горение происходит при избытке воздуха α.
Табл.3
|
Номер
варианта
|
Название
вещества
|
Химическая
формула
|
Температура
t
°С
|
V,м3
|
a
|
|
9
|
Метан
|
CH4
|
30
|
1
|
1,4
|
Решение.
Сгорает индивидуальное горючее вещество,
находящееся в газообразном состоянии.
Запишем уравнение реакции горения пропана в
воздухе:
CH4 + 2(О2 + 3,76N2) = CО2 + 2 Н2О + 3,76∙2
N2
Из уравнения находим β
=
2. Рассчитаем
теоретические объёмы воздуха и продуктов горения индивидуального горючего
вещества в газообразном состоянии в расчёте на 1 м3 горючего вещества в
нормальных условиях:
 =9,42 м3/м3
=9,42 м3/м3
Объем воздуха при Т=303 К

Рассчитываем действительный объем воздуха,
расходованный на горение с коэффициентом избытка воздуха:

Объем продуктов горения при нормальных условиях
|
VПГ0
= 1 +2+ 2×3,76
|
=12,42м/м3.
|
|
|
1
|
|
|
Объем
продуктов горения при 303 K
|
|
|
V
0
|
=
12,42×303 =
13,78 м3/м3.
|
|
ПГ(РТ)
|
273
|
|
Находим действительный объем продуктов горения с
учетом избытка воздуха
 =13,78 + 10,46∙(1,4-1)=17,96
м3/м3
=13,78 + 10,46∙(1,4-1)=17,96
м3/м3
Определить объём и состав продуктов горения (в
об. %) смеси газов , если горение происходит при коэффициенте избытка воздуха α
Оксид углерода -10%
Этилен-22%
Ацетилен-8%
Углекислый газ-10%
Азот -50%
α=2
решение.
Составим для всех горючих компонентов смеси
уравнения реакций
2CО
+ 1(O2 + 3,76N2) = 2CO2 + 3,76N2H4 + 3(O2 + 3,76N2) = 2CO2 + 2H2O + 3·3,76N22Н2
+ 2,5(O2 + 3,76N2)
= 2CO2 + Н2О+2,5·3,76N2
Рассчитаем теоретический объём продуктов горения
по формуле


Рассчитаем действительный объём
продуктов горения с учётом избытка воздуха 
Рассчитаем состав продуктов
горения.
Учитывая, что горение протекает с
избытком воздуха, то при расчёте количества молей продуктов горения учитывается
избыточное число молей кислорода и азота ( и
и  ):
): 
nобщ= =
=



 =
= 
 .
.
Вычислить температуру горения керосина,
процентного состава: С-80%, Н-13,7%, О-0,3%, W-6%,
если горение протекает при коэффициенте избытка воздуха α=1,3
а
доля потерь тепла излучением составляет 40%.
Решение. Рассчитаем низшую теплоту сгорания
горючего вещества, используя формулу Д. И. Менделеева:
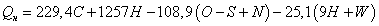 =229,4∙80+1257∙13,7+108,9∙0,3-25,1(9∙13,7+6)=41108
Кдж/кг
=229,4∙80+1257∙13,7+108,9∙0,3-25,1(9∙13,7+6)=41108
Кдж/кг
Рассчитаем объёмы продуктов горения при полном
сгорании 1 кг горючего вещества сложного состава


Рассчитаем избыточный объём воздуха при полном
сгорании 1 кг горючего Вещества: 
Рассчитаем температуру горения и, т.к. в условии
задачи ничего не сказано о начальной температуре горения, будем считать, что
горение протекает при нормальных условиях:


Ответ: действительная температура горения
вещества сложного состава составила 1075 К.
Рассчитать температуру вспышки толуола (0.т.)
С6Н14 по формуле В.И. Блинова. Сравнить найденное значение с экспериментальным,
взятым из справочника.
Решение. Формула Блинова имеет вид:

где А - постоянная пpибора, зависящая от условий
опыта;
До - коэффициент диффузии, м2/с;- число молей
кислорода, необходимое для полного сгорания одного моля пара жидкости;
Рнп - давление насыщенного пара жидкости при
Твсп, Па.
Уравнение реакции горения толуола в воздухе:
C6H5CH3 + 9(O2+3,76*N2) = 7CO2 +
4H2O+9*3,76N2
где n=9 температура вспышки в открытом тигле А =
45,3 (К×Па.м2)/с;
До=0,084*10-4 м2/с
Если коэффициент диффузии пара в воздух
неизвестен, то его можно вычислить по эмпирической формуле (см2 /с):

Подставляем данные в формулу:

Найдем такую температуру, при которой
произведение Т*Р=1775,5.
Воспользуемся зависимостью насыщенного пара от
температуры жидкости.
Т1=362,5 Т2=383,6
Р1=53,32 Р2=101,3
Вычислить температуру самовоспламенения
2,4-диметил-3-этилпентанола
Запишем структурную формулу
2,4-диметил-3-этилпентанола и пронумеруем все атомы углерода, группу -ОН
обозначим буквой Г (гидроксил).

В молекуле 5 концевых групп: 4 метильных (-СН3)
и одна гидроксильная (-ОН), т.е.
Мр = 5. Тогда число цепей:

Составим таблицу, в которую внесем цепи и их
длину:
|
Углеродная
цепь m1
|
Г-5
|
Г-6
|
Г-9
|
Г-8
|
5-6
|
5-9
|
5-8
|
8-9
|
6-9
|
6-8
|
|
Длина
цепи l1
|
6
|
4
|
6
|
6
|
5
|
5
|
3
|
5
|
5
|
5
|
Рассчитываем среднюю длину углеродных цепей:

По таблице XIY приложения находим температуру
самовоспламенения 2,4-диметил-3-этилпентанола, отыскивая её по значению средней
длины цепи в молекуле соединения: Тсвп = 560 К или 285 оС.