Новые инициирующие взрывчатые вещества, не содержащие свинца и ртути
Реферат
Новые инициирующие взрывчатые вещества, не содержащие свинца и
ртути
Введение
инициирующий взрывчатка азид
оксидиазосоединение
Инициирующими взрывчатыми веществами
называются такие взрывчатые вещества, которые обладают весьма высокой
чувствительностью и взрываются от незначительного внешнего механического (удар,
трение) или теплового (луч лазера, пламя, нагрев, электрический ток)
воздействия. Эти вещества всегда детонируют и вызывают детонацию других
взрывчатых веществ. Инициирующие взрывчатые вещества применяются в небольших
количествах для снаряжения капсюлей, создающих первоначальный импульс взрыва. У
инициирующих ВВ переход горения в детонацию происходит быстро, на расстоянии,
не превышающем нескольких миллиметров от места поджигания. Эффективность
инициирующих ВВ тем выше, чем короче участок перехода горения в детонацию и чем
выше скорость детонации. Если поместить немного инициирующего ВВ на заряд из
бризантного ВВ и поджечь, то взрыв его произведет такой сильный удар, в результате
которого взорвется и бризантное ВВ.
Существует две основные области
применения ИВВ:
) Для возбуждения детонации в
зарядах БВВ.
) Для сенсибилизации
воспламенительных составов, предназначенных для зажигания пороховых зарядов или
инициирования детонации в зарядах основного ИВВ.
В качестве инициирующих взрывчатых
веществ наибольшее применение имеют гремучая ртуть, азид свинца и стифнат
свинца, но в реферате рассматриваются исключительно ИВВ, не содержащие свинца и
ртути.
1.
Соли диазония
Соли диазония с анионами-окислителями
обладают взрывчатыми свойствами, причем практически все перхлораты арилдиазония
- ИВВ. Высокую инициирующую способность, сочетающуюся с удовлетворительными
эксплуатационными характеристиками, имеет 2,4 -
динитро-диазобензолперхлорат (2,4 - динитрофенилдиазоний перхлорат).
Исходным продуктом для его получения является 2,4 - динитроанилин.

,4 - Динитродиазобензолперхлорат
является эффективным ИВВ, обладая следующими свойствами: tвсп, 5 сек
= 215оС; = 1,65 г./см3, минимальный заряд по
тетрилу 0,007 г. (для сравнения: гремучая ртуть - 0,35 г., а азид свинца -
0,025 г.).
,4 - Динитродиазобензолперхлорат
разлагается на свету, однако продукты фотораспада образуют светозащитную
пленку, поэтому распадается только поверхностный слой и инициирующая
способность заряда не изменяется. Продукт термически стоек: взрывчатые свойства
вещества сохранились после выдержки зарядов в течение двух лет при 80 оС.
В 40-е годы прошлого века динитродиазобензолперхлорат успешно прошел опытную
проверку как ИВВ для промышленных КД. В последующие десятилетия делались
неоднократные попытки найти практическое применение этому перхлорату
фенилдиазония, в том числе как малотоксичному ИВВ для коммерческих КД и ЭД.
Однако широкому использованию 2,4 - динитродиазобензолперхлората мешают два
существенных недостатка: гигроскопичность, технический продукт
перепрессовывается.
2. Оксидиазосоединения
Многие оксидиазофенолы проявляют
взрывчатые свойства. Наибольшее практическое значение как ИВВ в ряду
диазофенолов имеет 2-диазо - 4,6 - динитрофенол, C6H2N4O5, (диазодинитрофенол, ДДНФ, DDNP). Молекулярная масса 210,1, кислородный баланс -60,9%.
Диазодинитрофенол не гигроскопичен,
незначительно растворим в воде, растворим в метаноле и этаноле, легко растворим
в ацетоне, нитроглицерине, нитробензоле, анилине, пиридине и уксусной кислоте.
На солнечном свету темнеет. Плотность ДДНФ мнк. = 1,719
г./см3, теплота образования 321 кДж/моль.
В литературе предложены для ДДНФ как
открытая, так и циклическая структуры диазофенольного фрагмента.

Согласно квантово-химическим
расчетам наиболее вероятной для этого соединения в газовой фазе является
следующая открытая структура:
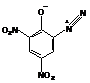
Бризантность ДДНФ составляет ~95% от
бризантности ТНТ, фугасность в свинцовом блоке равна 326 см3/10
г. Температура вспышки диазодинитрофенола tвсп, 5 сек = 175-180оС;
минимальный заряд по тетрилу равен 0,13 г., то есть меньше, чем у гремучей
ртути. ДДНФ менее чувствителен к удару, чем азид свинца. Скорость детонации
ДДНФ 4400 м/с при плотности заряда 0.9 г./см3, 6600 м/с при
плотности заряда 1,5 г/см3, 6900 м/с при плотности заряда 1,6 г/см3.
Взрывчатое разложение ДДНФ описывается следующим уравнением:
C6H2N4O5 à 42 CO + 2,52 CO2 + 2,94 H2O +
+ 3,15 H2 + 7,67 C +7,87 HCN + 16,1 N2
Получают диазодинитрофенол
диазотированием пикраминовой кислоты нитритом натрия в 10%-ной серной кислоте
согласно схеме:
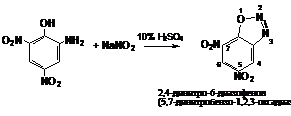
Целевой продукт выпадает из
реакционной массы в виде красно-коричневого осадка. Недостатком метода синтеза
ДДНФ является наличие большого количества токсичных сточных вод. Сырьевая база
ДДНФ достаточно широка, поскольку исходное вещество - пикраминовая кислота,
которую синтезируют частичным восстановлением пикриновой кислоты сульфидом
натрия, является товарным продуктом (она применяется при синтезе ряда
красителей).
ДДНФ как ИВВ имеет следующие
недостатки: перепрессовывается, у него недостаточно высокая термостойкость,
соединение быстро темнеет на солнечном свету, к тому же стимулирует иммунный
ответ, который способствует развитию аллергического синдрома.
Диазодинитрофенол нашел применение в
качестве ИВВ промышленных средств инициирования в США и Китае, а также как
компонент малотоксичных ударных составов капсюлей-воспламенителей стрелкового
оружия, в том числе спортивного и охотничьего в Европе и Северной Америке
. Азиды
Азид серебра, AgN3 - мол. масса 149,9. Инициирующее взрывчатое вещество. Под
действием света темнеет. Нерастворим в воде и органических растворителях.
Негигроскопичен. Растворим в водном аммиаке и во фтористом водороде.
Кристаллизуется из водного аммиака. Разрушается азотной кислотой. Плотность
кристаллов азида серебра составляет 5,1 г/см3. Энергия
кристаллической решетки равна 857,69 кДж/моль. Энтальпия образования (DHfo)
составляет + 279,5 кДж/моль, по другим данным +311 кДж/моль. Скорость детонации
при максимальной плотности равна 4,4 км/с. Объем газов при детонации составляет
244 л/кг. Фугасность равна 115 см3/10 г. Азид серебра чувствителен к
удару и трению. Продукт не перепрессовывается. По инициирующей способности азид
серебра заметно превосходит азид свинца. Скорость детонации азида серебра
составляет 3830 м/с при плотности 2,0 г/см3. Изменение скорости
детонации азида серебра при увеличении плотности заряда описывается уравнением:
Dr = D0 + 770 (r - r0) м/с, где r0 = 2 г/см2.
Давление детонации азида серебра
зависит от плотности заряда:
P = (40r - 61).102
МПа
Температура размягчения азида
серебра 2500С. Полностью азид серебра плавится при 3000С
(с разложением). Быстрое нагревание до 3000С вызывает взрыв азида
серебра. Недостатком азида серебра является плохая совместимость с сульфидом
сурьмы (Sb2S3) и тетразеном, которые
входят в большинство рецептур накольных составов. Азид серебра получают при
смешении растворов азида натрия и водорастворимых солей серебра. В ряде стран
(Великобритания, Швеция) производят азид серебра в небольших количествах по
реакции
AgNO3 + NaN3
AgN3 + NaNO3
NH3aq
На кафедре ХТОСА ЛТИ им Ленсовета
(СПбГТИ(ТУ)) была разработана альтернативная технология получения сыпучего
азида серебра по реакции:
3 + N2Н4+ NaNO2 AgN3
+ NaNO3 + 2Н2О
Азид серебра ограниченно применяют в
качестве ИВВ в малогабаритных средствах инициирования, где азид свинца не
эффективен, и в термостойких капсюлях-детонаторах. При увеличении габаритов
инициирующего заряда капсюля картина меняется: азид серебра становится менее
эффективным по сравнения с азидом свинца ИВВ, поскольку у него скорость
детонации существенно ниже. Практическое использование азида серебра
сдерживается высокой чувствительностью к трению, трудностью получения в сыпучем
виде, а также высокой стоимостью.
Азид кадмия, Cd(N3)2 мол. масса
196,46 - белое кристаллическое вещество, инициирующее ВВ. Растворяется и
гидролизуется водой. Гигроскопичен. Плотность монокристаллов 3,24 г./см3.
Теплота взрыва по различным оценкам находится в пределах 2336-2616 кДж/кг, Т
пл. = 2910С (с разл.), Т всп. (5 c) = 3600С. Скорость
детонации азида кадмия 3760 м/с при плотности 2,0 г/см3. Изменение
скорости детонации азида свинца при увеличении плотности заряда описывается
уравнением:
Dr = D0 + 360 (r - r0) м/с, где r0 = 2 г/см2.
Давление детонации азида свинца
зависит от плотности заряда:
P = (59r -
106). 102 МПа
Азид кадмия чувствителен к удару и
трению. Инициирующая способность азида кадмия больше, чем азида свинца.
Получают азид кадмия при взаимодействии гидроксида или карбоната кадмия с
избытком HN3.
Cd(OH)2 + 2
HN3 à Cd(N3)2 + 2 H2O3 + 2
HN3 à Cd(N3)2 + CO2 + H2O
Содержание Cd(N3)2 в продукте ~98%. Азид кадмия нашел ограниченное
применение в герметичных термостойких капсюлях - детонаторах для перфораторов
нефтегазовых скважин (термостойкость капслей-детонаторов составляет 2 ч при 250оС
и 6 суток при 160оС).
Азид таллия, TlN3, мол. масса 246,41 - желтый кристаллический порошок. Инициирующее
ВВ. Плохо растворяется в воде и органических растворителях. Энергия
кристаллической решетки 685,1 кДж/моль, энтальпия образования (DHfo) = 234
кДж/моль, Тпл = 3340С, Твсп. (1 с) = 5000С. Азид таллия
менее чувствителен к удару и трению, чем азид свинца. Инициирующая способность
азида таллия заметно меньше, чем азида свинца. Токсичен. Плохо совместим с
нитросоединениями. Удобным лабораторным способом получения азида таллия является
реакция водных растворов перхлората таллия и азида натрия.
TlClO4 + NaN3
à TlN3
+ NaClO4
Азид таллия ядовит. Азид таллия в
промышленности как ИВВ не используется. Находит ограниченное применение в
научных исследованиях.
. Органические
пероксиды
Пероксид ацетона (ацетон
дипероксид, 1,1,4,4 - тетраметил - 2,3,5,6 - тетраоксациклогексан), (С3Н6О2)2 - мол.
масса 148, белое кристаллическое инициирующее взрывчатое вещество. Ацетон
дипероксид хорошо растворяется в органических растворителях: бензоле, ацетоне,
хлороформе, диэтиловом эфире, петролейном эфире. Плотность = 1,33 г./см3,
Т пл. = 132 - 1330С, Т всп. (5 с) около 1800С. Очень
летучее вещество. Давление паров ацетон дипероксида 17,7 Па при 250С.
К удару ацетон дипероксид менее чувствителен, чем азид свинца.
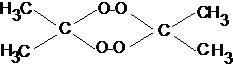
Его инициирующая способность больше,
чем у гремучей ртути, но меньше, чем у азида свинца. По другим данным заряд 0,5
г ацетон дипероксида, запрессованного в гильзу от КД №8 под давлением 30 МПа не
инициировал заряд гексогена.
Получают ацетон дипероксид при
взаимодействии ацетона с кислотой Каро (раствором пероксида водорода в
концентрированной серной кислоте) в среде уксусного ангидрида.
Перексид трициклоацетона
(циклотриацетонпероксид, 1,1,4,4,7,7 - гексаметил -
2,3,5,6.8.9-гексаоксациклононан), С9Н18О6,
мол. масса 222,1 - инициирующее взрывчатое вещество.
CH3-C-CH3
/ \
О O
/ \
О O
/ \
(СН3)2С - О -
О - С(СН3)2
Циклотриацетонпероксид образует
бесцветные кристаллы в виде призм. Плотность монкрсталла 1,272 г./см3
(рентген), хорошо растворяется в бензоле, ацетоне, хлороформе, эфире,
петролейном эфире, пиридине, ледяной уксусной и азотной кислотах. В этиловом
спирте растворяется при нагревании, не растворяется в воде и водных растворах
аммиака. Образует не менее шести полиморфных форм. Гидролизуется разбавленными
кислотами. Тпл. составляет 970С. Энергия образования
циклотриацетонпероксида -90,8 кДж/моль. Кислородный баланс -151.3%. Теплота
взрыва 5668 кДж/кг. Фугасность 250 см3/10 г. Скорость детонации при
плотности 0,92 г./см3 3750 м/с, при плотности 1,18 г./см3
- 5300 м/с, фугасность в свинцовом блоке 250 см3/10 г.
Циклотриацетонпероксид не корродирует медь, алюминий, цинк, олово, железо;
корродирует свинец. Чувствительность к удару у циклотриацетонпероксида выше, чем
у азида свинца, по инициирующей способности циклотриацетонпероксид уступает
азиду свинца: его минимальный заряд по гексогену равен 0,1 г (давление
прессования 30 МПа) и 0,16 г. по тротилу.
Продукт получают из ацетона,
подкисленного серной кислотой, на который действуют пергидролем (разбавленным
раствором пероксида водорода).
Циклотриацетонпероксид является
кинетическим продуктом окисления ацетона, а ацетон дипероксид -
термодинамическим, то есть при хранении тример может перейти в димер.
Практического значения как ИВВ пероксиды ацетона из-за высокой летучести и
склонности к сублимации не имеют.
5. Ацетилениды
В нейтральной или слабокислой среде
образуется смешанная соль Ag2C2.AgNO3 - инициирующее взрывчатое вещество, молекулярная масса 409,7,
плотность 5,369 г./см3 (рентген), температура разложения около 2200С,
фугасность в свинцовом блоке 136 см3/10 г., теплота взрыва 1888 кДж/кг.
Скорость детонации 2250 м/с при плотности 2,51 г./см3 и 4540 м/с при
плотности 3,19 г./см3. Инициирующая способность больше, чем у
гремучей ртути и зависит от способа получения двойной соли. Минимальный заряд Ag2C2.AgNO3 равен 0,005 г. по ТЭНу,
0,07 г. по тетрилу и 0,25 г. по тротилу. Соль не перепрессовывается. На
практике в качестве ИВВ не применяется.
. Соли
динитробензфуроксана
,6 -
Динитро-7-гидрокси-7-гидробензфуроксанид калия (КДНБФ) представляет собой малотоксичное «псевдоинициирующее»
вещество.

,6 -
Динитро-7-гидрокси-7-гидробензфуроксанид калия
Температура плавления калиевого
производного равна 1740С, температура вспышки при 5-секундной
задержке КДНБФ составляет 207 - 2100С, температура начала интенсивного
разложения около 1900С. Плотность монокристалла 2,21 г./см3.
Чувствительность к трению КДНБФ такая же, как у ТНРС’а. По чувствительности к
удару аддукт (s-комплекс Мейзенгеймера)
превосходит азид свинца, но уступает гремучей ртути.
Получить КДНБФ можно из
о-нитроанилина по следующей схеме:

Используется КДНБФ в малотоксичных
воспламенительных пиротехнических составах вместо ТНРС совместно с нетоксичным
окислителем KNO3 и добавками, повышающими
восприимчивость составов к удару и трению. Опытное производство продукта КДНБФ
началось в США вскоре после второй мировой войны. Существенным недостатком
соединения КДНБФ является его недостаточно высокая термостойкость.
В начале XXI века была получена и
исследована как возможный малотоксичный заменитель ТНРС калиевая соль
4,6 - динитро-7-гидроксибензофуроксана (КДНГБФ),
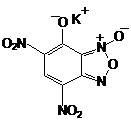
Калиевая соль 4,6 -
динитро-7-гидроксибензофуроксана
В отличие от соединения КДНБФ, которое
является комплексом Мейзенгеймера, вещество КДНГБФ представляет собой
простую соль.
Калиевая соль существует в виде
моногидрата и в безводной форме. Плотность КДНГБФ лежит в диапазоне 1,94 - 2,13
г./см3. Температура начала интенсивного разложения соли КДНГБФ около
2700C, вещество сохраняет эксплуатационные свойства после нагревания
при 1200С в течение 90 дней. Вещество КДНГБФ является быстрогорящим
соединением, с хорошей термостойкостью и достаточно безопасным в обращении.
Получают КДНГБФ из доступного
мета-броманизола по следующей схеме:
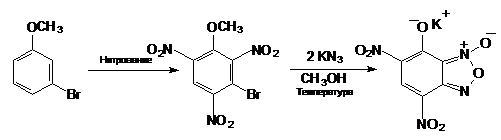
На заключительной стадии реакции
азид-ион замещает бром, а метокси-группа замещается на гидроксил.
С начала 2009 г. в США соль КДНГБФ
допущена к применению в малотоксичных пиротехнических составах для средств
инициирования.
7. Координационные
металлокомплексы с внешней сферой
Возросшие требования по
технологической, эксплуатационной и экологической безопасности инициирующих
взрывчатых веществ привели исследователей к поиску энергоемких соединений в
ряду комплексных солей d-металлов.
В США в качестве ВВ для безопасных
средств инициирования было предложено использовать перхлорат пентааммин
(5-циано-2Н-тетразолато-N2) кобальта(III) (CP)

Перхлорат пентааммин
(5-циано-2Н-тетразолато-N2) кобальта(III), CP
Плотность монокристаллов комплекса
СР составляет 1,97 г./см3, температура начала интенсивного
разложения (при скорости нагревания 20оС /мин.) равно 288 0С.
Образец СР после выдержки в течение трех лет при 800С сохранил все
эксплуатационные свойста. Участок перехода горения в детонацию (при диаметре
заряда 5 мм) примерно 4,5 мм, время перехода горения в детонацию около 75 мкс,
скорость детонации 7,18 км/с при плотности 1,75 г./см3. Зависимость
скорости детонации СР от плотности заряда описывается следующим уравнением:
D = 0,868 + 3,608r,
где D - скорость детонации (км/с),
r -
исходная плотность заряда СР (г/см3).
Все измерения проведены для диаметра
заряда 6,35 мм.
Чувствительность к удару комплекса
СР меньше, чем чувствительность ТЭНа. Металлокомплекс плохо совместим со
штатным БВВ - октогеном. СР слабо гигроскопичен.
Технологический процесс получения
СР, разработанный фирмой Unidinamic (США), состоит из ряда стадий.
Вначале получают нитрат
карбоксипентаамминкобальта (III) (CPCN) по реакции:
2 Co(NO3)2
+ NH3(H2O) + 2 (NH4)2CO3
+ 1/2O2 à
à 2 [Co(NH3)5CO3] NO3 +
2 NH4NO3 + H2O
Процесс синтеза комплекса CPCN включает барботирование
воздуха через перемешиваемую пастообразную массу карбоната аммония и нитрата
кобальта в растворе аммиака в течение 96 часов для окисления Со2+ до
Со3+. После окончания аэрирования ярко-красную реакционную массу
нагревают до 70 -750С для растворения соли CPCN, фильтруют от примесей
и охлаждают до 00С. Выпавший продукт промывают спиртом и сушат.
Полученное вещество не обладает
взрывчатыми свойствами.
Для получения перхлората
аквапентаамминкобальта (III) (АРСР) комплекс СPCN обрабатывают большим избытком хлорной кислоты.
[Co(NH3)5CO3]
NO3 + 3 HClO4 à [Co(NH3)5H2O] (ClO4)3
+ СО2 + HNO3
Процесс протекает в два этапа.

СР
Очистку комплекса СР-сырца
производят из подкисленного хлорной кислотой раствора перхлората аммония. При
очистке удаляется основная часть «амидного комплекса» и практически весь
непрореагировавший циантетразол, а также остатки азотной кислоты. Нужный
фракционный состав СР получают при добавлении горячего водного раствора
очищенного СР к охлажденному пропанолу-2. После фильтрации продукт просеивают и
сушат при 60 - 650С в течение нескольких часов. За одно осаждение
получают около 1 кг товарного СР, пригодного для снаряжения средств
инициирования.
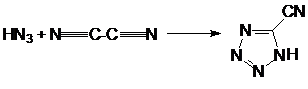
Эта реакция является ключевой во
всем процессе синтеза СР.
Вещество СР предложено к
использованию в электродетонаторах. Однако комплекс токсичен, что препятствует
его широкому применению.
Перхлорат пентааммин (5-нитротетразолато-N2) кобальта
(III) (NCP, НКТ) нашел ограниченное применение в России в качестве ВВ
для безопасных средств инициирования. Вещество НКТ по сравнению с традиционными
ИВВ обладает пониженной чувствительностью к разрядам статического
электричества. Плотность монокристаллов комплекса НКТ 2,03 г./см3,
температура начала интенсивного разложения 2650С (TG/DTA). Термостатирование в
герметичных условиях при 200°С в течение 6 часов не приводит к изменению его
свойств. Участок перехода горения в детонацию у НКТ в диаметре 6,25 мм при r=1,60-1,63 г./см3 составляет около 4,5 мм.
Скорость детонации вещества НКТ составляет 6,65 км/с при плотности 1,61 г./см3.
Минимальный заряд по гексогену в гильзе от КД №8 равен 0,15-0,20 г.
Чувствительность к удару комплекса НКТ меньше, чем чувствительность ТЭНа.
Продукт негигроскопичен. Соединение НКТ менее токсично, чем комплекс СР.
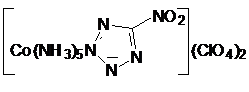
Перхлорат пентааммин
(5-нитротетразолато-N2) кобальта (III), НКТ
Технологический процесс получения
НКТ аналогичен технологическому процессу приготовления CP. Целевой комплекс
синтезируют из комплексной соли АРСР и натриевой соли 5-нитротетразола в водном
хлорнокислом растворе при 95 - 1000С в течение трех часов. Процесс
очистки комплекса НКТ от примесей принципиально не отличается от способа
приготовления товарного CP.
Как одно из наиболее перспективных
ВВ для безопасных средств инициирования, в том числе лазерных, рассматривается перхлорат
тетрааммин-цис-бис (5-нитро-2Н-тетразолато-N2) кобальта(III) (BNCP):
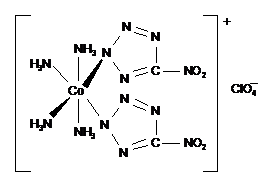
Перхлорат тетрааммин-цис-бис
(5-нитро-2Н-тетразолато-N2) кобальта(III), (BNCP)
Плотность монокристалла вещества BNCP составляет 2,05 г./см3,
скорость детонации при плотности 1,79 г./см3 равна
7117 м/с, температура начала интенсивного разложения (при скорости нагревания
20 оС /мин.) 269оС (ДСК). Минимальный заряд по гексогену
в гильзе от КД №8 равен 0,05 г., время перехода горения в детонацию около 10
мкс. Чувствительность к удару у комплекса BNCP больше, чем у вещества
СР, но меньше, чем у ТЭНа. Вещество BNCP получают по реакции:

Реакция протекает при температуре около
90°С и времени выдержки около 3 часов. В синтезе BNCP исходный тетраамминат
кобальта использовали в виде перхлората [Co(NH3)4CO3]ClO4 или нитрата [Co(NH3)4CO3]NO3, синтез и свойства
которых подробно описаны в литературе. Натриевая соль 5-нитротетразола была
получена или по реакции Зандмейера в присутствии солей меди (см. раздел 6.2),
или в результате следующего некаталитического процесса:
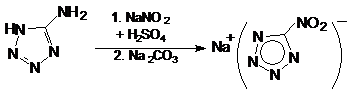
Реакцию проводят в две стадии. На
первом этапе диазотируют 5-аминотетразол избытком нитрита натрия в среде серной
кислоты. На втором этапе реакционную массу нейтрализуют карбонатом натрия,
отгоняют воду и экстрагируют целевой продукт ацетоном из смеси солей.
Нитротеразолат натрия выделяют в виде кристаллогидрата, который менее опасен в
обращении, чем безводная соль.
Выход комплекса BNCP составлял 50-60%,
считая на комплексный карбонат кобальта. Комплекс BNCP нашел применение в
системах пироавтоматики ракетных комплексов в США в составе полупроводниковых и
оптических детонаторов.
Комплексные перхлораты амминатов
кобальта (III) с тетразольными лигандами термостойки, негигроскопичны, более
безопасны, чем штатные ИВВ. Эти вещества не имеют в своем составе
высокотоксичных тяжелых металлов: ртути, свинца, кадмия. Комплексный катион
амминкобальта (III) малотоксичен. Но в состав этих кобальтовых комплексов
входит биологически опасный перхлорат-анион, который вероятно является
тератогеном (вызывает уродства во время внутриутробного развития ребенка) и
действует на щитовидную железу. Потому комплексные перхлораты амминатов
кобальта (III) с азольными лигандами не могут быть причислены к «зеленым»
инициирующим веществам.
Между тем, поиск малотоксичных
энергонасыщенных веществ для средств инициирования привел исследователей из
Лос-Аламосской Национальной лаборатории (США) в начале XXI века к получению медных
и железных комплексных солей 5-нитротетразола, представленных как идеальные
«зеленые» инициирующие вещества. Комплексы имеют следующую брутто-формулу:
(Cat)1-4[МII(NТ)3-6(H2O)3-0],
где Cat= NH4, Na, М = Fe, Cu
Авторы исследования утверждают, что
эксплуатационные свойства этих металлокомплексов легко регулировать природой Cat и М, а также
содержанием NТ- в молекуле. Было
найдено, что комплексы
Na2[FeII(NТ)4(H2O)2] и Na2[CuII(NТ)4(H2O)2]
являются более безопасными ИВВ, чем
АС и ТНРС. Некоторые характеристики комплексных нитротетразолатов FeII и CuII
приведены в таблице.
Свойства металлокомплексных
нитротетразолатов FeII и CuII
|
Металлокомплекс
|
Плотность монокристалла, г/см3
|
Чувствительность к электрической искре, Дж
|
Температура начала интенсивного разложения, 0С (ДСК)
|
2,2
|
> 0.36
|
250
|
|
Na2[CuII(NТ)4(H2O)2]
|
2,1
|
> 0.36
|
259
|
При высоких давлениях комплексы
перепрессовываются. Испытания показали, что опытные КД и ЭД, содержащие
инициирующие заряды комплекса Na2[FeII(NТ)4(H2O)2] или соли Na2[CuII(NТ)4(H2O)2] по своим характеристикам не отличались от штатных,
снаряженных азидом свинца. Промышленного производства этих металлокомплексов в
настоящее время, по-видимому, не существует.
То, что гидразинаты никеля с
анионами-окислителями имеют короткий участок перехода горения в детонацию и
могут использоваться для инициирования органических энергонасыщенных веществ,
известно около ста лет. Однако эти соединения по эффективности уступают азиду
свинца, поэтому до последнего времени не рассматривалась возможность их
практического применения в КД и ЭД. Поиск экологически чистых энергонасыщенных
соединений, не наносящих вред окружающей среде, заставил исследователей вновь
вернуться к этому классу металлокомплексных солей. Одним из перспективных
«зеленых» энергонасыщенных соединений, способных заменить азид свинца в
промышленных КД и ЭД, является комплексный нитрат гидразинникеля (II)
Ni(N2H4)3(NO3)2.
Плотность монокристалла комплекса 2,129 г./см3. Плотность
прессованного заряда комплекса Ni(N2H4)3(NO3)2 равна 1,55 г./см3 (при давлении
прессования 20 - 40 МПа) и около 1,70 г./см3 (при давлении
прессования 60 - 80 МПа). Заряды комплексного нитрата никеля перепрессовываются
при давлении свыше 60 МПа. Температура вспышки комплексного гидразината никеля
при 5-секундной задержке составляет 1670С. Температура начала разложения
и температура начала интенсивного разложения, определенные методом
дифференциального термического анализа (DTA), равны 2100С
и 2200С соответственно. Энергия активации термораспада комплексного
нитрата никеля составляет 78 кДж/моль (по результатам TG/DTA анализа) и 89 кДж/моль
(исхода из Твспышки). Скорость детонации металлокомплекса 7,0 км/с
при плотности заряда 1,7 г/см3. Минимальный заряд Ni(N2H4)3(NO3)2 в гильзе
от КД №8 по ТЭНу равен 0,15 г. Комплексный нитрат никеля получают из доступного
сырья, в стандартной аппаратуре в водной среде при температуре 650С
по уравнению:
Ni(NO3)2*6H2O
+ 3N2H4*H2O à Ni(N2H4)3(NO3)2
+ 9H2O
Нитрат гидразинникеля (II)
Комплексный нитрат Ni(N2H4)3(NO3)2 (вещество
розового цвета) не гигроскопичен и практически нерастворим в воде, он совместим
с конструкционными материалами. Металлокомплекс устойчив к действию солнечного
света и рентгеновского излучения, малочувствителен к зарядам статического
электричества. В Китае разработана промышленная технология получения комплексного
гидразината никеля. Комплексный нитрат никеля Ni(N2H4)3(NO3)2 используется
в Китае в экологичных промышленных КД и ЭД.
Комплексный азид
гидразинникеля (II) [Ni(N2H4)2] (N3)2 - еще один кандидат на замену азида свинца в
«зеленых» промышленных КД и ЭД. Плотность монокристалла комплекса 2,12 г./см3.
Температура вспышки комплексного азида никеля при 5-секундной задержке около
193 0C. Температура начала разложения равна 1860C (DTA). Продукт разлагается в
две макрокинетические стадии. Энергия активации первой стадии термораспада
равна 142,6 кДж/моль, второй стадии составляет 109,2 кДж/моль. Скорость
детонации металлокомплекса 5,42 км/с при плотности заряда 1,497 г./см3.
Минимальный заряд [Ni(N2H4)2] (N3)2 в гильзе от КД №8 по гексогену равен 0,045 г.
Чувствительность к удару комплекса азида никеля меньше чувствительности ТЭНа.
Комплексный азид получают из нитрата или ацетата никеля, гидразин-гидрата и
азида натрия по уравнению:
Ni(NO3)2*6H2O
+ 2N2H4*H2O + 2NaN3à [Ni(N2H4)2]
(N3)2 + 8H2O + 2NaNO3
Азид
гидразинникеля (II)
или
Ni(CH3COO)2*4H2O+2N2H4*H2O+2NaN3à[Ni(N2H4)2]
(N3)2+6H2O+2CH3COONa
Азид гидразинникеля (II)
Комплексный азид никеля представляет
собой зеленый поликристаллический продукт. Технический продукт не
гигроскопичен, нерастворим в воде. В Китае разработана опытно-промышленная
технология получения комплексного азида никеля, позволяющая безопасно получать
до 5 кг продукта за одно осаждение. Испытания ЭД, содержащих в качестве
первичного заряда азид гидразинникеля (II), показали, что они по
надежности не уступают штатным ЭД и могут использоваться в горнодобывающей
промышленности.
Заключение
Существуют множество ИВВ, в которых
нет свинца и ртути, но в наше время они имеют не такое широкое применение (не
могут являться штатными) из-за различных недостатков. Но в некоторых случаях
они имеют больше достоинств, и их применение является наиболее выгодным и
целесообразным. В заключение следует сказать, что во всем мире стремятся найти
малотоксичные энергонасыщенные вещества.
Например, вещество СР предложено к
использованию в электродетонаторах. Однако комплекс токсичен, что препятствует
его широкому применению. Широкому использованию 2,4 -
динитродиазобензолперхлората мешают два существенных недостатка:
гигроскопичность, технический продукт перепрессовывается. ДДНФ как ИВВ имеет
следующие недостатки: перепрессовывается, у него недостаточно высокая
термостойкость, соединение быстро темнеет на солнечном свету, к тому же
стимулирует иммунный ответ, который способствует развитию аллергического
синдрома.
Список использованной
литературы
1. Илюшин М.А. Энергонасыщенные вещества для средств
инициирования: учебное пособие/ М.А. Илюшин, И.В. Целинский, А.А. Котомин, Ю.Н.
Данилов - СПб.: СПбГТИ(ТУ) - 2013 -177 с.
. Илюшин М.А. Металлокомплексы в высокоэнергетических композициях
(монография)/под ред. И.В. Целинского/ М.А. Илюшин, А.М. Судариков, И.В.
Целинский и др. - СПб.: ЛГУ им А.С. Пушкина, 2010. - 188 с.
3. Лоскутова Л.А. Чувствительность энергетических материалов
к детонационному импульсу: методические указания/ Л.А. Лоскутова, М.А. Илюшин,
А.В. Смирнов, И.В. Бачурина - СПб.: СПбГТИ(ТУ), 2011. - 23c.
. Лоскутова Л.А. Температура вспышки конденсированных
энергоемких веществ: методические указания/ Л.А. Лоскутова, А.С. Козлов, М.А.
Илюшин, И.В. Бачурина - СПб.: СПбГТИ(ТУ), 2007. - 20 с.
. Лоскутова Л.А. Чувствительность твердых взрывчатых систем
к механическим воздействиям: методические указания/ Л.А. Лоскутова, А.С. Козлов
- СПб: СПбГИ(ТУ), 2007 - 22 с.