Химия и биологическая роль элементов VA-группы
Государственное
бюджетное образовательное учреждение высшего профессионального образования
"Оренбургский государственный медицинский университет"
Министерства
здравоохранения Российской Федерации.
Реферат по
дисциплине «Химия»
на тему:
Химия и биологическая роль элементов VA-группы
Выполнила:
студентка 1 курса
лечебного
факультета,
группы,
Лылова
Виктория
Константиновна
Проверила:
Кузьмичёва
Наталья
-16 уч. Год
Содержание
1. Общая характеристика, краткие
сведения об истории открытия элементов и их распространённости в природе
2. Изменение в группе величины радиусов
атомов и ионов, потенциала ионизации
3. Сравнение химических свойств простых
элементов
4. Свойства соединений азота в
отрицательных степенях окисления: нитриды, гидразин, гидроксиламин
5. Свойства соединений фосфора: фосфин
и фосфиды, фосфиновая кислота и фосфиты, фосфоновая кислота и фосфонаты
6. Качественные реакции
7. Обнаружение мышьяка в биологических
объектах
8. Медико- биологическое значение
элементов VA-группы
Список
литературы
1. Общая
характеристика, краткие сведения об истории открытия элементов и их
распространённости в природе
Азот
Азо́т - элемент
<https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82>
15-й группы (по устаревшей классификации - главной подгруппы пятой группы)
второго периода периодической системы химических элементов
<https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2>
Д. И. Менделеева
<https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D0%BD%D0%B4%D0%B5%D0%BB%D0%B5%D0%B5%D0%B2,_%D0%94%D0%BC%D0%B8%D1%82%D1%80%D0%B8%D0%B9_%D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87>,
с атомным номером
<https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80>
7. Относится к пниктогенам
<https://ru.wikipedia.org/wiki/%D0%9F%D0%BE%D0%B4%D0%B3%D1%80%D1%83%D0%BF%D0%BF%D0%B0_%D0%B0%D0%B7%D0%BE%D1%82%D0%B0>.
Обозначается символом N (лат.
<https://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA>
Nitrogenium). Простое
вещество
<https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%81%D1%82%D0%BE%D0%B5_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE>
азот - двухатомный газ
<https://ru.wikipedia.org/wiki/%D0%93%D0%B0%D0%B7> без цвета, вкуса и запаха.
Один из самых распространённых элементов на Земле. Химически весьма инертен,
однако реагирует с комплексными соединениями переходных металлов. Основной
компонент воздуха (78,09 % объёма), разделением которого получают промышленный
азот, (более ¾ идёт на
синтез аммиака
<https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%BC%D0%B8%D0%B0%D0%BA>).
Применяется как инертная среда для множества технологических процессов; жидкий
азот - хладагент. Азот - один из основных биогенных элементов, входящих в состав
белков и нуклеиновых кислот.
История открытия: В 1772
году Генри Кавендиш
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D0%B2%D0%B5%D0%BD%D0%B4%D0%B8%D1%88,_%D0%93%D0%B5%D0%BD%D1%80%D0%B8>
провёл следующий опыт: он многократно пропускал воздух
<https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B7%D0%B4%D1%83%D1%85> над
раскалённым углём, затем обрабатывал его щёлочью, в результате получался
остаток, который Кавендиш назвал удушливым (или мефитическим) воздухом. С
позиций современной химии ясно, что в реакции с раскалённым углём кислород
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4>
воздуха связывался в углекислый газ, который затем поглощался щёлочью. При этом
остаток газа представлял собой по большей части азот. Таким образом, Кавендиш
выделил азот, но не сумел понять, что это новое простое вещество (химический
элемент). В том же году Кавендиш сообщил об этом опыте Джозефу Пристли
<https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D1%81%D1%82%D0%BB%D0%B8,_%D0%94%D0%B6%D0%BE%D0%B7%D0%B5%D1%84>.
Интересен тот факт, что он сумел
связать азот с кислородом при помощи разрядов электрического тока, а после
поглощения оксидов азота в остатке получил небольшое количество газа, абсолютно
инертного, хотя, как и в случае с азотом, не смог понять, что выделил новый
химический элемент - инертный газ
<https://ru.wikipedia.org/wiki/%D0%98%D0%BD%D0%B5%D1%80%D1%82%D0%BD%D1%8B%D0%B5_%D0%B3%D0%B0%D0%B7%D1%8B>
аргон.
Пристли в это время проводил серию
экспериментов, в которых также связывал кислород воздуха и удалял полученный
углекислый газ, то есть также получал азот, однако, будучи сторонником
господствующей в те времена теории флогистона
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BB%D0%BE%D0%B3%D0%B8%D1%81%D1%82%D0%BE%D0%BD>,
совершенно неверно истолковал полученные результаты (по его мнению, процесс был
противоположным - не кислород удалялся из газовой смеси, а наоборот, в
результате обжига воздух насыщался флогистоном; оставшийся воздух (азот) он и
назвал насыщенным флогистоном, то есть флогистированным). Очевидно, что и
Пристли, хотя и смог выделить азот, не сумел понять сути своего открытия,
поэтому и не считается первооткрывателем азота.
Одновременно схожие эксперименты с
тем же результатом проводил и Карл Шееле <https://ru.wikipedia.org/wiki/%D0%A8%D0%B5%D0%B5%D0%BB%D0%B5,_%D0%9A%D0%B0%D1%80%D0%BB_%D0%92%D0%B8%D0%BB%D1%8C%D0%B3%D0%B5%D0%BB%D1%8C%D0%BC>.
В 1772 году
<https://ru.wikipedia.org/wiki/1772_%D0%B3%D0%BE%D0%B4> азот (под
названием «испорченного воздуха») как простое вещество описал Даниэль Резерфорд
<https://ru.wikipedia.org/wiki/%D0%A0%D0%B5%D0%B7%D0%B5%D1%80%D1%84%D0%BE%D1%80%D0%B4,_%D0%94%D0%B0%D0%BD%D0%B8%D1%8D%D0%BB%D1%8C>,
он опубликовал магистерскую диссертацию, где указал основные свойства азота (не
реагирует со щелочами
<https://ru.wikipedia.org/wiki/%D0%A9%D1%91%D0%BB%D0%BE%D1%87%D1%8C>, не
поддерживает горения, непригоден для дыхания). Именно Даниэль Резерфорд и
считается первооткрывателем азота. Однако и Резерфорд был сторонником
флогистонной теории, поэтому также не смог понять, что же он выделил. Таким
образом, чётко определить первооткрывателя азота невозможно.
Распространённость: Азот - один
из самых распространённых элементов на Земле. Вне пределов Земли азот обнаружен
в газовых туманностях, солнечной <https://ru.wikipedia.org/wiki/%D0%A1%D0%BE%D0%BB%D0%BD%D1%86%D0%B5>
атмосфере, на Уране
<https://ru.wikipedia.org/wiki/%D0%A3%D1%80%D0%B0%D0%BD_(%D0%BF%D0%BB%D0%B0%D0%BD%D0%B5%D1%82%D0%B0)>,
Нептуне <https://ru.wikipedia.org/wiki/%D0%9D%D0%B5%D0%BF%D1%82%D1%83%D0%BD_(%D0%BF%D0%BB%D0%B0%D0%BD%D0%B5%D1%82%D0%B0)>,
межзвёздном пространстве и др. Атмосферы спутников Титан, Тритон и карликовой
планеты Плутон тоже в основном состоят из азота. Азот - четвёртый по
распространённости элемент Солнечной системы (после водорода
<https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4>,
гелия <https://ru.wikipedia.org/wiki/%D0%93%D0%B5%D0%BB%D0%B8%D0%B9> и
кислорода
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4>).
Азот в форме двухатомных молекул N2
составляет большую часть атмосферы
<https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BC%D0%BE%D1%81%D1%84%D0%B5%D1%80%D0%B0_%D0%97%D0%B5%D0%BC%D0%BB%D0%B8>
Земли, где его содержание составляет 75,6 % (по массе) или 78,084 % (по
объёму), то есть около 3,87·1015 т.
Содержание азота в земной коре, по
данным разных авторов, составляет (0,7-1,5)·1015 т (причём в гумусе
<https://ru.wikipedia.org/wiki/%D0%93%D1%83%D0%BC%D1%83%D1%81> - порядка
6·1010 т), а в мантии Земли - 1,3·1016 т. Такое соотношение масс заставляет
предположить, что главным источником азота служит верхняя часть мантии, откуда
он поступает в другие оболочки Земли с извержениями вулканов
<https://ru.wikipedia.org/wiki/%D0%92%D1%83%D0%BB%D0%BA%D0%B0%D0%BD_(%D0%B3%D0%B5%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%8F)>.
Масса растворённого в гидросфере
азота, учитывая, что одновременно происходят процессы растворения азота
атмосферы в воде и выделения его в атмосферу, составляет около 2·1013 т, кроме
того, примерно 7·1011 т азота содержатся в гидросфере в виде соединений.
Биологическая роль: Азот
является химическим элементом, необходимым для существования животных и
растений, он входит в состав белков
<https://ru.wikipedia.org/wiki/%D0%91%D0%B5%D0%BB%D0%BE%D0%BA> (16-18 %
по массе), аминокислот <https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%B8%D0%BD%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B>,
нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина
<https://ru.wikipedia.org/wiki/%D0%93%D0%B5%D0%BC%D0%BE%D0%B3%D0%BB%D0%BE%D0%B1%D0%B8%D0%BD>
и др. В составе живых клеток по числу атомов азота около 2 %, по массовой доле
- около 2,5 % (четвёртое место после водорода, углерода и кислорода). В связи с
этим значительное количество связанного азота содержится в живых организмах,
«мёртвой органике» и дисперсном веществе морей и океанов. Это количество
оценивается примерно в 1,9·1011 т. В результате процессов гниения и разложения
азотсодержащей органики, при условии благоприятных факторов окружающей среды,
могут образоваться природные залежи полезных ископаемых, содержащие азот,
например, «чилийская селитра
<https://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D0%BB%D0%B8%D1%82%D1%80%D1%8B>»
(нитрат натрия
<https://ru.wikipedia.org/wiki/%D0%9D%D0%B0%D1%82%D1%80%D0%B8%D0%B5%D0%B2%D0%B0%D1%8F_%D1%81%D0%B5%D0%BB%D0%B8%D1%82%D1%80%D0%B0>
с примесями других соединений), норвежская, индийская селитры.
Фосфор
Фо́сфор (φωσφόρος -
светоносный; лат. Phosphorus) - химический элемент
<https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82>
15-й группы
<https://ru.wikipedia.org/wiki/15_%D0%B3%D1%80%D1%83%D0%BF%D0%BF%D0%B0_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2>
(по устаревшей классификации - главной подгруппы пятой группы) третьего периода
периодической системы Д. И. Менделеева
<https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2>;
имеет атомный номер
<https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80>
15. Элемент входит в группу пниктогенов <https://ru.wikipedia.org/wiki/%D0%9F%D0%BE%D0%B4%D0%B3%D1%80%D1%83%D0%BF%D0%BF%D0%B0_%D0%B0%D0%B7%D0%BE%D1%82%D0%B0>.
Фосфор - один из распространённых элементов
<https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82>
земной коры: его содержание составляет 0,08-0,09 % её массы. Концентрация в
морской воде
<https://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D1%80%D1%81%D0%BA%D0%B0%D1%8F_%D0%B2%D0%BE%D0%B4%D0%B0>
0,07 мг/л. В свободном состоянии не встречается из-за высокой химической
активности. Образует около 190 минералов
<https://ru.wikipedia.org/wiki/%D0%9C%D0%B8%D0%BD%D0%B5%D1%80%D0%B0%D0%BB>,
важнейшими из которых являются апатит
<https://ru.wikipedia.org/wiki/%D0%90%D0%BF%D0%B0%D1%82%D0%B8%D1%82> Ca5(PO4)3
(F,Cl,OH ), фосфорит
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D1%82>
и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в
плодах и семенах. Содержится в животных тканях, входит в состав белков и других
важнейших органических соединений (АТФ
<https://ru.wikipedia.org/wiki/%D0%90%D0%A2%D0%A4>, ДНК
<https://ru.wikipedia.org/wiki/%D0%94%D0%9D%D0%9A>), является элементом
жизни.
История открытия: Обычно
датой открытия фосфора считается 1669 г., однако имеются некоторые указания,
что он был известен и ранее. Гефер, например, сообщает, что в алхимическом
манускрипте из сборника, хранящегося в Парижской библиотеке, говорится о том,
что еще около ХII в. некто Алхид Бехиль получил при перегонке мочи с глиной и известью
вещество, названное им "эскарбукль". Может быть, это и был фосфор,
составляющий большой секрет алхимиков. Во всяком случае известно, что в поисках
философского камня алхимики подвергали перегонке и другим операциям
всевозможные материалы, в том числе мочу, экскременты, кости и т. д. С древних
времен фосфорами называли вещества, способные светиться в темноте. В XVII в.
был известен болонский фосфор - камень, найденный в горах вблизи Болоньи; после
обжига на углях камень приобретал способность светиться. Описывается также
"фосфор Балдуина", приготовленный волостным старшиной алдуином из
прокаленной смеси мела и азотной кислоты. Свечение подобных веществ вызывало
крайнее удивление и почиталось чудом.
В 1669 г. гамбургский
алхимик-любитель Бранд, разорившийся купец, мечтавший с помощью алхимии
поправить свои дела, подвергал обработке самые разнообразные продукты.
Предполагая, что физиологические продукты могут содержать "первичную
материю", считавшуюся основой философского камня, Бранд заинтересовался человеческой
мочой.
Он собрал около тонны мочи из
солдатских казарм и выпаривал ее до образования сиропообразной жидкости. Эту
жидкость он вновь дистиллировал и получил тяжелое красное "уринное
масло". Перегнав это масло еще раз, он обнаружил на дне реторты остаток
"мертвой головы", казалось бы ни к чему непригодной. Однако,
прокаливая этот остаток длительное время, он заметил, что в реторте появилась
белая пыль, которая медленно оседала на дно реторты и явственно светилась.
Бранд решил, что ему удалось извлечь из "маслянистой мертвой головы"
элементарный огонь, и он с еще большим рвением продолжил опыты. Превратить этот
"огонь" в золото ему, конечно, не удалось, но он все же держал в
строгом секрете свое открытие фосфора. Однако о секрете Бранда узнал некто Кункель,
служивший в то время алхимиком и тайным камердинером у саксонского курфюрста.
Кункель попросил своего сослуживца Крафта, отправлявшегося в Гамбург, выведать
у Бранда какие-либо сведения о фосфоре. Крафт, однако, сам решил
воспользоваться секретом Бранда. Он купил у него секрет за 200 талеров и,
изготовив достаточное количество фосфора, отправился в путешествие по Европе,
где с большим успехом демонстрировал перед знатными особами свечение фосфора. В
частности, в Англии он показывал фосфор королю Карлу II и ученому Бойлю. Тем
временем Кункелю удалось самому приготовить фосфор способом, близким к способу
Бранда, и в отличие от последнего он широко рекламировал фосфор, умалчивая,
однако, о секрете его изготовления. В 1680 г. независимо от предшественников
новый элемент был получен знаменитым английским физиком и химиком Робертом
Бойлем, который, так же как и Кункель, опубликовал данные о свойствах фосфора,
но о способе его получения сообщил в закрытом пакете лишь Лондонскому
королевскому обществу (это сообщение было опубликовано только через 12 лет, уже
после смерти Бойля), а ученик Бойся - А. Ганквиц изменил чистой науке и вновь
возродил «фосфорную спекуляцию» в виде широкой производственной деятельности по
изготовлению этого вещества: 50 лет он широко торговал фосфором по весьма
высокой цене. В Голландии, например, унция (31,1 г) фосфора стоила в то время
16 дукатов. По поводу природы фосфора высказывались самые фантастические
предположения. В XVIII в. фосфором занимались многие крупные ученые и среди них
Маргграф, усовершенствовавший способ получения фосфора из мочи путем добавления
к последней хлорида свинца.
В 1777 г. Шееле установил
наличие фосфора в костях и рогах животных в виде фосфорной кислоты, связанной с
известью. Некоторые авторы, впрочем, приписывают это открытие другому шведскому
химику Гану, однако именно Шееле разработал способ получения фосфора из костей.
Элементарным веществом фосфор был признан Лавуазье на основе его известных
опытов по сжиганию фосфора в кислороде. В таблице простых тел Лавуазье поместил
фосфор во второй группе простых тел, неметаллических, окисляющихся и дающих
кислоты. С XIX в. фосфор получил широкое применение главным образом в виде
солей, используемых для удобрения почв.
Итак, более трехсот лет
отделяют нас от того момента, когда гамбургский алхимик Геннинг Бранд открыл
новый элемент - фосфор. Подобно другим алхимикам, Бранд пытался отыскать
эликсир жизни или философский камень, с помощью которых старики молодеют,
больные выздоравливают, а неблагородные металлы превращаются в золото. Не
забота о благе людском, а корысть руководила Брандом. Об этом свидетельствуют
факты из истории единственного настоящего открытия, сделанного им. На первом,
пятидесятилетнем этапе истории фосфора, кроме открытия Бойля, лишь одно событие
отмечено историей науки: в 1715 г. Генсинг установил наличие фосфора в мозговой
ткани. После опытов Маркграфа история элемента, приобретшего много лет спустя
номер 15, стала историей многих больших открытий.
Распространение в
природе: Фосфор широко распространен в природе и
составляет 0,12% земной коры. Он входит в состав белков растительного и
животного происхождения. Человеческий скелет содержит примерно 1400 г фосфора,
мышцы - 130 г, мозг и нервы - 12 г. Фосфор составляет существенную долю в
химическом составе растений и поэтому является важным удобрением. Основным
сырьем для производства удобрений служат апатит CaF2Ч3Ca3(PO4)2
и фосфориты, основой которых являются фосфат кальция Ca3(PO4)2.
Элементный фосфор получают электротермическим восстановлением при 1400-1600°С
из фосфоритов и апатитов в присутствии SiO2. Апатит добывают в
России, Бразилии, Финляндии и Швеции. Крупным источником фосфора является
фосфоритовая руда, в больших количествах добываемая в США, Марокко, Тунисе,
Алжире, Египте, Израиле. Гуано, другой источник фосфора, добывают на
Филиппинах, Сейшельских островах, в Кении и Намибии.
Биологическая роль
соединений фосфора: Фосфор присутствует в живых клетках
в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых
кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека
состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2.
В состав зубной эмали входит фторапатит. Основную роль в превращениях
соединений фосфора в организме человека и животных играет печень. Обмен фосфорных
соединений регулируется гормонами и витамином D. При недостатке фосфора в
организме развиваются различные заболевания костей.
Суточная потребность в фосфоре
составляет:
· для взрослых
1,0-2,0 г
· для беременных и
кормящих женщин 3-3,8 г
· для детей и
подростков 1,5-2,5 г
При больших физических
нагрузках потребность в фосфоре возрастает в 1,5-2 раза.
Усвоение происходит эффективнее
при приеме фосфора вместе с кальцием в соотношении 3:2 (P:Ca).
Мышьяк
Мышья́к (лат.
<https://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA>
Arsenicum;
обозначается символом As) - химический элемент
<https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82>
15-й группы (по устаревшей классификации - главной подгруппы пятой группы)
четвёртого периода периодической системы
<https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2>;
имеет атомный номер <https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80>
33. Простое вещество представляет собой хрупкий полуметалл
<https://ru.wikipedia.org/wiki/%D0%9F%D0%BE%D0%BB%D1%83%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D1%8B>
стального цвета с зеленоватым оттенком (в серой аллотропной модификации).
История открытия:
Мышьяк является одним из древнейших элементов, используемых человеком. Сульфиды
мышьяка As2S3 и As4S4, так
называемые аурипигмент («арсеник») и реальгар, были знакомы римлянам и грекам.
Эти вещества ядовиты. Мышьяк является одним из элементов, встречающихся в
природе в свободном виде. Его можно сравнительно легко выделить из соединений.
Поэтому история не знает, кто впервые получил в свободном состоянии
элементарный мышьяк. Многие приписывают роль первооткрывателя алхимику Альберту
Великому. В трудах Парацельса также описано получение мышьяка в результате
реакции арсеника с яичной скорлупой. Многие историки науки предполагают, что
металлический мышьяк был получен значительно раньше, но он считался
представителем самородной ртути. Это можно объяснить тем, что сульфид мышьяка
был очень похож на ртутный минерал. И выделение из него было очень легким, как
и при выделении ртути. Элементарный мышьяк был известен в Европе и в Азии ещё
со средних веков. Китайцы получали его из руд. Мышьяк - ядовитое вещество.
Европейцы не могли диагностировать наступление смерти из-за отравления
мышьяком, а вот китайцы могли это делать. Но этот метод анализа до настоящих
времен не дошел, так и остался загадкой. Европейцы научились определять
наступление смерти при отравлении мышьяком, это впервые сделал Д.Марше. Данная
реакция используется и в настоящее время.
Мышьяк иногда встречается в
оловянных рудах. В китайской литературе средних веков описаны случаи смерти
людей, которые выпивали воду или вино из оловянных сосудов, из-за наличия в нём
мышьяка. Сравнительно долго люди путали сам мышьяк и его оксид, принимали за
одно вещество. Это недоразумение было устранено Г.Брандтом и А.Лавуазье,
которые и доказали, что это разные вещества, и что мышьяк - самостоятельный
химический элемент. Оксид мышьяка долгое время использовался для уничтожения
грызунов. Отсюда и происхождение русского названия элемента. Оно происходит от
слов «мышь» и «яд».
Распространённость в природе: Мышьяк -
рассеянный элемент. Содержание в земной коре 1,7·10−4% по
массе. В морской воде 0,003 мг/л. Этот элемент иногда встречается в природе в
самородном виде, минерал
<https://ru.wikipedia.org/wiki/%D0%9C%D0%B8%D0%BD%D0%B5%D1%80%D0%B0%D0%BB>
имеет вид металлически блестящих серых скорлупок или плотных масс, состоящих из
мелких зёрнышек.
Известно около 200
мышьяковосодержащих минералов. В небольших концентрациях часто сопутствует
свинцовым, медным и серебряным рудам
<https://ru.wikipedia.org/wiki/%D0%A0%D1%83%D0%B4%D0%B0>. Довольно
распространены два природных минерала мышьяка в виде сульфидов (бинарных
соединений с серой
<https://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D1%80%D0%B0>):
оранжево-красный прозрачный реальгар
<https://ru.wikipedia.org/wiki/%D0%A0%D0%B5%D0%B0%D0%BB%D1%8C%D0%B3%D0%B0%D1%80>
AsS и лимонно-жёлтый аурипигмент
<https://ru.wikipedia.org/wiki/%D0%90%D1%83%D1%80%D0%B8%D0%BF%D0%B8%D0%B3%D0%BC%D0%B5%D0%BD%D1%82>
As2S3. Минерал, имеющий промышленное значение для
получения мышьяка, - арсенопирит (мышьяковый колчедан) FeAsS или FeS2•FeAs2
(46 % As), также перерабатывают мышьяковистый колчедан
<https://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%BB%D1%87%D0%B5%D0%B4%D0%B0%D0%BD>
- лёллингит
<https://ru.wikipedia.org/wiki/%D0%9B%D1%91%D0%BB%D0%BB%D0%B8%D0%BD%D0%B3%D0%B8%D1%82>
(FeAs2) (72,8 % As), скородит
<https://ru.wikipedia.org/wiki/%D0%A1%D0%BA%D0%BE%D1%80%D0%BE%D0%B4%D0%B8%D1%82>
FeAsO4 (27 - 36 % As). Большая часть мышьяка добывается попутно при
переработке мышьяковосодержащих золотых
<https://ru.wikipedia.org/wiki/%D0%97%D0%BE%D0%BB%D0%BE%D1%82%D0%BE>,
свинцово-цинковых, медноколчеданных и других руд.
Биологическая роль: Мышьяк и
все его соединения ядовиты
<https://ru.wikipedia.org/wiki/%D0%AF%D0%B4>. При остром отравлении
мышьяком наблюдаются рвота <https://ru.wikipedia.org/wiki/%D0%A0%D0%B2%D0%BE%D1%82%D0%B0>,
боли в животе, понос
<https://ru.wikipedia.org/wiki/%D0%94%D0%B8%D0%B0%D1%80%D0%B5%D1%8F>,
угнетение центральной нервной системы
<https://ru.wikipedia.org/wiki/%D0%A6%D0%B5%D0%BD%D1%82%D1%80%D0%B0%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F_%D0%BD%D0%B5%D1%80%D0%B2%D0%BD%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0>.
Сходство симптомов отравления мышьяком с симптомами холеры
<https://ru.wikipedia.org/wiki/%D0%A5%D0%BE%D0%BB%D0%B5%D1%80%D0%B0>
длительное время позволяло маскировать использование соединений мышьяка (чаще
всего, триоксида мышьяка, т. н. «белого мышьяка») в качестве смертельного яда.
Во Франции порошок триоксида мышьяка за высокую эффективность получил обиходное
название «наследственный порошок» (фр. <https://ru.wikipedia.org/wiki/%D0%A4%D1%80%D0%B0%D0%BD%D1%86%D1%83%D0%B7%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA>
poudre
de succession).
Существует предположение, что соединениями мышьяка был отравлен Наполеон
<https://ru.wikipedia.org/wiki/%D0%9D%D0%B0%D0%BF%D0%BE%D0%BB%D0%B5%D0%BE%D0%BD_I_%D0%91%D0%BE%D0%BD%D0%B0%D0%BF%D0%B0%D1%80%D1%82>
на острове Святой Елены. В 1832 году
<https://ru.wikipedia.org/wiki/1832_%D0%B3%D0%BE%D0%B4> появилась
надёжная качественная реакция на мышьяк - проба Марша <https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D0%B1%D0%B0_%D0%9C%D0%B0%D1%80%D1%88%D0%B0>,
значительно повысившая эффективность диагностирования отравлений.
На территориях, где в почве и воде
избыток мышьяка, он накапливается в щитовидной железе <https://ru.wikipedia.org/wiki/%D0%A9%D0%B8%D1%82%D0%BE%D0%B2%D0%B8%D0%B4%D0%BD%D0%B0%D1%8F_%D0%B6%D0%B5%D0%BB%D0%B5%D0%B7%D0%B0>
у людей и вызывает эндемический зоб
<https://ru.wikipedia.org/wiki/%D0%AD%D0%BD%D0%B4%D0%B5%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D0%B7%D0%BE%D0%B1>.
Помощь и противоядия при отравлении
мышьяком: приём водных растворов тиосульфата натрия Na2S2O3
<https://ru.wikipedia.org/wiki/%D0%A2%D0%B8%D0%BE%D1%81%D1%83%D0%BB%D1%8C%D1%84%D0%B0%D1%82_%D0%BD%D0%B0%D1%82%D1%80%D0%B8%D1%8F>,
промывание желудка, приём молока и творога; специфическое противоядие - унитиол
<https://ru.wikipedia.org/wiki/%D0%A3%D0%BD%D0%B8%D1%82%D0%B8%D0%BE%D0%BB>.
ПДК
<https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE_%D0%B4%D0%BE%D0%BF%D1%83%D1%81%D1%82%D0%B8%D0%BC%D0%B0%D1%8F_%D0%BA%D0%BE%D0%BD%D1%86%D0%B5%D0%BD%D1%82%D1%80%D0%B0%D1%86%D0%B8%D1%8F>
в воздухе для мышьяка 0,5мг/м³.
Работают с мышьяком в герметичных
боксах, используя защитную спецодежду. Из-за высокой токсичности соединения
мышьяка использовались как отравляющие вещества в Первую мировую войну
<https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B2%D0%B0%D1%8F_%D0%BC%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D1%8F_%D0%B2%D0%BE%D0%B9%D0%BD%D0%B0>.
В западных странах мышьяк был
известен преимущественно как сильный яд, в то же время в традиционной китайской
медицине он почти на протяжении двух тысяч лет использовался для лечения
сифилиса и псориаза. Теперь медики доказали, что мышьяк оказывает положительный
эффект и в борьбе с лейкемией. Китайские ученые обнаружили, что мышьяк атакует
белки, которые отвечают за рост раковых клеток.
Мышьяк в малых дозах канцерогенен
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D0%BD%D1%86%D0%B5%D1%80%D0%BE%D0%B3%D0%B5%D0%BD>,
его использование в качестве лекарства, «улучшающего кровь» (так называемый
«белый мышьяк», например, «Таблетки Бло с мышьяком», и др.) продолжалось до
середины 1950-х гг., и внесло свой весомый вклад в развитие онкологических
заболеваний <https://ru.wikipedia.org/wiki/%D0%97%D0%BB%D0%BE%D0%BA%D0%B0%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%B5%D0%BD%D0%BD%D1%8B%D0%B5_%D0%BE%D0%BF%D1%83%D1%85%D0%BE%D0%BB%D0%B8>.
Для лечения сонной болезни
традиционно используют органические соединения мышьяка.
Недавно широкую огласку получила
техногенная экологическая катастрофа
<https://ru.wikipedia.org/wiki/%D0%AD%D0%BA%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D0%BA%D0%B0%D1%82%D0%B0%D1%81%D1%82%D1%80%D0%BE%D1%84%D0%B0>
на юге Индии - из-за чрезмерного отбора воды из водоносных горизонтов мышьяк
стал поступать в питьевую воду. Это вызвало токсическое и онкологическое
поражение у десятков тысяч людей.
Считалось, что «микродозы мышьяка,
вводимые с осторожностью в растущий организм, способствуют росту костей
человека и животных в длину и толщину, в отдельных случаях рост костей может
быть вызван микродозами мышьяка в период окончания роста».
Считалось также, что «При длительном
потреблении небольших доз мышьяка у организма вырабатывается иммунитет: Этот
факт установлен как для людей, так и для животных. Известны случаи, когда
привычные потребители мышьяка принимали сразу дозы, в несколько раз превышающие
смертельную, и оставались здоровыми. Опыты на животных показали своеобразие
этой привычки. Оказалось, что животное, привыкшее к мышьяку при его употреблении,
быстро погибает, если значительно меньшая доза вводится в кровь или под кожу».
Однако такое «привыкание» носит очень ограниченный характер, в отношении т. н.
«острой токсичности», и не защищает от новообразований. Тем не менее, в
настоящее время исследуется влияние микродоз мышьяксодержащих препаратов в
качестве противоракового средства.
Известны экстремофильные бактерии,
которые способны выживать при высоких концентрациях арсената в окружающей
среде. Было высказано предположение, что в случае штамма GFAJ-1
<https://ru.wikipedia.org/wiki/GFAJ-1> мышьяк замещает фосфор в
биохимических реакциях, в частности, входит в состав ДНК, однако это
предположение не подтвердилось.
Сурьма
Сурьма́ (лат.
<https://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA>
Stibium;
обозначается символом
<https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D0%B7%D0%BD%D0%B0%D0%BA%D0%B8>
Sb) химический элемент <https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82>
15-й группы (по устаревшей классификации - главной подгруппы пятой группы)
пятого периода периодической системы химических элементов <https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2>
Д. И. Менделеева
<https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D0%BD%D0%B4%D0%B5%D0%BB%D0%B5%D0%B5%D0%B2,_%D0%94%D0%BC%D0%B8%D1%82%D1%80%D0%B8%D0%B9_%D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87>;
имеет атомный номер <https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80>
51. Простое вещество
<https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%81%D1%82%D0%BE%D0%B5_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE>
сурьма- полуметалл
<https://ru.wikipedia.org/wiki/%D0%9F%D0%BE%D0%BB%D1%83%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB>
серебристо-белого цвета
<https://ru.wikipedia.org/wiki/%D0%A6%D0%B2%D0%B5%D1%82> с синеватым
оттенком, грубозернистого строения. Известны четыре металлических аллотропных
модификаций сурьмы, существующих при различных давлениях, и три аморфные
модификации (взрывчатая, чёрная и жёлтая сурьма).
История открытия: Сурьма
известна с глубокой древности. В странах Востока она употреблялась примерно за
3000 лет до н. э. для изготовления сосудов. В Древнем Египте уже в 19 в. до н.
э. порошок сурьмяного блеска (природный Sb2S3) под
названием mesten или stem применялся для чернения бровей. В Древней Греции
<https://ru.wikipedia.org/wiki/%D0%94%D1%80%D0%B5%D0%B2%D0%BD%D1%8F%D1%8F_%D0%93%D1%80%D0%B5%D1%86%D0%B8%D1%8F>
он был известен как στίμμι и στίβι, отсюда лат.
<https://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA>
stibium.Около 12-14
вв. н. э. появилось название antimonium. Подробное описание свойств и способов
получения сурьмы и её соединений впервые дано алхимиком Василием Валентином
<https://ru.wikipedia.org/wiki/%D0%92%D0%B0%D1%81%D0%B8%D0%BB%D0%B8%D0%B9_%D0%92%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%B8%D0%BD>
(Германия) в 1604. В 1789 <https://ru.wikipedia.org/wiki/1789> А.
Лавуазье
<https://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D0%B2%D1%83%D0%B0%D0%B7%D1%8C%D0%B5>
включил сурьму в список химических элементов под названием antimoine
(современный английский antimony, испанский и итальянский antimonio,
немецкийAntimon). Русское слово «сурьма» произошло от турецкого и
крымско-татарского sürmä; им
обозначался порошок свинцового блеска
<https://ru.wikipedia.org/wiki/%D0%A1%D1%83%D0%BB%D1%8C%D1%84%D0%B8%D0%B4_%D1%81%D0%B2%D0%B8%D0%BD%D1%86%D0%B0>
PbS, также служивший для чернения бровей (по другим данным, «сурьма» - от
персидского «сурме» - металл).
Висмут
Ви́смут -
химический элемент
<https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82>
15-й группы (по устаревшей классификации - главной подгруппы пятой группы)
шестого периода периодической системы химических элементов
<https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2>
Д. И. Менделеева
<https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D0%BD%D0%B4%D0%B5%D0%BB%D0%B5%D0%B5%D0%B2,_%D0%94%D0%BC%D0%B8%D1%82%D1%80%D0%B8%D0%B9_%D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87>;
имеет атомный номер
<https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80>
83. Обозначается символом Bi (лат.
<https://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA>
Bismuthum). Простое
вещество представляет собой при нормальных условиях блестящий серебристый с
розоватым оттенком металл.
История
происхождения: Предположительно латинское Bismuthum
или bisemutum происходит от немецкого weisse Masse, «белая масса».
В Средневековье
<https://ru.wikipedia.org/wiki/%D0%A1%D1%80%D0%B5%D0%B4%D0%BD%D0%B8%D0%B5_%D0%B2%D0%B5%D0%BA%D0%B0>
висмут часто использовался алхимиками во время опытов. Добывающие руду шахтёры
называли его tectum argenti, что означает «производство серебра», при этом они
считали, что висмут был наполовину серебром.
Висмут использовали не только в
Европе. Инки применяли висмут в процессе изготовления холодного оружия, из-за
него мечи отличались особой красотой, а их блеск был вызван радужным окислением,
которое являлось следствием образования на поверхности металла тонкой плёнки
оксида висмута
<https://ru.wikipedia.org/wiki/%D0%9E%D0%BA%D1%81%D0%B8%D0%B4_%D0%B2%D0%B8%D1%81%D0%BC%D1%83%D1%82%D0%B0(III)>.
Однако висмут не был отнесен к
самостоятельному элементу, и полагали, что он является разновидностью свинца
<https://ru.wikipedia.org/wiki/%D0%A1%D0%B2%D0%B8%D0%BD%D0%B5%D1%86>,
сурьмы или олова
<https://ru.wikipedia.org/wiki/%D0%9E%D0%BB%D0%BE%D0%B2%D0%BE>. Впервые о
висмуте упоминается в 1546 году в трудах немецкого минералога и металлурга
Георгиуса Агриколы
<https://ru.wikipedia.org/wiki/%D0%93%D0%B5%D0%BE%D1%80%D0%B3%D0%B8%D0%B9_%D0%90%D0%B3%D1%80%D0%B8%D0%BA%D0%BE%D0%BB%D0%B0>.
В 1739 г. немецким химиком Поттом И. Г. было установлено, что висмут является
всё-таки отдельным химическим элементом. Через 80 лет шведский химик Берцелиус
впервые ввел символ элемента Bi в химическую номенклатуру.
Нахождение в природе: Содержание
висмута в земной коре - 2·10−5 % по массе, в морской воде -
2·10−5 мг/л.
В рудах находится как в форме
собственных минералов, так и в виде примеси в некоторых сульфидах и сульфосолях
других металлов. В мировой практике около 90 % всего добываемого висмута
извлекается попутно при металлургической переработке свинцово-цинковых, медных,
оловянных руд и концентратов, содержащих сотые и иногда десятые доли процента
висмута.
Висмутовые руды, содержащие 1 % и
выше висмута, встречаются редко. Минералами висмута, входящими в состав таких
руд, а также руд других металлов, являются висмут самородный
<https://ru.wikipedia.org/w/index.php?title=%D0%A1%D0%B0%D0%BC%D0%BE%D1%80%D0%BE%D0%B4%D0%BD%D1%8B%D0%B9_%D0%B2%D0%B8%D1%81%D0%BC%D1%83%D1%82&action=edit&redlink=1>
(содержит 98,5-99 % Bi), висмутин <https://ru.wikipedia.org/wiki/%D0%92%D0%B8%D1%81%D0%BC%D1%83%D1%82%D0%B8%D0%BD>
Bi2S3 (81,30 % Bi), тетрадимит
<https://ru.wikipedia.org/w/index.php?title=%D0%A2%D0%B5%D1%82%D1%80%D0%B0%D0%B4%D0%B8%D0%BC%D0%B8%D1%82&action=edit&redlink=1>
Bi2Te2S (56,3-59,3 % Bi), козалит
<https://ru.wikipedia.org/w/index.php?title=%D0%9A%D0%BE%D0%B7%D0%B0%D0%BB%D0%B8%D1%82&action=edit&redlink=1>
Pb2Bi2S5 (42 % Bi), бисмит
<https://ru.wikipedia.org/w/index.php?title=%D0%91%D0%B8%D1%81%D0%BC%D0%B8%D1%82&action=edit&redlink=1>
Bi2O3 (89,7 % Bi),бисмутит <https://ru.wikipedia.org/w/index.php?title=%D0%91%D0%B8%D1%81%D0%BC%D1%83%D1%82%D0%B8%D1%82&action=edit&redlink=1>
Bi2CO3(OH)4 (88,5-91,5 % Bi), виттихенит
<https://ru.wikipedia.org/w/index.php?title=%D0%92%D0%B8%D1%82%D1%82%D0%B8%D1%85%D0%B5%D0%BD%D0%B8%D1%82&action=edit&redlink=1>
Cu3BiS3, галеновисмутит
<https://ru.wikipedia.org/w/index.php?title=%D0%93%D0%B0%D0%BB%D0%B5%D0%BD%D0%BE%D0%B2%D0%B8%D1%81%D0%BC%D1%83%D1%82%D0%B8%D1%82&action=edit&redlink=1>
PbBi2S4, айкинит
<https://ru.wikipedia.org/wiki/%D0%90%D0%B9%D0%BA%D0%B8%D0%BD%D0%B8%D1%82>
CuPbBiS3.
2. Изменение в группе величины
радиусов атомов и ионов, потенциала ионизации
азот окисление атом нитрид
Периодическая система элементов
<#"877552.files/image001.gif">
Переходные металлы (Co, Ni, Cu, Ag)
катализируют разложение гидразина, при катализе платиной, родием и палладием
основными продуктами разложения являются азот и водород:
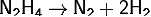
Благодаря наличию двух неподелённых
пар электронов
<https://ru.wikipedia.org/wiki/%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D0%B0%D1%8F_%D0%BF%D0%B0%D1%80%D0%B0>
у атомов азота, гидразин способен к присоединению одного или двух ионов
водорода. При присоединении одного протона получаются соединения гидразиния с
зарядом 1+, двух протонов - гидразония с зарядом 2+, содержащие соответственно
ионы N2H5+ и N2H62+.
Водные растворы гидразина обладают основными
<https://ru.wikipedia.org/wiki/%D0%9E%D1%81%D0%BD%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5_(%D1%85%D0%B8%D0%BC%D0%B8%D1%8F)>
свойствами, но его основность значительно меньше, чем у аммиака:

(для аммиака Kb = 1,78·10−5)
Протонирование второй неподеленной
пары электронов протекает ещё труднее:
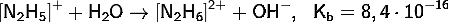
Известны соли гидразина - хлорид
гидразиния
<https://ru.wikipedia.org/wiki/%D0%A5%D0%BB%D0%BE%D1%80%D0%B8%D0%B4_%D0%B3%D0%B8%D0%B4%D1%80%D0%B0%D0%B7%D0%B8%D0%BD%D0%B8%D1%8F>
N2H5Cl, сульфат гидразония N2H6SO4
и т. д. Иногда их формулы записывают N2H4 · HCl, N2H4
·H2SO4 и т. д. и называют гидрохлорид гидразина, сульфат
гидразина и т. д. Большинство таких солей растворимо в воде.

Соли
<https://ru.wikipedia.org/wiki/%D0%A1%D0%BE%D0%BB%D0%B8> гидразина
бесцветны, почти все хорошо растворимы в воде. К числу важнейших относится
сульфат гидразина N2H4 · H2SO4.
Гидразин как восстановитель: Гидразин -
энергичный восстановитель
<https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D0%B8>.
В растворах гидразин обычно также окисляется до азота:

Восстановить гидразин до аммиака
можно только сильными восстановителями, такими, как Sn2+, Ti3+,
водородом в момент выделения (Zn + HCl):

Окисляется кислородом
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4>
воздуха до азота, аммиака и воды. Известны многие органические производные
гидразина. Гидразин, а также гидразин-гидрат, гидразин-сульфат,
гидразин-хлорид, широко применяются в качестве восстановителей золота
<https://ru.wikipedia.org/wiki/%D0%97%D0%BE%D0%BB%D0%BE%D1%82%D0%BE>,
серебра
<https://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D1%80%D0%B5%D0%B1%D1%80%D0%BE>,
платиновых металлов <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D1%8B_%D0%BF%D0%BB%D0%B0%D1%82%D0%B8%D0%BD%D0%BE%D0%B2%D0%BE%D0%B9_%D0%B3%D1%80%D1%83%D0%BF%D0%BF%D1%8B>
из разбавленных растворов их солей. Медь в аналогичных условиях
восстанавливается до закиси.
В органическом синтезе гидразин
применяется для восстановления карбонильной группы
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%80%D0%B1%D0%BE%D0%BD%D0%B8%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F_%D0%B3%D1%80%D1%83%D0%BF%D0%BF%D0%B0>
альдегидов <https://ru.wikipedia.org/wiki/%D0%90%D0%BB%D1%8C%D0%B4%D0%B5%D0%B3%D0%B8%D0%B4%D1%8B>
и кетонов
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B5%D1%82%D0%BE%D0%BD%D1%8B> до
метиленовой по КижнеруВольфу (-реакция КижнераВольфа
<https://ru.wikipedia.org/wiki/%D0%A0%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D1%8F_%D0%9A%D0%B8%D0%B6%D0%BD%D0%B5%D1%80%D0%B0%E2%80%94%D0%92%D0%BE%D0%BB%D1%8C%D1%84%D0%B0>),
реакция идёт через образование гидразонов
<https://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%B4%D1%80%D0%B0%D0%B7%D0%BE%D0%BD%D1%8B>,
расщепляющихся затем под действием сильных оснований.
Обнаружение:
Качественной реакцией на гидразин служит образование окрашенных гидразонов
<https://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%B4%D1%80%D0%B0%D0%B7%D0%BE%D0%BD%D1%8B>
с некоторыми альдегидами
<https://ru.wikipedia.org/wiki/%D0%90%D0%BB%D1%8C%D0%B4%D0%B5%D0%B3%D0%B8%D0%B4%D1%8B>,
в частности - с p- диметиламинобензальдегидом.
Гидроксилами́н NH2OH
- бесцветные кристаллы, легко растворимые в воде с образованием гидрата NH2ОН·Н2О.
Свойства: В водном
растворе диссоциирует <https://ru.wikipedia.org/wiki/%D0%94%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D1%8F_(%D1%85%D0%B8%D0%BC%D0%B8%D1%8F)>
по основному типу, являясь слабым основанием:
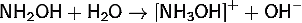 Ko = 2·10−8
Ko = 2·10−8
Может также диссоциировать и по
кислотному типу с рКа <https://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%BD%D1%81%D1%82%D0%B0%D0%BD%D1%82%D0%B0_%D0%B4%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D0%B8_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B>
= 14,02:

В кислом водном растворе
гидроксиламин устойчив, однако ионы переходных металлов
<https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B5%D1%85%D0%BE%D0%B4%D0%BD%D1%8B%D0%B5_%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D1%8B>
катализируют его распад.
Подобно NH3,
гидроксиламин реагирует с кислотами, образуя соли гидроксиламиния, например:

На воздухе соединение является
нестабильным:

но при давлении в 3 кПа (2,25 мм
рт.ст.) плавится при 32 °С и кипит при 57 °С без разложения.
На воздухе легко окисляется
кислородом воздуха:

Гидроксиламин проявляет свойства
восстановителя, при действии на него окислителей выделяются N2 или N2O:

В некоторых реакциях NH2OH
проявляются окислительные свойства, при этом он восстанавливается до NH3
или NH4+, например:

5. Свойства соединений фосфора
Фосфи́н
(фосфористый водород, фосфид водорода <https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4>,
гидрид фосфора
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%BE%D1%80>, по
номенклатуре IUPAC - фосфан РН3) - бесцветный, ядовитый газ (при
нормальных условиях) со специфическим запахом гнилой рыбы.
Физические свойства: Бесцветный газ. Плохо растворяется в воде, не реагирует с ней. При низких температурах образует твёрдый клатрат
<https://ru.wikipedia.org/wiki/%D0%9A%D0%BB%D0%B0%D1%82%D1%80%D0%B0%D1%82%D1%8B> 8РН3·46Н2О. Растворим в бензоле, диэтиловом
эфире
<https://ru.wikipedia.org/wiki/%D0%94%D0%B8%D1%8D%D1%82%D0%B8%D0%BB%D0%BE%D0%B2%D1%8B%D0%B9_%D1%8D%D1%84%D0%B8%D1%80>, сероуглероде
<https://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D1%80%D0%BE%D1%83%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4>. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой
<https://ru.wikipedia.org/wiki/%D0%9A%D1%80%D0%B8%D1%81%D1%82%D0%B0%D0%BB%D0%BB%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%80%D0%B5%D1%88%D1%91%D1%82%D0%BA%D0%B0>.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0,142 нм, ∠HPH = 93,5°).Дипольный
момент
<https://ru.wikipedia.org/wiki/%D0%94%D0%B8%D0%BF%D0%BE%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9_%D0%BC%D0%BE%D0%BC%D0%B5%D0%BD%D1%82> составляет 0,58 <https://ru.wikipedia.org/wiki/%D0%94%D0%B5%D0%B1%D0%B0%D0%B9>, существенно ниже, чем у аммиака
<https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%BC%D0%B8%D0%B0%D0%BA>. Водородная
связь
<https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%BD%D0%B0%D1%8F_%D1%81%D0%B2%D1%8F%D0%B7%D1%8C> между молекулами PH3 практически не проявляется и поэтому фосфин имеет более низкие температуры плавления и кипения.
Химические свойства: Фосфин
сильно отличается от своего аналога, аммиака
<https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%BC%D0%B8%D0%B0%D0%BA>. Его
химическая активность выше, чем у аммиака, он плохо растворим в воде
<https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%B0>, как основание
значительно слабее аммиака. Последнее объясняется тем, что связи H−P
поляризованы слабо и активность неподелённой пары электронов
<https://ru.wikipedia.org/wiki/%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D0%B0%D1%8F_%D0%BF%D0%B0%D1%80%D0%B0>
у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при
нагревании разлагается на элементы:
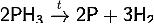
на воздухе самопроизвольно
воспламеняется (в присутствии паров дифосфина
<https://ru.wikipedia.org/wiki/%D0%94%D0%B8%D1%84%D0%BE%D1%81%D1%84%D0%B8%D0%BD>
или при температуре свыше 100 °C)
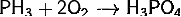
Проявляет сильные восстановительные
свойства:



При взаимодействии с сильными
донорами
<https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B2%D1%8F%D0%B7%D1%8C>
протонов фосфин может давать соли фосфония <https://ru.wikipedia.org/w/index.php?title=%D0%A4%D0%BE%D1%81%D1%84%D0%BE%D0%BD%D0%B8%D0%B9&action=edit&redlink=1>,
содержащие ион PH4+ (аналогично аммонию
<https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%BC%D0%BE%D0%BD%D0%B8%D0%B9>).
Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко
гидролизуется
<https://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%B4%D1%80%D0%BE%D0%BB%D0%B8%D0%B7>.


Соли фосфония, как и сам фосфин,
являются сильными восстановителями
<https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D0%B8>.
Фосфи́ды - бинарные
соединения
<https://ru.wikipedia.org/wiki/%D0%91%D0%B8%D0%BD%D0%B0%D1%80%D0%BD%D1%8B%D0%B5_%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F>
фосфора
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%BE%D1%80> с
другими менее электроотрицательными химическими элементами
<https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82>,
в которых фосфор проявляет отрицательную степень окисления
<https://ru.wikipedia.org/wiki/%D0%A1%D1%82%D0%B5%D0%BF%D0%B5%D0%BD%D1%8C_%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F>.
Химические свойства: Фосфиды
металлов - неустойчивые соединения, которые разлагаются водой
<https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%B0> и разбавленными
кислотами
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0>.
При этом получается фосфин
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%B8%D0%BD> и, в
случае гидролиза
<https://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%B4%D1%80%D0%BE%D0%BB%D0%B8%D0%B7>,
-гидроксид <https://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%B4%D1%80%D0%BE%D0%BA%D1%81%D0%B8%D0%B4>
металла, в случае взаимодействия с кислотами - соли.
Ca3P2
+ 6H2O → 3Ca(OH)2 + 2PH33P2 +
6HCl → 3CaCl2 + 2PH3
При умеренном нагревании
большинство фосфидов разлагаются. Плавятся под избыточным давлением паров
фосфора.
Фосфид бора BP, наоборот,
тугоплавкое (tпл. 2000 °C, с разложением), весьма инертное вещество.
Разлагается только концентрированными кислотами-окислителями, реагирует при
нагревании с кислородом <https://ru.wikipedia.org/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4>,
серой <https://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D1%80%D0%B0>, щелочами
<https://ru.wikipedia.org/wiki/%D0%A9%D0%B5%D0%BB%D0%BE%D1%87%D1%8C> при
спекании.
Фосфи́новые кисло́ты -
фосфорсодержащие органические соединения
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%BE%D1%80%D0%B3%D0%B0%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F>
общей формулы R2P(=O)OH, формально являющиеся замещенными
производнымифосфиновой кислоты
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%BD%D0%BE%D0%B2%D0%B0%D1%82%D0%B8%D1%81%D1%82%D0%B0%D1%8F_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0>
Н2P(=O)OH.
Соли и сложные эфиры
<https://ru.wikipedia.org/wiki/%D0%A1%D0%BB%D0%BE%D0%B6%D0%BD%D1%8B%D0%B5_%D1%8D%D1%84%D0%B8%D1%80%D1%8B>
фосфиновых кислот - фосфинаты
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%B8%D0%BD%D0%B0%D1%82%D1%8B>.
В спектре ЯМР
<https://ru.wikipedia.org/wiki/%D0%AF%D0%9C%D0%A0> 31P
химические сдвиги для фосфиновых кислот находятся в области 22-75 м.д., полоса
поглощения в ИК спектре связи P=O в области 1140-1210 см−1.
Химические свойства:
Основные реакции:
1. Образование ангидридов
<https://ru.wikipedia.org/wiki/%D0%90%D0%BD%D0%B3%D0%B8%D0%B4%D1%80%D0%B8%D0%B4%D1%8B>
при 400°С:

. Образование эфиров при действии
катализатора
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%82%D0%B0%D0%BB%D0%B8%D0%B7%D0%B0%D1%82%D0%BE%D1%80>:
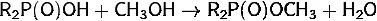
. Разрыв связей P-С при действии
растворов щелочей.
. Восстановление до фосфинов
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%B8%D0%BD%D1%8B>:

Фосфиты - соли
ортофосфористой кислоты <https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D1%81%D1%82%D0%B0%D1%8F_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0>
Н3РО3. Анион
<https://ru.wikipedia.org/wiki/%D0%90%D0%BD%D0%B8%D0%BE%D0%BD>
ортофосфористой кислоты <https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%B8%D1%81%D1%82%D0%B0%D1%8F_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0>
(HPO32−) является многоатомным ионом
<https://ru.wikipedia.org/wiki/%D0%98%D0%BE%D0%BD>, в котором центральным
атомом является атом фосфора
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%BE%D1%80> в
степени окисления +3. Его молекулярная геометрия приблизительно тетраэдрическая
<https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D1%82%D1%80%D0%B0%D1%8D%D0%B4%D1%80>.
Связывание может быть объяснено с помощью
резонансных структур, существует три эквивалентые структуры, содержащие одну
двойную связь эффективно делокализующие отрицательные заряды между
эквивалентными атомами кислорода. Четыре резонансные структуры фосфит-иона:
 <https://commons.wikimedia.org/wiki/File:Phosphite-ion-resonance-structures-2D.png?uselang=ru>
<https://commons.wikimedia.org/wiki/File:Phosphite-ion-resonance-structures-2D.png?uselang=ru>
Множество солей фосфористой кислоты,
такие как фосфит аммония, очень хорошо растворимы в воде. Иногда название
фосфиты относят также к эфирам
<https://ru.wikipedia.org/wiki/%D0%A1%D0%BB%D0%BE%D0%B6%D0%BD%D1%8B%D0%B5_%D1%8D%D1%84%D0%B8%D1%80%D1%8B>
этой кислоты, фосфорорганическим соединениям
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%BE%D1%80%D0%B3%D0%B0%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F>
с формулой P(OR)3.
Фосфоновые кислоты - тип
фосфорсодержащих органических соединений
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%BE%D1%80%D0%B3%D0%B0%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F>.
Общая формула R-PO(OH)2. Есть связь «углерод-фосфор» Один из
важнейших типов фосфоорганических соединений.
Физические свойства:
Гигроскопичные белые кристаллы
<https://ru.wikipedia.org/wiki/%D0%9A%D1%80%D0%B8%D1%81%D1%82%D0%B0%D0%BB%D0%BB%D1%8B>,
с четкими температурами плавления. В среднем - около 2000С
В спектрах ЯМР 31P химически сдвиги
для Фосфоновых кислот лежат в области 5-31 м д., полосы поглощения связи P = O
в инфракрасных спектрах -в области 1150-1220 см −1.
Химические свойства: образование
солей <https://ru.wikipedia.org/wiki/%D0%A1%D0%BE%D0%BB%D0%B8> с
основаниями <https://ru.wikipedia.org/wiki/%D0%9E%D1%81%D0%BD%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5_(%D1%85%D0%B8%D0%BC%D0%B8%D1%8F)>
Они бывают как кислыми, так и
средними, в зависимости от количества объёмов основания и кислоты, так как
фосфоновые кислоты двухосновны.
CH3-PO(OH)2+2NaOH=CH3-PO(ONa)23-PO(OH)2+NaOH=CH3-PO(OH)(ONa)
· образуют эфиры
<https://ru.wikipedia.org/wiki/%D0%AD%D1%84%D0%B8%D1%80%D1%8B> и
ангидриды
<https://ru.wikipedia.org/wiki/%D0%90%D0%BD%D0%B3%D0%B8%D0%B4%D1%80%D0%B8%D0%B4%D1%8B>
Фосфонаты - сложные
эфиры <https://ru.wikipedia.org/wiki/%D0%A1%D0%BB%D0%BE%D0%B6%D0%BD%D1%8B%D0%B5_%D1%8D%D1%84%D0%B8%D1%80%D1%8B>
фосфоновых кислот
<https://ru.wikipedia.org/wiki/%D0%A4%D0%BE%D1%81%D1%84%D0%BE%D0%BD%D0%BE%D0%B2%D1%8B%D0%B5_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B>
общей формулы RP(O)(OR1)n(OH)2-n. В
зависимости от числа гидроксильных групп фосфонаты делятся на первичные (n=1,
кислые фосфонаты), и вторичные (п = 2, полные фосфонаты).
Фосфонаты с низшими алкильными,
алкенильными и арильными заместителями - бесцветные жидкости, фосфонаты с высокими
молекулярными массами - масла или кристаллы. Связи при атоме фосфора имеют
тетраэдрическую конфигурацию, в ИК-спектрах присутствует характеристическая
полоса связи P=O при 1200-1280 см−1.
Химические свойства: Первичные
фосфонаты являются умеренно сильными кислотами (например, для n-ClC6H4P(O)(OC4H9)OH
рКа = 1,7) и образуют соли аминами, вторичные образуют аддукты
<https://ru.wikipedia.org/wiki/%D0%90%D0%B4%D0%B4%D1%83%D0%BA%D1%82> с
кислотами Льюиса (например, с галогенидами бора).
Первичные фосфонаты при нагревании
диспропорционируют с образованием полифосфатов, вторичные диалкилфосфонаты при
нагревании выше 150°С разлагаются с образованием первичных фосфонатов и
алкенов:
RP(O)(CH2CH2R1)2
 RP(O)(OH)CH2CH2R1
+ R1CH=CH2
RP(O)(OH)CH2CH2R1
+ R1CH=CH2
При взаимодействии с
пятихлористым фосфором и первичные, и вторичные фосфонаты образуют
хлорангидриды фосфоновых кислот:
RP(O)R12
+ PCl5  RP(O)R1Cl
+ R1Cl + POCl3
RP(O)R1Cl
+ R1Cl + POCl3
6. Качественные
реакции
) Характерной реакцией на ионы NH4+
является реакция с щелочью. При нагревании выделяется газообразный аммиак,
который можно обнаружить по запаху или по посинению мокрой, красной лакмусовой
бумажки.
(NH4)2SO4
+ 2KOH = K2SO4 + 2NH3 + H2O
NH4+ + SO42-
+ 2K+ + 2OH- = 2K+ + SO42- + 2NH3 +
2H2O
NH4+ + 2OH- =
2NH3 + 2H2O4+ + OH- = NH3
+ Н2О
) 5NaNO2 + 3H2SO4
+ 2KMnO4 = 5NaNO3 + 2MnSO4 + 3H2O +
K2SO4
3) Реакция с медью и серной кислотой.
Анион NО3- восстанавливается металлической медью в
присутствии серной кислоты до оксида азота:
8NaNO3 + 4H2SO4
+ 3Cu = 2NO↑ + 3Сu(NO3)2
+ 4Н2O.
Выделяющийся оксид азота окисляется кислородом
воздуха до бурого диоксида NO2:
+ O2 = 2NO2↑.
) Фосфат натрия Na3PO4 содержит фосфат-ион -
кислотный остаток фосфорной кислоты. К раствору фосфата натрия добавим нитрат
серебра.
3PO4
+ 3AgNO3= Ag3PO4 ↓ +3 NaNO3
Ион серебра и фосфат-ион образуют нерастворимое
вещество желтого цвета - фосфат серебра. Реакция образования желтого фосфата
серебра - качественная реакция на фосфат-ион, реакция, которая позволяет обнаружить
фосфат-ион в растворе.
7. Обнаружение мышьяка в
биологических объектах
Реакция
<#"877552.files/image027.gif">
Мышьяк
<#"877552.files/image028.jpg">
Реакцию
<http://www.xumuk.ru/bse/2325.html> Марша выполняют в специальном
аппарате (рис. 8), который состоит из колбы
<http://www.xumuk.ru/bse/1314.html> 1, капельной воронки 2, хлор
<http://www.xumuk.ru/encyklopedia/2/5028.html>кальциевой трубки 3 и
восстановительной трубки 4. Отверстие колбы
<http://www.xumuk.ru/bse/1314.html> аппарата Марша имеет пришлифованную
поверхность и закрывается пришлифованной пробкой, в которую впаяны капельная
воронка и отводная трубка. Восстановительная трубка аппарата Марша
изготовляется из тугоплавкого стекла (диаметр 4 мм) или кварца
<http://www.xumuk.ru/encyklopedia/1950.html>. В нескольких местах этой
трубки имеются сужения (диаметр 1,5 мм), а конец ее согнут почти под прямым
углом и вытянут в острие. Между отводной и восстановительной трубками
помещается хлоркальциевая трубка, заполненная безводным хлоридом кальция
<http://www.xumuk.ru/encyklopedia/1835.html>, предназначенным для
осушивания газов <http://www.xumuk.ru/encyklopedia/879.html>, выходящих
из колбы <http://www.xumuk.ru/bse/1314.html> аппарата. Колбу
<http://www.xumuk.ru/bse/1314.html>, хлоркальциевую и восстановительную
трубки соединяют друг с другом (стык в стык) при помощи кусочков резинового
шланга. Собранный таким образом аппарат Марша должен быть герметичным.
Определение мышьяка
<http://www.xumuk.ru/encyklopedia/2726.html> с помощью реакции
<http://www.xumuk.ru/bse/2325.html> Марша выполняют в три этапа. Вначале
проверяют реактивы на отсутствие в них мышьяка
<http://www.xumuk.ru/encyklopedia/2726.html>, затем определяют мышьяк
<http://www.xumuk.ru/encyklopedia/2726.html> в исследуемом растворе
<http://www.xumuk.ru/encyklopedia/2/3823.html> и, наконец, проверяют
подлинность налета, образовавшегося в восстановительной трубке.
. Медико-биологическое значение
элементов VA-группы
Азот.
Это один из важнейших биогенных элементов. Содержание его в живых организмах в
расчёте на сухое вещество составляет примерно 3%. Азот входит в состав аминокислот,
белков, нуклеотидов, нуклеиновых кислот, биогенных аминов и т.д.
Мы живет в атмосфере азота (объёмная доля азота
в воздухе составляет 78%), обогащенной кислородом и в очень малых количествах -
другими элементами. Без азот трудно представить себе жизнь на Земле. Азот и
жизнь - понятия неразделимые. Жизнь во многом обязана именно азоту, а азот
своим происхождением и существованием в биосфере обязан жизненным процессам.
Молекулярный азот участия в обмене веществ не
принимает. Человек использует азот органических соединений.
Азот - не только носитель жизни. Азотные
соединения, особенно нитраты, вредны для орг8анизма и могут быть причиной
отравлений.
В медицине применяются:2O - оксид
азота (I), или «веселящий газ», в смеси с кислородом используется в качестве
наркотического средства;4OH - водный раствор аммиака (нашатырный
спирт), используется для возбуждения дыхания и выведения больных из обморочного
состояния.
Фосфор.
Фосфор является пятым из важнейших для биологии элементом вслед за углеродом,
водородом, кислородом и азотом.
Фосфаты играют две ключевые роли. Во-первых, они
служат структурными элементами ряда биологических систем, например,
сахарофосфатный остов нуклеиновых кислот или отложение фосфата кальция костей и
зубов. У человека в костях содержится 5%, а в зубной эмали - 17% фосфора.
Вторая роль производных иона ортофосфата связана с переносом энергии.
В медицине применяется аденозинтрифосфорная
кислота (АТФ), назначается при хронической коронарной недостаточности, мышечной
дистрофии и атрофии, спазмах периферических сосудов.
Мышьяк.
Биологическая роль мышьяка изучена не до конца. В экспериментах на животных
было показано, что рационы, бедные по содержанию мышьяка, вызывают снижение
массы приплода, увеличению числа выкидышей, увеличению смертности как матерей,
так и приплода, снижению воспроизводительной функции. Следует также отметить,
что мышьяк - один из наиболее токсичных элементов
<http://eat-info.ru/references/pollutants/>.
Висмут. Содержание
висмута в человеческом организме составляет:
· мышечная ткань - 0,32×10−5
%
· костная ткань -
менее 0,2×10−4
%
· кровь - ~0,016 мг/л
· ежедневный приём с
пищей 0,005-0,02 мг.
Содержание в организме среднего
человека (масса тела ~70 кг) невелико, но точные данные отсутствуют. Данные о
токсической и летальной дозах также отсутствуют. Однако известно, что висмут
при пероральном приеме малотоксичен. Это кажется неожиданным, так как обычно
тяжелые металлы весьма ядовиты, но объясняется легкостью гидролиза
<https://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%B4%D1%80%D0%BE%D0%BB%D0%B8%D0%B7>
растворимых соединений висмута. В интервале величин pH
<https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%BD%D1%8B%D0%B9_%D0%BF%D0%BE%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D0%B5%D0%BB%D1%8C>,
встречающихся в человеческом организме (за исключением, может быть, желудка)
висмут практически полностью осаждается в виде нерастворимых основных солей.
Тем не менее, при совместном приёме висмута с веществами, способными перевести
его в раствор (глицерин, молочная кислота и т. п.) возможно тяжёлое отравление.
При проглатывании большого количества концентрированных растворов нитрата и
других солей висмута значительную опасность представляет высокая концентрация
свободной кислоты, образовавшейся вследствие гидролиза.
Склонностью к гидролизу и низкой
токсичностью обусловлено применение основных солей (субцитрата, основного
нитрата и др.) висмута в качестве препаратов для лечения язвы желудка
<https://ru.wikipedia.org/wiki/%D0%AF%D0%B7%D0%B2%D0%B0_%D0%B6%D0%B5%D0%BB%D1%83%D0%B4%D0%BA%D0%B0>.
Помимо нейтрализации кислоты и защиты стенок желудка коллоидным осадком, висмут
проявляет активность против бактерии Helicobacter pylori
<https://ru.wikipedia.org/wiki/Helicobacter_pylori>, которая играет
существенную роль в развитии язвенной болезни желудка.
Сурьма. Сурьма
относится к микроэлементам. Её содержание в организме человека составляет 10−6
% по массе. Постоянно присутствует в живых организмах, физиологическая и
биохимическая роль не выяснена. Сурьма проявляет раздражающее и кумулятивное действие.
Накапливается в щитовидной железе
<https://ru.wikipedia.org/wiki/%D0%A9%D0%B8%D1%82%D0%BE%D0%B2%D0%B8%D0%B4%D0%BD%D0%B0%D1%8F_%D0%B6%D0%B5%D0%BB%D0%B5%D0%B7%D0%B0>,
угнетает её функцию и вызывает эндемический зоб <https://ru.wikipedia.org/wiki/%D0%AD%D0%BD%D0%B4%D0%B5%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D0%B7%D0%BE%D0%B1>.
Однако, попадая в желудочно-кишечный тракт
<https://ru.wikipedia.org/wiki/%D0%96%D0%B5%D0%BB%D1%83%D0%B4%D0%BE%D1%87%D0%BD%D0%BE-%D0%BA%D0%B8%D1%88%D0%B5%D1%87%D0%BD%D1%8B%D0%B9_%D1%82%D1%80%D0%B0%D0%BA%D1%82>,
соединения сурьмы не вызывают отравления, так как соли Sb(III) там
гидролизуются с образованием малорастворимых продуктов. При этом соединения
сурьмы (III) более токсичны, чем сурьмы (V). Пыль и пары Sb вызывают носовые
кровотечения, сурьмяную «литейную лихорадку», пневмосклероз, поражают кожу,
нарушают половые функции. Порог восприятия привкуса в воде - 0,5 мг/л.
Смертельная доза для взрослого человека - 100 мг, для детей - 49 мг. Для
аэрозолей сурьмы ПДК в воздухе рабочей зоны 0,5 мг/м³, в
атмосферном воздухе 0,01 мг/м³. ПДК в почве 4,5 мг/кг. В питьевой
воде сурьма относится ко 2 классу опасности, имеет ПДК 0,005 мг/л,
установленное по санитарно-токсикологическому лимитирующему признаку вредности
<https://ru.wikipedia.org/w/index.php?title=%D0%9B%D0%B8%D0%BC%D0%B8%D1%82%D0%B8%D1%80%D1%83%D1%8E%D1%89%D0%B8%D0%B9_%D0%BF%D1%80%D0%B8%D0%B7%D0%BD%D0%B0%D0%BA_%D0%B2%D1%80%D0%B5%D0%B4%D0%BD%D0%BE%D1%81%D1%82%D0%B8&action=edit&redlink=1>.
В природных водах норматив содержания составляет 0,05 мг/л. В сточных
промышленных водах, сбрасываемых на очистные сооружения, имеющие биофильтры,
содержание сурьмы не должно превышать 0,2 мг/л.
Список литературы
1. Введение
в химию биогенных элементов и химический анализ. Под ред. Е.В. Барковского.
Минск, 1997. - 176 с.
. Дж.
Хьюз. Неорганическая химия биологических процессов / Пер. с англ. Новодаровой;
под ред. М.Е. Вальпина. - М.: Мир, 1983.
. Ершова
- М.: Высшая школа, 2007г. - 560с.
. К.Н.Зеленин,
В.В.Алексеев. Химия общая и биоорганическая. - СПб.: Элби-СПб, 2008. - 712 с.
. Н.Л.
Глинка. Общая химия. Л.: Химия, 1979 (и далее).
. Общая
химия. Биофизическая химия. Химия биогенных элементов: Учебное пособие для
студентов медицинских вузов/ Под ред. Ю.А.
. Общая
химия: учебник/А.В. Жолнин; под ред. В.А. Попкова, А.В. Жолина.- М.:ГЭОТАР-
Медиа, 2012.-400с.
. Пузаков
С.А. Химия: учебник для факультета ВСО - М.: ГЭОТАР-Медиа, 2008. - 640 с.
. Руководство
к лабораторным занятиям по биоорганической химии/ под ред. Н.А. Тюкавкиной. -
М.: Дрофа 5 изд., 2009г. - 318с
. Тюкавкин
Н.А., Бауков Ю.И. Биоорганическая химия: Учебник. - М.: Дрофа 7 изд., 2008г. -
543с.