Химическая кинетика
Реферат
Химическая
кинетика
. Понятие о химической кинетике. Скорость химической
реакции
Химические превращения могут протекать с различными скоростями. Время
некоторых процессов исчисляется годами и даже тысячелетиями, другие протекают практически
мгновенно, в последнем случае реакции могут сопровождаться взрывом.
●Химическая кинетика изучает механизмы
химических реакций, скорость реакций и факторы, влияющие на скорость.
Основополагающим в химической кинетике является
понятие о скорости химической реакции. Его можно ввести как с микроскопических,
так и с макроскопических позиций.
●Скорость химической реакции - это количество элементарных актов
химического взаимодействия, происходящих в единицу времени в единице объема.
Однако, пересчитать эти акты химического взаимодействия невозможно, поэтому
удобнее определять скорость реакции через макроскопические величины, например,
количество вещества, образующегося или расходуемого в процессе превращения.
Чтобы судить о скорости какого-либо процесса, достаточно знать изменение
количества только одного из веществ, участвующих в реакции, поскольку все
вещества реагируют друг с другом в эквивалентных количествах и связаны между
собой стехиометрическими коэффициентами в уравнении реакции.
Если рассматривать химическую реакцию, протекающую в гомогенной системе,
то скорость можно определить как изменение концентрации вещества в единицу
времени
V = ± ΔC/Δτ (1)
Знак «+» ставится, когда скорость процесса определяют по концентрации
продуктов реакции: концентрация продуктов реакции с течением времени
возрастает, следовательно, С2 > С1 и ∆С > 0.
Знак «-» нужно относить к изменению концентрации исходных веществ; их
концентрации уменьшаются, поэтому, С2 < С1 и ∆С < 0.
Для гетерогенных процессов скорость определяют чаще всего как изменение
концентрации продуктов реакции в единицу времени, на единице поверхности
раздела фаз
V = ± ΔC/( S
•Δτ) (2)
Из-за непрерывного изменения концентрации реагирующих веществ, скорость
реакции не может оставаться постоянной, поэтому, приведенные выше уравнения
характеризуют лишь среднюю скорость в пределах некоторого отрезка времени Δτ = τ2 - τ1.
В зависимости от природы реагентов, концентрация веществ может изменяться
как линейно, так и нелинейно. Поэтому вводится понятие мгновенной (или
истинной) скорости химической реакции
мгн..= = ± dC/dτ (3)
Скорость химической реакции зависит от очень многих факторов - природы и
концентрации реагирующих веществ, степени измельчения твердых веществ,
температуры, присутствия катализатора или ингибитора, значения рН среды и т.д.
2. Закон действия масс
Взаимодействие молекул возможно только в момент их столкновения.
Вероятность столкновения зависит от количества молекул в единице объёма, т.е.
от концентрации веществ.
Зависимость скорости реакции от концентрации реагирующих веществ
определяется основным законом химической кинетики - законом действующих масс
Гульдберга-Вааге:
При постоянной температуре скорость одностадийной химической реакции
прямо пропорциональна произведению концентраций реагирующих веществ, взятых в
степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции общего вида
аА + bB = cC + dD
математическое выражение закона действующих масс имеет следующий вид:
= k ∙ CAa ∙ CBb
или V = k ∙ [А]a ∙ [В]b , (4)
где CA и CB - молярные концентрации веществ А и В;
[А] и [В] - молярные концентрации взаимодействующих частиц;
а и b - стехиометрические коэффициенты в уравнении реакции;- константа
скорости реакции.
Чаще всего реакции протекают в несколько стадий. В этом случае скорость
химической реакции нужно определять скоростью самой медленной (лимитирующей)
стадии.
Коэффициент пропорциональности k (константа скорости реакции) при постоянной температуре есть величина
постоянная. Константа скорости численно определяется как скорость реакции при
единичных концентрациях реагирующих веществ, т.е. может быть определена как
удельная скорость. Константа скорости реакции зависит от химической природы
реагирующих веществ, температуры и некоторых других факторов, но не зависит от
концентрации реагирующих веществ. Т.е. константа скорости химической реакции
характеризует скорость реакции при данной температуре и является мерой
реакционной способности веществ.
Если в реакции участвуют газообразные вещества, то концентрации таких
веществ заменяют на их парциальное давление. Математическое выражение закона
действия масс для реакции С + О2 = СО2 будет иметь следующий вид:
= k ∙ р (О2)
где р (О2) - парциальное давление кислорода.
Поэтому, в системах с участием газообразных веществ, скорость химической
реакции зависит от давления.
Например, если при взаимодействии водорода с парами йода по уравнению
2 + I2 = 2HI
увеличить давление в 3 раза, то объем системы уменьшится во столько же
раз, и, следовательно, во столько же раз возрастет концентрация каждого из
реагирующих газообразных веществ. Скорость реакции при этих условиях, согласно
закону действия масс, возрастет в 9 раз.
Пример 1.
Определить, как изменится скорость реакции
(г.) + 2B(г.) = C(г.)
если концентрацию вещества A
увеличить в два раза, а концентрацию вещества B увеличить в три раза.
Решение:
Согласно закону действующих масс:
= k ∙ [A] ∙ [B]2.
При изменении концентраций реагирующих веществ по
условию задачи, выражение для скорости реакции записываем так:
' = k ∙ (2[A]) ∙ (3[B])2
=18 k [A] ∙ [B]2 .
Если сравнить выражения для скоростей реакции до и после изменения
концентраций веществ, можно увидеть, что скорость увеличилась в 18 раз:
' / V = 18.
Таким образом, закон действия масс позволяет
определять, как изменяются скорости реакций при изменении концентраций
реагирующих веществ.
Для гетерогенных процессов, которые протекают только на поверхности
раздела фаз, имеет значение площадь соприкосновения реагирующих веществ,
которая обусловлена степенью измельчения твердого вещества. Степень измельчения
поверхности твердого тела - важный фактор, который учитывается константой
скорости реакции. Поэтому, пока величина поверхности твердого тела остается
практически постоянной, скорость гетерогенной реакции зависит только от концентрации
веществ (растворенных или газообразных). Поэтому, для гетерогенных систем в
выражение скорости реакции не входит концентрация (точнее, парциальное
давление) твердого вещества.
Например, скорость реакции С + О2 = СО2 пропорциональна только концентрации
кислорода:
= k ∙ [О2].
В общем случае скорость гетерогенных реакций зависит от:
скорости подвода реагентов к границе раздела фаз;
скорости реакции на поверхности раздела фаз, которая зависит от площади
этой поверхности (чаще всего самой медленной);
скорости отвода продуктов реакции от границы раздела фаз.
Универсального выражения для скорости гетерогенных реакций не существует,
поскольку каждая из стадий при определенных условиях может быть лимитирующей.
Но в некоторых случаях, когда диффузионные стадии заведомо не являются
лимитирующими из-за активного перемешивания реагентов, а площадь поверхности
раздела фаз меняется медленно, можно экспериментально получить кинетические
уравнения типа, удовлетворительно описывающие протекание гетерогенных реакций. Это
имеет важное значение для химического производства, где большинство
используемых реакций является гетерогенными
кислород водород скорость реакция
3. Влияние природы реагирующих веществ на скорость
химических реакций
Под влиянием природы реагирующих веществ обычно подразумевают то, что
разные вещества реагируют по-разному. Проанализируем несколько примеров разной
реакционной способности сходных по строению веществ в однотипных реакциях.
Например, газообразный йодоводород реагирует с кислородом при комнатной
температуре с заметной скоростью по уравнению:
HI + O2 = 2 H2O + 2 I2
Аналогичная реакция газообразного хлороводорода с кислородом при
комнатной температуре с образованием хлора и воды идет очень медленно. Обе
реакции - окислительно-восстановительные и для их протекания атом галогена в
молекулах HCl или HI должен передать электрон кислороду. Иод в молекуле HI -
более подходящий донор электрона, т.к. его валентная оболочка находится
существенно дальше от ядра, чем у атома хлора в молекуле HCl.
Таким образом, знание электронного строения атомов и молекул реагирующих
веществ часто позволяет качественно оценить относительные скорости некоторых
реакций.
. Молекулярность реакции. Механизмы химических реакций
Число частиц, которые участвуют в элементарном акте
химического взаимодействия, называется молекулярностью реакции.
Если в элементарном акте взаимодействия участвует
только одна молекула, то реакция называется мономолекулярной, если участвуют
две молекулы - бимолекулярной, если три - тримолекулярной. Вероятность
соударения одновременно большего числа частиц очень мала, поэтому
тримолекулярные реакции встречаются очень редко, а реакции с участием четырех и
более молекул вообще неизвестны. Вероятность столкновения четырех и более
частиц одновременно в одной точке пространства стремится к нулю.
Большинство известных реакций являются сложными
реакциями и их протекание включает несколько стадий.
●Совокупность всех стадий реакции называется
механизмом реакции.
По типу механизма все реакции можно разделить на 3 группы
- параллельные, последовательные, сопряженные реакции и их комбинации.
Пример такой реакции можно представить следующей
схемой:
V1 B
A
V2 C
Если каждая из реакций является мономолекулярной, то суммарная скорость
реакции равна сумме скоростей отдельных стадий:
общ.= V1 + V2
Так протекает термическое разложение бертолетовой соли (хлората калия).
Одновременно происходят два процесса:
KCl + O2
KClO3
KClO4 + KCl
●Последовательными реакциями называется
связанная система реакций, в которых продукты предыдущих стадий являются
исходными веществами для последующих стадий.
Схематично это можно изобразить так:
V1 V2
A → B → C
Продукт В, который накапливается при протекании первой
стадии реакции, одновременно является исходным веществом для второй стадии
процесса, т.е. он расходуется на второй стадии. Такие вещества называются
промежуточными продуктами.
Количество стадий последовательных реакций может быть
очень большим. Различные стадии могут протекать с различными скоростями.
Суммарная скорость последовательных реакций будет определяться скоростью самой
медленной стадии, которая называется лимитирующей или скоростьопределяющей
стадией.
Взаимодействие тиосульфата натрия с кислотой можно считать
последовательной реакцией:
S2O3 + H2SO4 → H2S2O3 + Na2SO4 →
S + SO2 + H2O + Na2SO4
Здесь, первая стадия протекает практически мгновенно, а появление
нерастворимой серы - процесс относительно медленный.
●Две реакции, одна из которых индуцирует
протекание другой, называются сопряженными. Формально, сопряженные реакции
подобны параллельным реакциям, однако, они могут протекать только совместно.
Такие реакции часто имеют место в биологических объектах, когда протекание
одной реакции индуцирует протекание другой. Синтез некоторых белков не может
осуществляться без затрат энергии, т.е. не может протекать самопроизвольно. С
другой стороны, переработка углеводов протекает самопроизвольно и как раз с
выделением требуемого количества энергии. Самопроизвольное протекание одной
реакции индуцирует протекание другой, не протекающей самопроизвольно в данных
условиях.
Реально протекающие реакции могут быть сложными
комбинациями последовательных и параллельных стадий.
Например, цепные реакции, которые протекают через
образование свободных радикалов - частиц с неспаренными электронами. Примером
цепной реакции является взаимодействие хлора с водородом:
2 + Cl2 =
2HCl
Сначала происходит разрыв связей в молекулах хлора под
действием кванта света или при действии высокой температуры (зарождение цепи):
2 + hν → 2 Cl·
Затем каждый из радикалов участвует в следующих, чередующихся стадиях
(развитие цепи):
2 + Cl∙ → HCl + H∙
Н∙ + Cl2 → HCl +Cl∙
H2 + Cl∙
→ HCl + Н∙ и т.д.
Видно, что суммарный процесс является
последовательно-параллельным.
Цепной процесс продолжается до тех пор, пока имеются в
наличии исходные вещества или пока свободные радикалы не прореагируют друг с
другом (обрыв цепи):
∙ + Cl∙ = Cl2;
H∙ + H∙
= H2;
H∙ + Cl∙ = HCl
Цепные реакции могут протекать также по разветвленному
механизму, когда единичная реакция с участием одного свободного радикала
приводит к возникновению более чем одного нового свободного радикала.
Такое «размножение» радикалов приводит к
лавинообразному течению процесса, которое может вызвать взрыв. Так, например,
протекает процесс взаимодействия кислорода с водородом. На первой стадии
молекула Н2 распадается на два радикала Н∙ и затем развивается цепь
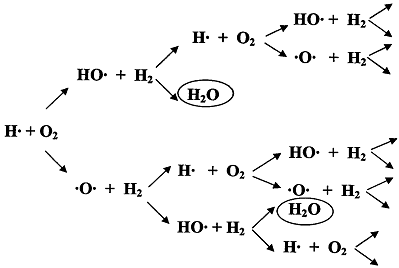
превращений (см. рисунок). Овалами обведены стадии образования продукта реакции
(воды), где происходит обрыв цепи. Здесь также к обрыву цепи может привести
"встреча" двух радикалов.
. Порядок реакции
Чтобы записать кинетическое уравнение реакции,
необходимо экспериментально определить величину константы скорости и
показателей степени при концентрациях реагирующих веществ. Показатель степени
при концентрации каждого из реагирующих веществ в кинетическом уравнении
химической реакции есть частный порядок реакции по данному веществу. Сумма
показателей степеней в кинетическом уравнении химической реакции представляет
собой общий порядок реакции.
Порядок химической реакции есть формально-кинетическое понятие,
физический смысл которого для элементарных (т.е. одностадийных) реакций
заключается в следующем: порядок реакции равен числу одновременно изменяющихся
концентраций. В случае элементарных реакций порядок реакции может быть равен
сумме коэффициентов в стехиометрическом уравнении реакции и совпадать с
молекулярностью реакции; однако в общем случае порядок реакции определяется
только экспериментально, зависит от условий проведения реакции и не связан со
стехиометрическими коэффициентами при реагентах в уравнении реакции.
Стехиометрическое уравнение реакции представляет собой уравнение материального
баланса и не может определять характера протекания этой реакции во времени. Поэтому
существуют реакции нулевого порядка (например, разложение некоторых соединений
на поверхности различных фаз), дробного и даже отрицательного порядка.
. Влияние температуры на скорость химических реакций
Скорость химических реакций сильно зависит от температуры.
В 1879 году голландский ученый Вант-Гофф предложил
простое эмпирическое правило:
При увеличении температуры на каждые десять градусов, скорость гомогенной
реакции возрастает в 2 ÷ 4 раза.
Можно представить это правило следующим математическим выражением:
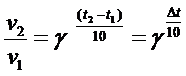 (5)
(5)
где
γ = 2 ÷ 4 -
температурный коэффициент реакции,
∆t
= t2 - t1.
Пример 2.
Определить, как изменится скорость реакции при
повышении температуры от 20оС до 50оС, если температурный коэффициент реакции
равен трем (γ = 3).
Решение:
Согласно правилу Вант-Гоффа, можно записать следующее соотношение:
(50-20)/10
V2 / V1 =
3 = 33 = 27.
Следовательно, скорость процесса возросла в 27 раз.
В чем причины возрастания скорости реакции при
повышении температуры?
Происходит это не из-за увеличения числа столкновений
частиц. Доказано, что при увеличении температуры на десять градусов, число
столкновений молекул возрастает только на 2-5 %, а скорость, по правилу
Вант-Гоффа, возрастает в 2 - 4 раза! Кроме того, что при нормальных условиях в
газообразной системе объемом 1 см3 число столкновений достигает порядка 1028 в
секунду. Если бы все столкновения приводили к элементарным актам химического
взаимодействия, то все реакции протекали бы с взрывом. Большинство реакций
имеют значительно меньшие скорости.
Чтобы объяснить такую закономерность протекания
реакций, используем теорию активных столкновений и понятие энергии активации Ea.
●Энергия активации это минимальная энергия частицы, достаточная для
осуществления элементарного акта химического взаимодействия. Молекулы,
обладающие энергией равной или большей, чем энергия активации, называются
активными.
Энергия активации определяется природой реагирующих веществ и отвечает
необходимости ослабления связей в исходных молекулах. Доля реакционноспособных,
т.е. активных молекул, ничтожно мала. Большинство молекул в системе такой
энергией не обладают, поэтому далеко не всякое столкновение способно привести к
химическому взаимодействию.
Согласно молекулярно-кинетической теории газов,
молекулы любой сложной системы распределяются по энергиям, т.е. обладают
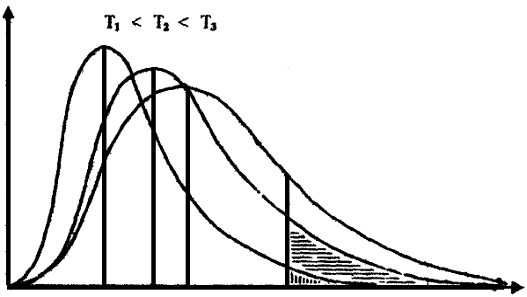
различным запасом энергии. Такое распределение можно схематично представить
следующим графиком (см. рисунок 1). По оси ординат отложена доля частиц с
определенной энергией, по оси абсцисс - энергия.
Доля частиц
 E
E
E1 E2 E3 Ea энергия
Рис. 1 - Распределение молекул по энергии при различных температурах
На графике представлены три случая распределения молекул по энергии для
различных температур. Из графика видно, что частицы обладают различной
энергией. Существует совсем немного частиц с очень малым значением энергии, также
невелико число частиц с очень большой энергией. На каждой кривой максимуму
соответствует область значений энергии, которые наиболее вероятны при данной
температуре. Площадь под кривой распределения соответствует полному числу
молекул системы. Видно, что с ростом температуры значение наиболее вероятной
энергии возрастает, кривая распределения становится более пологой, но площадь
под кривой остается неизменной.
Из представленного графика следует: число молекул,
обладающих энергией большей, чем энергия активации Еа, растет с увеличением
температуры. Для значения температуры Т1 это количество молекул изображено
площадью с вертикальной штриховкой, для температуры Т2 добавляется площадь с
горизонтальной штриховкой. Для температуры Т3 число молекул становится еще
больше.
Таким образом, при нагревании растет число активных
частиц, а значит, растет число «активных» столкновений, приводящих к
элементарным актам химического взаимодействия, а это, в свою очередь, ведет к
увеличению скорости химической реакции.
●Уравнение, отражающее зависимость константы скорости химической
реакции от температуры, называется уравнением Аррениуса
k = А ∙
e - (Ea/RT) (6)
Показательный характер данной зависимости определяет большие значения
температурного коэффициента (вспомните правило Вант-Гоффа).
Постоянная величина А, входящая в уравнение Аррениуса,
зависит от химической природы реагирующих веществ, а также от других факторов,
не связанных с температурой. Если подставить в уравнение Аррениуса значения R и T для температурных коэффициентов, определяемых правилом
Вант-Гоффа, то значения энергии активации будут лежать в интервале значений 50
- 100 кДж/моль.
Проделайте эти вычисления самостоятельно, используя правило Вант-Гоффа и
уравнение Аррениуса.
В настоящее время известно, что энергии активации многих реакций
оказываются как меньше, так и значительно больше этих значений.
При химическом взаимодействии, например водорода Н2 и йода I2, должны разорваться связи Н-Н и I-I в исходных молекулах и образоваться
новые связи в молекулах Н-I.
При сближении молекул H2 и I2 в некоторый момент времени
возникает переходное состояние, в котором старые связи уже ослаблены, а новые
еще не сформировались окончательно. Такое возбужденное нестабильное состояние
называется активным комплексом. Это можно представить следующей схемой:
H - H H…H H H
+ :
: | + |
I - I
I……I I I
Молекулы Активный
Молекулы
исходных комплекс
продуктов
веществ
Проведенные химиками расчёты показали, что процесс,
протекающий через образование активного комплекса, энергетически выгоднее, чем
возникновение новых связей после полного разрушения старых.
На рисунке 2 изображена энергетическая диаграмма реакции образования
йодоводорода из молекул йода и водорода. На диаграмме видно, насколько меньше
значение энергии активации для пути реакции через активированный комплекс, чем
через полный разрыв всех связей.

Координата реакции
Рисунок
2 - Энергетическая диаграмма реакции H2 + I2 = 2HI
Эта схема иллюстрирует, насколько важен для реально
протекающих процессов путь протекания реакции.
С точки зрения термодинамики безразлично, как будет
происходить процесс превращения веществ - ведь результат остается неизменным.
По кинетическим соображениям наиболее вероятен тот путь, который требует
меньшей энергии активации и развивается с максимальной скоростью.
Литература
Аналитическая химия. Физические и физико-химические методы анализа./ Под
ред. О.М.Петрухина. - М., 2005
Артеменко А.И. Органическая химия.- М., 2006
Ахметов Н.С. Общая и неорганическая химия.- М., 2003
Биологическая химия./ Под ред. Ю.Б. Филипповича, Н.И. Ковалевская,
Г.А.Севастьяновой . - М., 2005
Биохимия./Под редакцией В.Г.Щербакова. - СПб., 2003
Вольхин В.В. Общая химия. Избранные главы. - СПб, М, Краснодар., 2008
Вольхин В.В. Общая химия. Основной курс. - СПб, М, Краснодар., 2008
Гельфман М.И., Юстратов В.П. Химия. - СПб, М, Краснодар., 2008
Глинка Н.Л. Общая химия. - М., 2005
Говарикер В.Р., Васванатхан Н.В., Шридхар Дж.М. Полимеры. - М., 2000
Гранберг И.И. Органическая химия. - М., 2002
Дорохова Е.Н., Прохорова К.В. Аналитическая химия. Физико-химические
методы. - М., 2004
Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная
химия. - М., 1990
Зимон А.Д., Лещенко Н.Ф. Коллоидная химия.- М., 2003
Зимон А.Д. Физическая химия.- М., 2003
Ипполитов Е.Г., Артемов А.В., Батраков В.В. Физическая химия.- М., 2005
Ким А.М. Органическая химия. - Новосибирск, 2007
Коржуков Н.Г. Общая и неорганическая химия. - М., 2004
Коровин И.В. Общая химия. - М., 2005
Кругляков П.М.,Лещенко Н.Ф. Физическая и коллоидная химия. - М., 2007