Сравнение метрологических характеристик определения железа двумя методами
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Российский государственный университет нефти и газа
ИМЕНИ И.М. ГУБКИНА
Курсовая
работа на тему:
«Сравнение
метрологических характеристик определения железа двумя методами»
Москва
СОДЕРЖАНИЕ
Введение
. Литературный
обзор
.1. Комплексонометрическое
титрование
1.1.1 История появления метода
.1.2 Виды титриметрического анализа
.1.3 Комплексонометрический метод
.1.4 Методы определения железа
1.2 Фотометрический
метод
1.2.1 Определение
с О-фенантролином
1.2.2
Определение в виде тиоционатных комплексов
1.2.3
Определение с 1,10-ФЕНАНТРОЛИНОМ
1.2.4
Определение с сульфосалицилатом натрия
2. Экспериментальная
часть
2.1 Экспериментальные результаты
комплексонометрического титрования
.2 Экспериментальные результаты фотометрического
анализа
Выводы
Список
литературы
ВВЕДЕНИЕ
Цель работы: Исследовать метод комплексонометрического титрования,
фотометрический метод и их применение. Изучить методики
комплексонометрического, фотометрического исследования железа. Ознакомиться с
правилами изготовления и хранения рабочих растворов. Выбрать две методики для
сравнения метрологических характеристик и обосновать выбор. Освоить методики.
Сравнить метрологические характеристики результатов определения, полученные
экспериментальным путём. Сравнить метрологические характеристики методов .
1. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 КОМПЛЕКСОНОМЕТРИЧЕСКОЕ
ТИТРОВАНИЕ
.1.1 История появления метода
Титриметрический анализ (титриметрия) - важнейший из химических методов
анализа. Он возник в XVIII
веке, вначале как эмпирический способ проверки качества различных материалов,
например, уксуса, соды, отбеливающих растворов. На рубеже XVIII и XIX веков были изобретены бюретки и пипетки
(Ф.Декруазиль). Особое значение имели труды Ж.Гей-Люссака, который ввел
основные термины этого метода: титрование, титрант и другие,
происходящие от слова «титр». Титр - это масса растворенного вещества (в
граммах), содержащаяся в одном миллилитре раствора. Во времена Гей-Люссака
результаты анализа вычисляли именно с помощью титров. Однако титр как способ
выражения концентрации раствора оказался менее удобным, чем другие
характеристики (например, молярные концентрации), поэтому в современной
аналитике химии расчеты с применением титров ведут довольно редко. Напротив,
различные термины, произведенные от слова «титр», применяют очень широко.
В середине XIX века немецкий
химик К.Мор обобщил все созданные к тому времени титриметрические методики и
показал, что в основе любой методики лежит один и тот же принцип. К раствору
пробы, содержащей определяемый компонент Х, всегда прибавляют раствор с точно
известной концентрацией реагента R
(титрант). Этот процесс и называют титрованием. Проводя титрование, аналитик
следит за протеканием химической реакции между Х и добавляемым R. По достижении точки эквивалентности
(т.экв.), когда число молей эквивалентов введенного Rточно сравняется с числом молей эквивалентов находившегося в
пробе вещества Х, титрование прекращают и измеряют объем затраченного титранта.
Момент окончания титрования называют конечной точкой титрования (к.т.т.), ее,
как и т.экв., выражают в единицах объема, обычно в миллилитрах. В идеальном
случае Vк.т.т = Vт.экв., но на практике точное совпадение по разным причинам не
достигается, титрование заканчивают чуть раньше или, наоборот, чуть позже, чем
будет достигнута т.экв. Естественно, титрование следует проводить так, чтобы
различие междуVт.экв. и Vк.т.т. было бы как можно меньшим.
Поскольку массу или концентрацию Х рассчитывают по объему титранта,
затраченному на титрование пробы (по Vк.т.т.), в
прошлом титриметрию называли объемным анализом. Это название нередко
используют и сегодня, но термин титриметрический анализ более точен.
Дело в том, что операция постепенного прибавления реагента (титрование)
характерна для любой методики этого типа, а расход титранта можно оценивать не
только путем измерения объема, но и другими способами. Иногда
добавляемыйтитрант взвешивают (измерение массы на аналитических весах дает
меньшую относительную погрешность, чем измерение объема). Иногда измеряют
время, за которое будет введен титрант (при постоянной скорости ввода).
С конца XIX
века титриметрические
методики стали применять и в исследовательских, и в заводских, и в других
лабораториях. С помощью нового метода оказалось возможным определять
миллиграммовые и даже микрограммовые количества самых разных веществ. Широкому
использованию титриметрии способствовали простота метода, невысокая стоимость и
универсальность оборудования. Особенно широко титриметрию стали применять в
50-х годах XX
века, после создания
швейцарским аналитиком Г.Шварценбахом нового варианта этого метода
(комплексонометрии). Одновременно началось широкое применение инструментальных
методов контроля к.т.т. К концу 20 века значение титриметрии несколько
снизилось в связи с конкуренцией более чувствительных инструментальных методов,
но и сегодня титриметрия остается очень важным методом анализа. Она позволяет
быстро, легко и достаточно точно определять содержание большинства химических
элементов, отдельные органические и неорганические вещества, суммарное
содержание однотипных веществ, а также обобщенные показатели состава (жесткость
воды, жирность молока, кислотность нефтепродуктов).
.1.2Виды титриметрического анализа
Классифицировать титриметрические методики можно по нескольким
независимым признакам: а именно: 1) по типу реакции между Х и R, 2) по способу проведения титрования
и расчета результатов, 3) по способу контроля т.экв.
Классификация титриметрических методик по типу используемой
химической реакции
Таблица 1
|
Реакция
|
Метод
|
Реагент (титрант)
|
Вариант метода
|
Определяемые вещества
|
|
Протолиз
|
Метод нейтрализации
|
НCl, HClO4, HNO3
|
Ацидиметрия
|
Ocнования
|
|
|
KOH, NaOH и др.
|
Алкалиметрия
|
Кислоты
|
|
Комплексо-образование
|
Комплексометрия
|
ЭДТА
|
Комплексонометрия
|
Металлы и их соединения
|
|
|
NaF KCN
|
Фторидометрия, цианидометрия
|
Некоторые металлы, органические вещества
|
|
Окисление-восстановление
|
Редокс-метрия
|
KMnO4 К2Сr2O7
|
Перманганатометрия хроматометрия
|
Восстановители
|
|
|
KJ и Na2S2O3
|
Иодометрия
|
Восстановители, окислители, кислоты
|
|
|
Аскорбиновая кислота
|
Аскорбинометрия
|
Окислители
|
|
Осаждение
|
AgNO3
|
Аргентометрия
|
Галогениды
|
|
|
Hg2(NO3)2
|
Меркуриметрия
|
|
|
|
KSCN
|
Роданометрия
|
Некоторые металлы
|
|
|
Ba(NO3)2
|
Бариеметрия
|
Сульфаты
|
Классификация по способу титрования. Обычно выделяют три способа: прямое,
обратное и заместительное титрование.
Классификация по способу контроля т.экв. Известно несколько таких способов. Cамый простой - безындикаторное
титрование, самый распространенный - титрование с цветными индикаторами, а самые
точные и чувствительные - инструментальные варианты титриметрии.
1.1.3 Комплексонометрический метод
Комплексонометрия (хелатометрия) - метод титриметрического анализа,
основанный на реакциях взаимодействия определяемых ионов металла с
органическими реагентами (комплексонами) с образованием растворимых, бесцветных
прочных внутрикомплексных соединений.
Комплексоны - органические
соединения, производные аминополикарбоновых кислот, простейшей из которых
является иминодиуксусная кислота
Наиболее распространены следующие комплексоны:
Комплексон I, или
нитрилотриуксусная кислота
CH2COОН
HOOCH2C - N
CH2COOН
Комплексон II, или
этилендиаминтетрауксусная кислота (ЭДТА),
НOOCH2C
CH2COOНCH2 - CH2
- N
НOOCH2С CH2COOН,
Комплексон III называют также
ЭДТА (этилендиаминтетраацетат), трилон Б, который наиболее широко используется
в титриметрии. Комплексонов в настоящее время известно несколько десятков, но
они применяются редко.
НOOCH2C
CH2COONaCH2 - CH2 - N 2С CH2COOН,
Степень протекания реакции зависит от рН и константы
устойчивости комплексоната. Катионы, образующие устойчивые комплексонаты,
например,
Fe (III), могут быть
оттитрованы в кислых растворах. Ионы Са(II), Mg(II) и другие, образующие сравнительно
менее устойчивые комплексонаты, титруют при рН 9 и выше.
Точку эквивалентности в комплексонометрии можно определять различными способами:
1) алкалиметрическим титрованием ионов водорода, выделившиеся при
эквивалентном взаимодействии ионов металла с комплексоном;
) физико - химическими способами (спектрофотометрическим,
амперометрическим, потенциометрическим);
) индикаторным способом с помощью металл - индикаторов.
.1.4 Методы определения железа
№ 1. Определение содержания железа комплексонометрическим методом в
промывочных растворах.
Метод основан на образовании прочного растворимого в воде комплекса иона
железа (III) с динатриевой солью этилендиаминтетрауксусной кислоты (трилон Б). Титрование
трилоном проводят в сильнокислой среде (pH = 2) в присутствии сульфосалициловой
кислоты, применяемой в качестве индикатора после нагревания пробы до
температуры 60 - 70 °С. При наличии в растворе ионов железа (III) после
добавления сульфосалициловой кислоты раствор приобретает вишневый цвет
сульфосалицилата железа, интенсивность которого зависит от концентрации
железа.При титровании пробы трилоном Б сульфосалицилат железа разрушается с
образованием трилоната железа, имеющего лимонно-желтое окрашивание. Метод
позволяет определить содержание железа в растворе в диапазоне концентрации от
0,1 до 20 г/куб. дм. Определению содержания железа мешает медь, которая при pH
= 2 неколичественно образует комплекс с трилоном Б, а также ингибитор и другие
органические соединения, находящиеся в промывочном растворе. Поэтому перед
определением производят предварительную обработку пробы в целях разрушения
органических соединений и отделения меди.
Результат определения содержания железа с доверительной вероятностью Р =
0,9 находится по табл. 2
Таблица 2
|
Диапазон определяемых концентраций, г/куб.дм
|
Результат определения
|
|
Нижняя граница(наим.значение), г/куб.дм
|
Верхняя граница (наибольшее значение), г/куб.дм
|
|
0,1 - 20
|
С = -0,097+0,996*С
|
С = - 0,0026 + 1,028*С
|
С - значение концентрации железа, определенное данным
методом.
№2. Методика выполнения измерений
перманганатной окисляемости в пробах питьевых, природных и сточных вод
титриметрическим методом
Метод основан на окислении веществ, присутствующих в пробе воды,
известным количеством перманганата калия в сернокислой среде при кипячении в
течение 10 минут. Не вошедший в реакцию перманганат калия восстанавливают
щавелевой кислотой. Избыток щавелевой кислоты оттитровывают раствором
перманганата калия.
При определении перманганатной окисляемости после реакции должно
оставаться не менее 40 % введенного перманганата калия, так как степень
окисления зависит от его концентрации.
Для получения достоверных и сравнимых между собой результатов необходимо
строго придерживаться условий проведения анализа.
В результате аттестации установлено, что методика соответствует
предъявленым к ней метрологическим требованиям и обладает следующими основными
метрологическими характеристиками:
фотометрический железо окисляемость вода
Таблица 3
Диапазоны измерений, значения показательной точности,
правильности, повторяемости и воспроизводимости
|
Диапазон измерений, мг/дм3
|
Показатель повторяемости (относительное
среднеквадратическое отношение повторяемости), sr, %
|
Показатель воспроизводимости (относительное
среднеквадратическое отклонение воспроизводимости), sR, %
|
Показатель правильности (границы систематической
погрешности при вероятности P = 0,95), ±?с, %
|
Показатель точности (границы относительной погрешности при
вероятности P = 0,95), ±?, %
|
|
от 0,25 до 2,0 вкл.
|
7
|
10
|
4
|
20
|
|
св. 2 до 100 вкл.
|
3
|
5
|
2
|
10
|
Таблица 4
Диапазон измерений, значения предела воспроизводимости при
доверительной вероятности Р=0,95
|
Диапазон измерений, мг/дм3
|
Предел воспроизводимости(относительное значение
допускаемого расхождения между двумя результатами измерений, полученными в
разных лабораториях), R, %
|
|
от 0,25 до 2,0 вкл.
|
|
св. 2 до 100 вкл.
|
14
|
№ 3. Определение железа двухромовокислым калием
Сущность метода. Метод основан на восстановлении
трехвалентного железа раствором двухлористого олова с последующим титрованием
двухвалентного железа двухромовокислым калием с индикатором
дифиниламинминосульфонатом натрия.
Область применения. Метод используется при массовой
доле железа от 0,5 до 2,5%.
Таблица 5
Точность.
|
Массовая доля марганца, %
|
Погрешность результатов анализа Δ,
%
|
Допустимые расхождения, %
|
|
|
двух средних результатов анализа, выполненных в данных
условиях
|
двух параллельных определений
|
трех параллельных определений
|
результатов анализа стандартного и аттестационного значения
|
|
От 0,1 до 0,2 вкл.
|
0,02
|
0,03
|
0,02
|
0,03
|
0,01
|
|
Свыше 0,2 до 0,5 вкл.
|
0,04
|
0,04
|
0,04
|
0,04
|
0,02
|
|
Свыше 0,5 до 1,0 вкл.
|
0,05
|
0,06
|
0,05
|
0,06
|
0,03
|
|
Свыше 1,0 до 2,0 вкл.
|
0,07
|
0,09
|
0,07
|
0,09
|
0,05
|
|
Свыше 2,0 до 3,5 вкл.
|
0,11
|
0,14
|
0,11
|
0,11
|
0,07
|
№ 4.
Прямое определение железа с вариаминовым синим.
Анализируемый раствор должен содержать около 5 мг трехвалентного железа
на каждые 100 мл. Если раствор сильнокислый, к нему добавляют аммиак. Хорошо
проявила себя добавка гликола в количестве 0,2-0,5 г. Затем вност каплю
индикатора и проводят титрование. Исходный сине-фиолетовый раствор вблизи точки
эквивалентности становится серым и с последней каплей ЭДТА окраска переходит в
желтую.
№ 5. Определение железа и алюминия при совместном
присутствии.
Раздельное определение основано на титровании железа в кислой среде,
введение стандартного раствора ЭДТА, создании pH=4,2, оптимального для комплексообразования алюминия с ЭДТА,
и оттитровывании избытка ЭДТА стандартным раствором хлорида цинка в присутствии
ксиленолового оранжевого в качестве индикатора. Метод мало селективен.
.2 ФОТОМЕТРИЧЕСКИЙ МЕТОД
Метод анализа, основанный на переведении определяемого компонента в
поглощающее свет соединение с последующим определением количества этого
компонента путем измерения светопоглощения раствора полученного соединения,
называется фотометрическим.
Фотометрический метод анализа может применяться для большого диапазона
определяемых концентраций. Его используют как для определения основных
компонентов различных сложных технических объектов с содержанием до 20-30%
определяемого компонента, так и для определения микропримесей в этих объектах
при содержании их до 10-3 - 10-4%. Очень ценно использование фотометрических
методов для решения многих теоретических вопросов аналитической и физической
химии.
.2.1 Определение СО-фенантролином
ПНД Ф 14.1:2.2-95
Методика предназначена для выполнения измерений массовой концентрации
общего железа (0,05 - 2,0 мг/дм3) в неокрашенных и слабоокрашенных сточных и
природных водах фотометрическим методом.
ПРИНЦИП МЕТОДА
Фотометрический метод определения массовой концентрации общего железа
основан на взаимодействии ионов Fe(2+) с о-фенантролином с образованием
красного комплекса с максимумом светопоглощения при = 510 нм. Восстановление
Fe(3+) до Fe(2+) проводят гидроксиламином. Окраска комплекса не зависит от рН в
пределах от 3 до 9 ед. рН и устойчива длительное время.
Если массовая концентрация общего железа в анализируемой пробе превышает
верхнюю границу, то допускается разбавление пробы таким образом, чтобы
концентрация общего железа соответствовала регламентированному в табл. 6
диапазону.
Таблица 6
Значения показателей точности, повторяемости и
воспроизводимости методики
|
Диапазон измерений, мг/дм3
|
Показатель точности (границы относительной погрешности при
вероятности Р = 0,95), ±d, %
|
Показатель повторяемости (относительное
среднеквадратическое отклонение повторяемости) sr, %
|
Показатель воспроизводимости (относительное
среднеквадратическое отклонение воспроизводимости), sR, %
|
|
от 0,05 до 0,10 вкл.
|
25
|
7
|
10
|
|
св.0,10 до 1,00 вкл.
|
20
|
6
|
|
св. 1,0 до 2,0 вкл.
|
16
|
5
|
7
|
1.2.2 Определение в виде тиоционатных комплексов
Метод основан на образовании интенсивно окрашенных комплексов железа
(III) с тиоцианат-ионами. В зависимости от рН и концентрации реагента
образуются комплексные соединения с разным количеством лигандов: от [Fe(SCN)]2+
до [Fe(SCN)6]3-, причем их спектральные характеристики различны. Поэтому для
получения воспроизводимых и точных результатов следует обеспечить постоянство
концентрации (желательно большой) тиоцианат-ионов во всех растворах. При
соблюдении этого условия растворы тиоцианатных комплексов железа подчиняются
закону Бугера-Ламберта-Бера в широком диапазоне концентраций железа.
Выбрав светофильтр и фотометрируя анализируемый раствор, можно точно
определить концентрацию ионов железа по предварительно построенному
калибровочному графику.
1.2.3 Определение С1,10-фенантролином
РД 52.24.358-2006 устанавливает методику выполнения измерений (далее -
методика) массовой концентрации железа общего растворенного и железа валового в
пробах природных и очищенных сточных вод в диапазоне от 0,02 до 4,00 мг/дм3
фотометрическим методом.
При анализе проб воды с массовой концентрацией железа, превышающей 4,00 мг/дм3,
допускается выполнение измерений после соответствующего разбавления пробы
дистиллированной водой.
При соблюдении всех регламентируемых методикой условий проведения измерений
характеристики погрешности результата измерения с вероятностью 0,95 не должны
превышать значений, приведенных в таблице 7.
Таблица 7
Диапазон измерений, значения
характеристик погрешности и ее составляющих (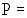 0,95)
0,95)
|
Диапазон измерений массовой концентрации железа общего 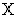 , мг/дм , мг/дм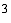
|
Показатель повторяемости (средне- квадратическое отклонение
повторяемости) 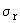 , мг/дм , мг/дм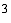
|
Показатель воспроизводимости (средне-квадратическое
отклонение воспроизво- димости) 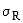 , мг/дм , мг/дм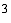
|
Показатель правильности (границы систематической
погрешности при вероятности 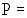 0,95) ± 0,95) ±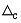 , мг/дм , мг/дм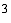
|
Показатель точности (границы погрешности при вероятности 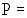 0,95) ± 0,95) ±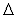 , мг/дм , мг/дм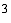
|
|
От 0,020 до 0,050 включ.
|
0,002
|
0,004
|
0,003
|
0,008
|
|
Св. 0,050 до 1,000 включ.
|
0,002+0,012·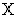
|
0,001+0,056·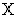
|
0,031·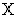
|
0,003+0,12·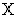
|
|
Св. 1,00 до 4,00 включ.
|
0,03
|
0,06+0,007·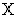
|
0,02+0,011·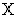
|
0,13+0,016·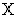
|
Метод измерения основан на восстановлении Fe(III) гидроксиламином до
Fe(II) и взаимодействии последнего с 1,10-фенантролином в кислой среде (рН
около 3) с образованием окрашенного в оранжево-красный цвет комплекса с
максимумом в спектре поглощения при 510 нм. Для разрушения комплексов железа с
органическими и неорганическими лигандами используют предварительную
термическую обработку или облучение пробы ультрафиолетом. При анализе пробы,
отфильтрованной через мембранный фильтр, определяют содержание растворенного
общего железа. Валовое содержание (сумму растворенных и взвешенных форм)
определяют, анализируя тщательно перемешанную нефильтрованную пробу.
1.2.4 Определение С сульфосалицилатом натрия
Сущность метода: основан на том, что сульфосалициловая кислота или её
натриевая соль образуют с солями железа окрашенные комплексные соединения,
причём в слабокислой среде сульфосалициловая кислота реагирует только с солями
железа(III) (красное окрашивание), а в
слабощелочной среде - с солями железа(III) и(II) (жёлтое окрашивание).
Таблица 8
Значения показателей точности, повторяемости и
воспроизводимости методики
|
Диапазон измерений, мг/дм3
|
Показатель точности (границы относительной погрешности при
вероятности Р = 0,95), ± d, %
|
Показатель повторяемости (относительное
среднеквадратическое отклонение повторяемости), sr, %
|
Показатель воспроизводимости (относительное
среднеквадратическое отклонение воспроизводимости), sR, %
|
|
от 0,1 до 1,0 вкл.
|
30
|
8
|
12
|
|
cв. 1,0 до 5,0 вкл.
|
15
|
4
|
6
|
|
cв. 5,0 до 10,0 вкл.
|
10
|
3
|
4
|
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ КОМПЛЕКСОНОМЕТРИЧЕСКОГО
ТИТРОВАНИЯ
Для проведения эксперимента был выбран метод № 1 -
Определение содержания железа комплексонометрическим методом в промывочных
растворах. Так как Методика обеспечивает получение достоверных характеристик
погрешности определения содержания железа при принятой доверительной
вероятности и способы их выражения. Также метод позволяет определить содержание
железа в растворе в диапазоне концентрации от 0,1 до 20 г/куб. дм.
Оборудование и приборы:Весы лабораторные аналитические,
колбы мерные,колбы конические вместимостью 250 куб.см, стакан мерный
вместимостью 50 куб.см,воронка конусообразная, бюретка для титрования
вместимостью 25 куб. см, пипетки.
РАСТВОРЫ И РЕАКТИВЫ:
1. Вода дистиллированная (ГОСТ 6709-72)
2. Трилон Б, 0,1 Н раствор (ТУ 6-09-2540-72)
. Соляная кислота, 1 Н (ГОСТ 3118-77)
. Азотная кислота концентрированная (ГОСТ
4204-77)
. Аммиак водный 10%-ный (ГОСТ 3760-79)
. Сульфосалициловая кислота 20%-ная. (ГОСТ
4478-78)
. Персульфат аммония (ГОСТ 3766-64)
МЕТОД ИЗМЕРЕНИЙ
Метод основан на образовании прочного растворимого в
воде комплекса иона железа (III) с динатриевой солью этилендиаминтетрауксусной
кислоты (трилон Б).
Титрование трилоном проводят в сильнокислой среде (pH
= 2) в присутствии сульфосалициловой кислоты, применяемой в качестве индикатора
после нагревания пробы до температуры 60 - 70 °С.
При наличии в растворе ионов железа (III) после
добавления сульфосалициловой кислоты раствор приобретает вишневый цвет
сульфосалицилата железа, интенсивность которого зависит от концентрации железа.
При титровании пробы трилоном Бсульфосалицилат железа
разрушается с образованием трилоната железа, имеющего лимонно-желтое
окрашивание.
Метод позволяет определить содержание железа в
растворе в диапазоне концентрации от 0,1 до 20 г/куб. дм.
ВЫПОЛНЕНИЕ АНАЛИЗА
Подготовка пробы
Если анализируемая проба мутная и в ней содержатся
взвешенные вещества, то пробу необходимо отфильтровать.
Предварительная обработка пробы
В коническую колбу вместимостью 250 куб. см отбирают
пипеткой 1 - 5 куб. см отфильтрованной пробы, добавляют 1 - 2 куб. см
концентрированной соляной кислоты (в зависимости от объема пробы), 0,1 - 0,2 г
персульфата аммония и 50 куб. см горячей дистиллированной воды. Пробу кипятят
15 - 20 мин. до объема 5 - 10 куб. см, не допуская упаривания ее досуха. Затем
осторожно добавляют горячую дистиллированную воду. Раствор должен иметь
чисто-желтый цвет; наличие нечеткого желтого окрашивания свидетельствует о
неполном разрушении органических веществ в пробе. В этом случае обработку
следует повторить, добавив вновь соляную кислоту и персульфат аммония (2 - 3
г).
При наличии в промывочном растворе органических
соединений их разрушают путем добавления в пробу концентрированной азотной
кислоты вместо персульфата аммония и соляной кислоты. На 1 - 5 куб. см пробы
добавляют 3 - 15 куб. см азотной кислоты. Упаривание пробы проводят как было
указано выше.
Выполнение определения при отсутствии
меди
Предварительно обработанную пробу доводят до кипения и
медленно при интенсивном перемешивании нейтрализуют аммиаком, разбавленным
водой в соотношении 1:1, до появления осадка гидроокиси железа (но не до
полного осаждения). Добавляют несколько капель соляной кислоты до полного
растворения гидроокиси железа (pH = 2), вводят 2 куб. см сульфосалицилата
натрия и, нагрев пробу до температуры 70 °С, титруют 0,1 Н раствором трилона Б
до перехода окраски из вишневой в лимонно-желтую.
Расчет содержания железа
Содержание железа (г/куб. дм) вычисляют в пересчете на
оксид железа (III) по формуле:
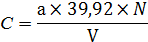
где:
a - объем трилона Б, пошедший на титрование, куб. см;
N - нормальность раствора трилона Б;
V - анализируемый объем пробы, куб. см;
39,92 - грамм-эквивалент Fe O в данной реакции.
a = 5,1 куб. см, N = 0,05, V = 1,0 куб. см:
С = (5,1х39,92 х 0,05)/1= 10,17 г/куб. дм;O3
Нижняя и верхняя границы содержания железа:
С 1 = -0,097 + 0,996 х 10,17 = 10,03;
С 2 = -0,026 + 1,028 х 10,17 = 10,43.
.2 ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ ФОТОМЕТРИЧЕСКОГО АНАЛИЗА
Для эксперимента был выбран метод определения железа сульфосалицилатом
натрия, так как имелись нужные реактивы.
Реактивы:
Сульфосалициловая кислота, 10%-ный раствор или сульфосалицилат натрия,
Аммиак, разбавленный раствор, стандартный раствор соли железа, соляная кислота,
разбавленная.
Ход определения:
В коническую колбу наливают 10 мл анализируемого раствора, затем
приливают 5 мл раствора сульфосалициловой кислоты или сульфосалицилата натрия,
5 мл раствора аммиака и перемешивают.
Измеряют оптическую плотность полученного раствора. Содержание железа
находят по калибровочной кривой.
Таблица 9
Полученные экспериментальные данные.
|
Концентрация железа (мкг/100мл)
|
Оптическая плотность
|
Концентрация анализируемого раствора
|
|
0
|
0,153
|
|
|
0,1
|
0,186
|
|
|
0,2
|
0,211
|
|
|
0,25
|
|
0,224
|
|
0,3
|
0,24
|
|
|
0,4
|
0,273
|
|
|
0,5
|
0,301
|
|
График 1
Зависимость оптической плотности от концентрации раствора
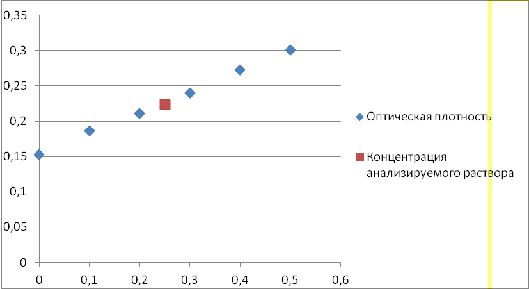
Таблица 10
Расчёт коэффициента корреляции
|
Коэффициент корреляции
|
|
-0,25
|
-0,074
|
0,01858333
|
0,06
|
0,006
|
|
-0,15
|
-0,041
|
0,0062
|
0,02
|
0,002
|
|
-0,05
|
-0,016
|
0,00081667
|
0,00
|
0,000
|
|
0,05
|
0,013
|
0,00
|
0,000
|
|
0,15
|
0,046
|
0,00685
|
0,02
|
0,002
|
|
0,25
|
0,074
|
0,01841667
|
0,06
|
0,005
|
|
Сумма
|
|
|
0,0515
|
0,18
|
0,015
|
|
X-Xср
|
Y-Yср
|
(X-Xср)*(Y-Yср)
|
(X-Xср)^2
|
(Y-Yср)^2
|
|
|
r
|
0,99941924
|
|
|
ВЫВОДЫ
В результате проделанной работы была достигнута цель работы - исследовать
метод комплексонометрического титрования, фотометрический метод и их
применение. Также были Изучены методики комплексонометрического,
фотометрического исследования железа. Рассмотрены основные индикаторы
комплексонометрии. Также ознакомились с правилами изготовления и хранения
рабочих растворов.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1.
Харитонов Ю.Я. Аналитическая химия. Аналитика. В 2-х кн.- М.: Высш.шк., 2001.
Кн.1.
. Золотов
Ю.А. Основы аналитической химии. В 2-х т. - М.: Высш.шк.,1999. Т.2.
. Васильев
В.П. Аналитическая химия. В 2-х ч. - М.: Высш.шк., 1989. Ч.1.
. Пилипенко
А.Т., Пятницкий И.В. Аналитическая химия. В 2-х кн. - М.: Химия, 1990. Кн.1.
. Пономарев
В.Д. Аналитическая химия. В 2-х ч.- М.:Высш.шк.,1982. Ч.2.
. Алексеев
В.Н. Количественный анализ. - М.: Химия, 1972.
. Крешков
А.П. Основы аналитической химии. В 3-х т. - М.: Химия, 1976. Т.2.
. Фритц
Дж., Шенк Г. Количественный анализ. - М.: Мир, 1978.
. Умланд
Ф., Янсен А., Тириг Д., Вюнш Г. Комплексные соединения в аналитической химии. -
М.: Мир, 1975.
. Лурье
Ю.Ю. Справочник по аналитической химии. - М.: Химия, 1989
. Шварценбах
Г, Флашка Г., Комплексонометрическое титрование, пер. с нем., М., 1970; Пршибил
Р., Аналитические применения этилендиаминтетрауксусной кислоты и родственных
соединений, пер. с англ., М., 1975.
12.