Сорбция фосфатидилхолина на катионообменниках
МИНОБРНАУКИ
РОССИИ
ФЕДЕРАЛЬНОЕ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ВОРОНЕЖСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Химический
факультет
Кафедра
аналитической химии
Бакалаврская
работа
Сорбция
фосфатидилхолина на катионообменниках
Направление
020100 Химия
Профиль
Аналитическая химия
Допущено к защите в ГЭК __.__.2015
Зав. кафедрой д.х.н., проф. В.Ф. Селеменев
Обучающийся В.Д. Галлямова
Руководители д.х.н., проф. В.Ф. Селеменев
асс. А.А. Назарова
Воронеж 2015
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ, СИМВОЛОВ И
ПРИНЯТЫХ В РАБОТЕ СОКРАЩЕНИЙ
ФЛ - фосфолипиды;
R - насыщенные
углеводородные остатки жирных кислот;
R’ - ненасыщенные
углеводородные остатки жирных кислот;
ФК - фосфатидная кислота;
ФХ - фосфатидилхолин;
ФЭА - фосфатидилэтаноламин;
ФС - фосфатидилсерин;
ФИ - фосфатидилинозитол;
ЦДФ - цитидин дифосфат
рН - отрицательный десятичный логарифм
равновесной концентрации ионов водорода;
рK
- показатель константы диссоциации;
ККМ - критическая концентрация мицеллообразования;
Ткип - температура кипения;
ТСХ - тонкослойная хроматография;
Снф - концентрация неподвижной фазы;
Спф - концентрация подвижной фазы;
D - коэффициент
разделения;;
Vнф - объем
неподвижной фазы;
Vпф - объем
подвижной фазы;
Rf -
относительная подвижность вещества;
Zf -
расстояние, пройденное веществом от точки нанесения пробы до центра зоны;
Zx -
расстояние, пройденное элюентом от стартовой линии до линии фронта;
L - коэффициент
разделения;
H - высота,
эквивалентная теоретической тарелке;
N - число
теоретических тарелок;
σх - стандартное
отклонение;

 - количество исходного вещества;
- количество исходного вещества;

 - количество сорбируемого
вещества;- разность между количеством сорбируемого и исходного вещества;
- количество сорбируемого
вещества;- разность между количеством сорбируемого и исходного вещества;
А - обменная емкость сорбента
(адсорбция);- коэффициент распределения вещества между фазами раствора и
сорбента.
ВВЕДЕНИЕ
Фосфолипиды (ФЛ) представляют собой
группу биологически активных соединений, встречающихся в организмах животного,
растительного и бактериального происхождения. Они участвуют в важнейших
биологических процессах: передаче нервного импульса, активном переносе через
мембраны, транспорте жиров, жирных кислот и холестерина, синтезе белка и других
ферментативных процессах [1]. В высокой концентрации фосфолипиды обнаружены в
различных органах животных и человека: головном и спинном мозге, крови, печени,
сердце, почках и т.д., особенно велико содержание ФЛ в нервной системе
(20-25%). Фосфолипиды входят в состав всех структурных элементов клетки, в
первую очередь клеточных мембран, и мембран субклеточных частиц; в виде
липопротеидов они составляют не менее 30% общей сухой массы мембраны.
К одним из самых перспективных способов
выделения биологически активных веществ стоит отнести сорбционный метод,
который позволяет не только выделять фосфолипидную фракцию, но и получать
отдельные фосфолипиды из фосфолипидного концентрата с высокой степенью чистоты.
Поэтому актуальным является разработка сорбционного способа выделения
фосфолипидов из растительных объектов. В проведенных ранее работах была изучена
сорбция фосфатидилхолина (ФХ) на макропористых неионогенных сорбентах, а также
на анионообменниках различных типов. Фосфолипиды в зависимости от рН среды
могут находиться в различных ионных формах, поэтому является актуальным
изучение их сорбции и на катионообменниках. В предыдущих работах было показано,
что в процесс сорбции ФХ большой вклад вносит взаимодействие сорбата с матрицей
ионообменной смолы. Поэтому для исследования нами были взяты гелевый
сильнокислотный «КУ-2-8», представляющий собой сверхсшитый полимер на основе
стирола и дивинилбензола, имеющий ионогенные сульфогруппы, а также гелевый
слабокислотный «КБ-4» - сверхсшитый полимер на основе метакриловой кислоты и
дивинилбензола с ионогенными карбоксильными группами.
Таким образом, целью настоящей
работы явилось изучение процессов сорбции фосфатидилхолина на сильно- и
слабокислотных катионообменных сорбентах «КУ-2-8» и «КБ-4» в зависимости от pH среды.
Для достижения поставленной цели
необходимо было решить следующие задачи:
1. Разработать методику количественного
определения фосфатидилхолина методом тонкослойной хроматографии (ТСХ).
. Получить градуировочные графики ФХ при pH
7 и pH 2 методом
ТСХ в области концентраций 0,01-0,50 мг/мл.
. Получить изотермы сорбции ФХ на
ионообменных сорбентах «КУ-2-8» и «КБ-4» при варьировании pH
среды, провести математическую обработку полученных данных.
. Выяснить механизм образования межмолекулярных
связей между сорбентом и ФХ методом ИК-спектроскопии.
фосфолипид
фосфатидилхолин хроматография
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
.1 Общая характеристика фосфолипидов
.1.1 Строение и свойства фосфолипидов
Фосфолипиды представляют собой сложные эфиры
многоатомных спиртов с высшими жирными кислотами, содержащие остатки фосфорной
кислоты и связанные с нею добавочные группировки (азотистые основания,
аминокислоты, глицерин, инозит и др.). В качестве высших жирных кислот в
молекулах ФЛ содержатся пальмитиновая, стеариновая, линолевая, линоленовая и
арахидоновая кислоты, а также лигноцериновая, нервоновая и др.
В зависимости от типа фосфолипида в построении
его молекулы принимают участие один или два остатка высшей жирной кислоты.
Фосфорная же кислота входит, как правило, в состав фосфолипидов в количестве
одной молекулы.
В зависимости от того, какой многоатомный спирт
входит в состав, можно выделить три основные группы фосфолипидов:
глицерофосфолипиды, инозитфосфолипиды и сфингофосфолипиды [2]. Глицерофосфолипиды
часто называют фосфатидами, так как их можно рассматривать как производные
фосфатидной кислоты (рис 1.1), а инозитфосфолипиды - фосфоинозитидами.
Глицерофосфолипиды, или фосфатиды, - сложные
эфиры глицерина, высших жирных кислот, фосфорной кислоты и азотистого
основания. В зависимости от характера азотистого основания среди фосфатидов
различают фосфатидилхолин (лецитины), фосфатидилколамин (кефалины),
фосфатидилсерин и фосфатидилтреонин. Из них лецитины наиболее распространены в
природе (рис. 1.2). Наличие в лецитинах холина в качестве азотистого основания
впервые было установлено К. С. Дьяконовым (1867).

Рис. 1.1. Фосфатидная кислота - родоначальник
глицерофосфатидов

Рис. 1.2. Фосфатидилхолин (биполярная форма)
Некоторые фосфатиды, открытые сравнительно
недавно, вместо азотистого основания содержат глицерин и его производные.
Инозитфосфолипиды (фосфоинозитиды) представляют
группу фосфолипидов, строение которой выяснено в последние 25 - 30 лет
благодаря интенсивным работам по их химическому синтезу, осуществленным
сотрудниками, принадлежащими к школам Н. А. Преображенского и л. Д.
Бергельсона. Простейший монофосфоинозитид представлен на рис 1.3.

Как можно видеть, он похож на
фосфатид, у которого азотистое основание заменено остатком инозита.
Сфингофосфолипиды в отличие от
рассмотренных выше фосфатидов и инозитфосфолипидов содержат остаток высшей
жирной кислоты, соединенный с двухатомным аминоспиртом (сфингозином) пептидной
связью (рис 1.4).

Рис. 1.4. Сфинголипид
Остальные компоненты
сфингофосфолипидов - фосфорная кислота и холин - присоединены так же, как у
фосфатидов. Именно в сфинголипидах в значительных количествах обнаружены
лигноцериновая и нервоновая кислоты, менее характерные для остальных групп
фосфолипидов. Следует отметить, что представители этой группы фосфолипидов
более характерны для животного, чем для растительного мира.
Несмотря на различие структуры
отдельных классов фосфолипидов, все они построены по схожему принципу. В
структуре ФЛ выделяют две части, различные по своей растворимости в воде:
полярной части, обладающей высоким сродством к воде, т.е. гидрофильной
составляющей, и радикалов, образуемых неполярными углеводородными цепями жирных
кислот. Эта часть молекулы обладает низким сродством к воде, т.е. гидрофобна
(рис.1.1). Именно это сочетание обуславливает основное свойство фосфолипидов -
амфифильность, т.е. сродство к полярной (водной) и к гидрофобной (жировой)
средам.
.1.2 Физико-химические свойства ФЛ
Физико-химические и биологические свойства ФЛ
зависят от природы заместителя, длины углеводородной цепи входящих в его
молекулу жирных кислот, от положения и числа двойных связей в них [3].
Липиды хорошо растворимы в органических
растворителях, таких, как метанол, ацетон, хлороформ и бензол. В то же время
эти вещества нерастворимы или мало растворимы в воде. Слабая растворимость
связана с недостаточным содержанием в молекулах липидов атомов с поляризующейся
электронной оболочкой, таких, как О, N, S или P [4]. Надо отметить, что
отдельные группы ФЛ различаются растворимостью в растворителях. Например, в
метиловом и этиловом спирте ФХ и ФК хорошо растворимы, ФЭА мало растворимы, ФС
почти не растворяются; ФХ плохо растворяются в ацетоне, а ФК отличаются хорошей
растворимостью в этом растворителе [5].
Наличие в составе ФЛ групп, способных к
диссоциации, приводит к тому, что в зависимости от рН среды эти вещества будут
находиться в различных ионных формах [1]. В табл. 1.1 представлен пример
константы протолиза функциональных групп фосфатидилхолина.
Таблица 1.1
Ионные формы ФХ при различных значениях рН (Ki
- константы протолиза функциональных групп ФЛ) [6]
Фосфатидилхолин (ФХ)  1,5 (≡Р
- OH )
1,5 (≡Р
- OH )
На рис. 1.5 представлена распределительная
диаграмма ФХ в зависимости от рН среды.

Рис. 1.5. Характеристика ионных форм
ФХ в водных растворах при изменении величины рН: 1 - однозарядный катион, 2 -
цвиттер-ион, 3 - однозарядный анион
Из рис. 1.5 следует, что ФХ
находится в форме цвиттер-иона в широком интервале pH (включая также и
физиологические значения pH), что обуславливает его поведение в биологических
мембранах [7].
Общие свойства фосфолипидов в
значительной степени обусловлены природой жирных кислот, входящих в их состав:
фосфолипиды, которые содержат в основном ненасыщенные жирные кислоты, имеют
мазеобразную консистенцию, в то время как фосфолипиды, содержащие ненасыщенные
жирные кислоты - твердую консистенцию. Фосфолипиды склонны к
порошкообразованию, что объясняется значительным содержанием в них углеводов.
К наиболее важным свойствам
фосфолипидов, объясняющим их поведение на отдельных этапах переработки
масличных семян и растительных масел, а также характеризующих их
потребительские свойства, как самостоятельного продукта (фосфатидный концентрат),
относится:
1) поверхностно-активные
свойства;
2) полярность,
поляризуемость, дипольные моменты;
3) электрическая
проводимость фосфолипидов в неполярных растворителях;
4) образование
ассоциатов и мицелл фосфолипидов в неполярных растворителях.
Фосфолипиды растительных масел способны изменить
фазовые и энергетические взаимодействия на поверхности раздела полярной и
неполярной фаз. Наличие такой активности для фосфолипидов обусловлено их
химическим строением, полярностью и поляризуемостью, а также внешними
факторами: температурой, характером среды (растворителя), концентрацией и типом
фаз на границе раздела.
Для неинногенных ПАВ, к которым можно отнести
фосфолипиды растительных масел, в неполярных и малополярных растворителях
характерны следующие типы межмолекулярных взаимодействий [1,6,8]:
слабое химическое, обусловленное образованием
водородных связей и комплексов (комплексоподобное взаимодействие) [9];
ориентационное взаимодействие между молекулами с
постоянным жестким диполем;
дисперсионное взаимодействие - мгновенные
диполи, образованные благодаря определенному положению электронов в молекуле.
Последние три типа характеризуются в основном
ван-дер-ваальсовыми силами.
Реакционная способность молекул фосфолипидов,
связанная с их химическим строением и составом, обуславливает взаимодействие
фосфолипидов с белками, углеводами, неомыляемыми липидами, ионами металлов,
кислородом, щелочей, кислот и другими веществами, а также возможность
протекания побочных реакций.
Фосфолипиды связываются с белками электростатическими
силами: фосфатидилхолины и фосфатидилэтаноламины взаимодействуют с белком
своими фосфатными группами и четвертичными атомами азота, проявляя сродство к
аминокислотам, содержащим группы -ОН; =NH,
-NH2, =S.
В образовании комплексов фосфолипиды - белки
существенное значение имеют силы ван-дер-вальса; несмотря на то, что они
обладают малой энергией, с помощью этих сил возможно активное взаимодействие
благодаря большому количеству одновременных взаимодействий (кооперативности).
В фосфолипидах растительных масел присутствует
значительное количество ионов металлов (кальций, магний, калий, натрий, железо
и другие), так как отдельные группы фосфолипидов растительных масел способны
взаимодействовать с ионами металлов.
В результате взаимодействия фосфолипидов с
углеводами образуется меланоидиновые соединения - продукты сахароаминного
взаимодействия аминоалкоголей фосфолипидов с углеводами, так называемые
меланофосфотиды.
.1.3 Мицеллообразование фосфолипидов
Как уже говорилось ранее, наличие у молекул ФЛ
двух частей - сильно полярной «головки» и неполярных жирнокислотных цепей,
препятствует их растворимости в воде и других полярных растворителях, однако
это обуславливает их способность образовывать мембраны. Локализация
углеводородных цепей ЖК в упорядоченной структуре воды энергетически невыгодна,
и именно поэтому ФЛ стремятся к образованию везикулярных или мицеллярных
дисперсий (рис. 1.6).

Рис. 1.6. Формы ориентации молекул ФЛ в воде.
Образование мицелл, липосом, ламеллярных структур
На электронных микрофотографиях таких дисперсий
обнаружены слоистые структуры, замыкающиеся друг с другом с образованием
мембранных оболочек, которые оказались внешне чрезвычайно похожими на мембраны
клеток. Вскоре было показано, что если в контактирующем с ФЛ водном растворе
присутствуют ионы, то они включаются в образующуюся внутреннюю водную область и
удерживаются там длительное время. Это происходит за счет того, что создаваемые
фосфолипидами слоистые мембранные оболочки захватывают при замыкании часть
водного раствора и обладают свойствами полупроницаемого барьера, легко
пропускающего воду, но ограничивающего диффузию растворенных в ней других
веществ [10, 11]. ФЛ, являющиеся основными компонентами и строительными блоками
биомембран, могут в водном окружении спонтанно образовывать замкнутые
мембранные структуры. Это открытие сыграло большую роль в мембранологии.
Энергетически выгодное расположение для таких амфифильных соединений как ФЛ -
мономолекулярный слой на поверхности раздела между водой и гидрофобной средой;
в таком случае полярные "головки" ориентированы в сторону воды, а
жирнокислотные цепи погружены в неполярную среду (рис. 1.6). Поэтому в водной
среде молекулы ФЛ ассоциируются друг с другом, образуя микроскопические ассоциаты
или бислои, в которых расположенные внутри гидрофобные цепи
("хвосты") защищены от воды полярными головками. Стремление
максимально ограничить контакт неполярных цепей липида с водой приводит к тому,
что бислой при его достаточной протяженности, может замыкаться сам на себя,
формируя сферические полые оболочечные структуры, получившие название везикулы.
Обычно названия "липосомы" и
"липидные везикулы" используют как синонимы, но необходимо отметить,
что липосомами впервые были названы частицы, образующиеся при механическом
диспергировании взвеси ФЛ в воде. В этом случае образуются большого размера (до
50 мкм), состоящие из нескольких десятков липидных бислоев, разделенных водными
промежутками (мультиламеллярные) везикулы (липосомы), имеющие недостаточно
развитую поверхность [12, 13].
Применение специальных технологий (ультразвук,
детергенты и др.) позволяет получить моноламеллярные липосомы с большей
поверхностью, диаметром 100 - 200 нм, которые сохраняют некоторое количество
захваченной при замыкании водной фазы, окруженной бислойной фосфолипидной
оболочкой (рис. 1.6). Наиболее мелкие фосфолипидные частицы (менее 100 нм) с
высокоразвитой поверхностью, с полярными группами снаружи и жирнокислотными
цепями внутри называют мицеллами. В отличие от липосом, они не имеют
внутреннего водного объема.
Формы самоорганизации ФЛ в воде определяются
зарядом их полярных головок и соотношением объемов, занимаемых головками и
неполярными жирнокислотными цепями. Когда эти объемы примерно одинаковы, т. е.
когда молекулы липида имеют цилиндрические очертания, преобладает тенденция к
образованию бислоя. Если же объем полярной головки больше объема цепей, то
молекула по форме приближается к обращенному конусу, и в водном окружении она
будет находиться в мицеллярной фазе [14].
Липидная мицелла может быть окружена
предпочтительно ионами водорода или гидроксильными группами окружающей ее воды.
Поэтому по своим физическим свойствам вода вблизи поверхности мицеллы заметно
отличается от остальной.
.1.4 Функциональная роль фосфолипидов в клетке
Фосфолипиды являются неотъемлемым
компонентом всех клеточных мембран. Между плазмой и
<#"877223.files/image010.gif">
Отношение количеств вещества в двух фазах
определяет величину фактора емкости, в последнее время называемого фактором
удерживания K. Величины D и K
связаны между собой прямо пропорциональной зависимостью:

где Vнф и Vпф - объемы неподвижной и подвижной
фаз соответственно.
Вид изотермы сорбции влияет на форму
хроматографической зоны. Различают три основных формы изотермы: линейную,
выпуклую и вогнутую (рис. 1.7). В области небольших концентраций большинство
изотерм имеет линейный характер, при повышении концентраций линейная
зависимость нарушается, и они становятся вогнутыми или выпуклыми.
В практической работе нелинейность изотерм
является нежелательным фактором, поскольку приводит к изменению формы зон и
влияет на эффективность хроматографического процесса.
В соответствии с коэффициентами распределения
разделяемые компоненты переносятся подвижной фазой вдоль слоя сорбента, образуя
отдельные зоны. Положение каждой зоны характеризуется величиной Rf,
физический смысл которой определяется отношением скоростей движения зоны
определяемого вещества и элюента.

Рис. 1.7. Связь между изотермой сорбции и формой
пятна в ТСХ
Поскольку на практике измерить эти величины
трудно, величину Rf, называемую
относительной подвижностью, определяют как отношение расстояния, пройденного
веществом от точки нанесения пробы до центра зоны (Zx),
к расстоянию, пройденному элюентом от стартовой линии до линии фронта (Zf):

Величина Rf
является индивидуальной характеристикой соединения, хроматографируемого в
данном растворителе, и изменяется от 0 до 1. Оптимальным для практической ТСХ
является интервал измерения Rf
от 0,2 до 0,8. При Rf = 0
вещество остается на линии старта, при Rf
= 1 вещество не задерживается неподвижной фазой и движется с фронтом
растворителя.
В идеальном случае Rf
не зависит от концентрации раствора и присутствия других компонентов.
Определяющую роль играет соотношение растворителей.
Из определения подвижности компонента следует
другое выражение для измерения фактора удерживания. В данном случае величина K
равна:

где величина (1- Rf)
пропорциональна количеству растворенного вещества в неподвижной фазе, а
величина Rf пропорциональна
количеству растворенного вещества в подвижной фазе.
Селективность разделения двух веществ в тонком
слое сорбента характеризует величина L, называемая коэффициентом разделения:

Чем больше величина L, тем лучше будет
разделение, так как зоны компонентов будут располагаться друг от друга на
большем расстоянии.
Эффективность процесса хроматографирования
характеризует высота, эквивалентная теоретической тарелке (Н) и число теоретических
тарелок (N).
Высоту, эквивалентную теоретической тарелке
(ВЭТТ), можно рассчитать как отношение дисперсии (размывания) пятна к длине
пути, пройденного пятном:

Число теоретических тарелок рассчитывается как
отношение длины пути, пройденного растворителем от линии старта до линии
фронта, к ВЭТТ:

.2.3
Краткая характеристика метода ИК-спектроскопии
Инфракрасный спектр химического соединения
является одной из его наиболее важных характеристик. Инфракрасная область
спектра занимает диапазон длин волн от границы видимой до микроволновой
области. Коротковолновый и длинноволновый участки спектра называют
соответственно ближней и далекой инфракрасными областями. Для характеристики
ИК-излучения обычно используют волновые числа, т.е. величины, обратные длинам
волн, измеренным в сантиметрах. ИК-области соответствует диапазон 4000 - 400
см-1 [28].
Поглощение веществом инфракрасного излучения
вызывает переход между колебательными уровнями основного электронного состояния
[29]. Существует два основных вида молекулярных колебаний - валентные и
деформационные. Частота поглощаемого излучения равна характеристической частоте
валентных и деформационных колебаний соответствующих связей. Таким образом, при
облучении молекулы ИК-светом будут поглощаться только кванты, частоты которых
соответствуют частотам валентных или деформационных колебаний связей этой
молекулы [29]:
валентные колебания: ритмичные колебания вдоль
оси связи, при которых расстояние между колеблющимися атомами увеличивается или
уменьшается, но сами атомы остаются на оси валентной связи (связь растягивается
или сокращается);
деформационные колебания: атомы отклоняются от
оси валентной связи с изменением валентных углов. При этом связи меняют
положение относительно друг друга в одной (плоскостные колебания) или разных
(инсплоскостные колебания) плоскостях.
Информацию о валентных и деформационных
колебаниях атомов в молекуле дают спектры поглощения в средней ИК-области
электромагнитного спектра.
На основании табличных характеристических частот
по полученному ИК-спектру органического соединения определяют различные
группировки атомов в молекуле и тем самым устанавливают его строение. Для этого
ИК-спектр целесообразно условно разделить на четыре области и проанализировать
каждую из них, начиная с высокочастотной области:
) область 3700-2900 см-1 - проявляются
валентные колебания связей атома водорода с атомами кислорода, азота, серы и
углерода;
) область 2500-1900 см-1 - обычно
называется областью кратных связей, потому что здесь находятся полосы
поглощения таких характеристических групп, как С=С, C=N;
) область 1900-1300 см-1 - проявляются
валентные колебания связей С=С алкенов, С-С ароматического кольца, С-О, О=N и
других групп, т. е. это область двойных связей;
) область менее 1300 см-1 - особенно
богата полосами, большая часть которых трудно поддается расшифровке, так как
обусловлена колебаниями углеродного скелета всей молекулы. Спектр поглощения в
этой области является индивидуальной характеристикой соединения, поэтому ее
называют областью «отпечатков пальцев» и при установлении идентичности
соединений обращают на нее особое внимание.
Достаточно интенсивные полосы поглощения,
проявляющиеся в области, характерной для определенной группы, и пригодные для
идентификации этой группы, называются характеристическими полосами поглощения
или характеристическими частотами. За последние годы собрано огромное
количество данных, относящихся к этим полосам, и многие полосы в области
«отпечатков пальцев» теперь также используются для характеристики различных
групп.
ИК-спектры фосфолипидов снимают в виде пленки
(предварительно растворив образец в вазелиновом масле) на пластинке из
материала, прозрачного в исследуемой области (например, KBr, NaCl, KCl,
кремний). Необходимо помнить, что вазелиновое масло сильно поглощает при
частоте 3000-2800 см-1 , 1460 и 1380 см-1 [5]. ИК-спектры фосфолипидов могут
быть сняты и в виде растворов. Для этого готовят 1-2%-ный раствор исследуемого
образца фосфолипида (10-20 мг/мл) в четырыххлористом углероде и помещают в
сдвоенные кюветы из NaCl толщиной 0,2 мм [5].
Спектры чистых фосфолипидов могут быть получены
при снятии спектра образца, нанесенного в виде тонкой пленки на пластины
монокристаллического кремния.
ГЛАВА 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Построение градуировочного графика для
определения ФХ методом тонкослойной хроматографии
Для количественного определения ФХ методом ТСХ
были выбраны следующие условия:
. Система элюентов: хлороформ - метанол -
уксусная кислота - вода (20: 12: 3,2: 1,6)
. Пластина: Сорбфил
. Объем наносимой пробы: 10 мкл
. Интервал концентраций (0,01-0,50)
мг/мл.
. Проявитель: 5%-ный раствор
фосфорномолибденовой кислоты
. Программа количественной обработки
данных: Sorbfil Videodensitometer

(а) (б)
Рис. 2.1. Хроматограмма стандартных растворов ФХ
в нейтральной (а) и кислой (б) средах в интервале концентраций 0,01-0,50 мг/мл

Рис. 2.2. Градуировочный график для определения
концентрации растворов ФХ методом ТСХ в нейтральной среде в интервале
концентраций 0,01-0,50 мг/мл

Рис. 2.3. Градуировочный график для определения
концентрации растворов ФХ методом ТСХ в кислой среде в интервале концентраций
0,01-0,50 мг/мл
2.2
Изучение процессов сорбции ФХ на ионообменных сорбентах
2.2.1 Физико-химические характеристики изучаемых
сорбентов
В таблице 2.1 представлены некоторые
физико-химические характеристики выбранных нами сорбентов.
Таблица 2.1.
Физико-химические характеристики полимерных
сорбентов
|
Сорбент
|
КУ-2-8
|
КБ-4
|
|
Тип
сорбента
|
Катионообменный
|
|
Размер
зерна, мм
|
0,315-1,25
|
0,315-1,6
|
|
Объемная
доля рабочей фракции, %, не менее
|
95
|
90
|
|
Эффективный
размер зерен, мм, не более
|
0,35-0,55
|
0,5
|
|
Удельный
объем в Н-форме, см /г, не более:
|
2,8
|
2,5
|
|
Полная
обменная емкость (по H+), моль·экв/г
|
5,8
|
4,9
|
|
Полная
обменная емкость (в пересчете на ФХ), мг/г
|
4,4
|
3,7
|
|
Структурное
звено
|
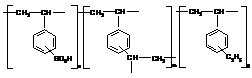 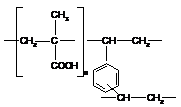
|
|
.2.2 Подготовка сорбента к работе
Провели кондиционирование сорбента. Для этого
навеску сорбента 30 г залили на 4 часа насыщенным раствором хлорида натрия,
затем промыли дистиллированной водой методом декантации. После этого
последовательно промыли сорбент соляной кислотой с концентрациями: 0,2; 1,0;
2,0; 3,0 М до отсутствия следов железа, после чего промыли дистиллированной
водой до нейтральной среды. Затем сорбент промывали последовательно гидроксидом
натрия с концентрациями: 0,10; 0,15; 0,20; 0,25 М, после чего промыли методом
декантации дистиллированной водой до нейтральной среды. На конечном этапе
заливали сорбент 0,5 М раствором HCl
до тех пор, пока концентрация соляной кислоты в колбе с сорбентом не стала
равна концентрации исходного раствора соляной кислоты (0,5 М). Переведенный в H+
- форму сорбент в дальнейшем промывали дистиллированной водой и сушили на
воздухе в течение трех суток.
.2.3 Определение обменной емкости изучаемых
сорбентов
Навеску образцов 1,0000 г, переведенных в H+
- форму, заливали 100,0 мл 0,1 М NaOH и выдерживали в течение 4 часов. После
этого отбирали 10,0 мл рабочего раствора и титровали 0,1 М раствором HCl
(индикатор - метилоранж). Измерение проводили не менее 6 раз. По полученным
данным рассчитали ПОЕ. Таким образом, ПОЕ (КУ-2-8) = 5,8 ммоль·экв/г, ПОЕ
(КБ-4) = 4,9 ммоль·экв/г.
.2.4 Построение изотермы сорбции
Построение изотермы сорбции проводили методом
переменных концентраций. Для этого брали навески по 0,2 г подготовленных к
работе сорбентов и заливали 10 мл спиртового раствора ФХ с концентрациями:
0,01; 0,05; 0,10; 0,20; 0,30; 0,40; 0,50 мг/мл. Полученные смеси выдерживали в
течение 72 ч до полного установления равновесия. Далее сорбент отфильтровывали
и проводили количественный анализ методом ТСХ (для растворов с концентрацией
0,01 - 0,50 мг/мл). По градуировочным графикам определяли концентрации ФХ.
.3
Исследование ФХ с помощью ИК-спектроскопии
Для подтверждения или опровергания гипотезы
образования межмолекулярных связей, обуславливающих сорбцию, широко применяется
метод ИК - спектроскопии. В данной работе мы применяли две различные методики
получения ИК - спектров.
Спиртовые растворы ФХ наносили тонкой пленкой на
пластину из монокристаллического кремния. После высушивания пластинки помещали
в спектрометр фирмы Bruker «Vertex-70» и регистрировали спектр. Полученные
спектры были обработаны с помощью программы «Grams 4/32».
снятие ИК спектров сорбентов
Методика изготовления таблетки.
Образцы изучаемых сорбентов предварительно
высушивались при температуре 40 ºС
в течение трех суток, после этого сорбенты тщательно растирались в агатовой
ступке до получения однородного тонкого порошка или пудры, и затем
изготавливались таблетки с предварительно высушенным при 160 °С и измельченным
порошком оптически чистого монокристаллического KBr в соотношении 0,1 мг
образца - 100 мг бромида калия.
ИК-спектры фосфатидилхолина получали на
спектрометре с Фурье-преобразованием «Vertex-70», с последующей обработкой
программой GRAMS 4/32.
ГЛАВА 3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
.1 Построение градуировочного графика
Построенные нами градуировочные графики для
определения концентрации ФХ в растворах после сорбции линейны, отличаются
хорошей воспроизводимостью и точностью. Данные для построения графиков
воспроизводились нами не менее 5 раз. В случае работы с маленькими
концентрациями растворов объем пробы был увеличен в 10 раз, что привело к
получению удовлетворительных данных и пятен хорошей формы и интенсивности.
Ввиду сложности изучаемого вещества и недостатков метода ТСХ градуировочные
зависимости воспроизводились в каждой серии растворов.
.2 Расчет изотерм сорбции
По описанной в п. 2.2. методике провели сорбцию
ФХ на изучаемых сорбентах. После определения концентрации ФХ в растворе
проводили обработку данных.
Количество исходного вещества (
 ) рассчитывали по формуле (3.1):
) рассчитывали по формуле (3.1):

где C0 -
концентрация исходного раствора, мг/мл; V - объем спиртового раствора ФХ, мл.
Количество сорбируемого вещества (
 ) рассчитывали по формуле (3.2):
) рассчитывали по формуле (3.2):

где C -
концентрация фильтрата, мг/мл; V - объем спиртового раствора ФХ, мл.
Разность между количеством
сорбируемого вещества находится по формуле (3.3):

Обменная емкость сорбента
(адсорбция) равна (3.4):

где m - масса навески сорбента, г.
По приведенным формулам рассчитывали
данные необходимые для построения изотермы сорбции (П.2 - П.5).
В ранних работах было выяснено, что
фосфатидилхолин склонен к мицеллобразованию уже при довольно низких
концентрациях растворов. ККМ в растворе этилового спирта составляет 4,56 мг/мл.
Однако работа при низких концентрациях ФХ не имеет практического применения,
так как последующее выделение этого соединения из растворов в интервале
концентраций меньше ККМ привела бы к значительным затратам растворителей. Но
стоит отметить, что изучение разбавленных растворов ФХ может дать полезные
сведения о механизме сорбции. В связи с этим нами была проведена работа по
изучению сорбции ФХ из растворов в интервале концентраций: 0,01 - 0,50 мг/мл.
Для начала были построены графики
зависимости емкости сорбента КУ-2-8 от равновесной концентрации в нейтральной и
кислой средах (рис. 3.1) и рис. (3.2).

Рис. 3.1. Изотермы сорбции ФХ на
сорбенте КУ-2-8 в нейтральной и кислой средах
В предыдущих работах было доказано,
что механизм сорбции ФХ на ионообменнике может быть двух типов - ионный обмен
или гидрофобные взаимодействия с матрицей сорбента. В случае реализации
механизма ионного обмена на первом этапе формируется мономолекулярный слой
согласно теории Ленгмюра, а затем, после накопления сорбированных молекул ФХ на
поверхности зерна сорбента, начинается процесс сорбат-сорбатного
взаимодействия. При сорбции по гидрофобному взаимодействию невозможно выделить
этап формирования мономолекулярного слоя, так как одновременно проходят два
процесса - сорбция ФХ на поверхности зерна сорбента и связывание свободных
молекул ФХ сорбированными частицами (ссылка на работу Маши)
В случае работы с КУ-2-8 обе
изотермы соответствуют виду кривой полимолекулярной сорбции: на первом этапе
формируется мономолекулярный слой по ионообменному механизму, а дальнейший рост
изотермы обусловлен включением механизма сорбции за счет гидрофобных связей. В
кислой среде насыщение сорбента ФХ происходит быстрее и кривая выходит на плато
уже при равновесной концентрации раствора, равной 0,14 мг/мл, в отличие от
нейтральной среды, где кривая выходит на плато при значении 0,17 мг/мл. Помимо
этого стоит отметить, что в кислой среде формирование мономолекулярного слоя
происходит при значении обменной емкости гораздо большем (2,81 мг/г), чем в
нейтральной среде (1,28 мг/г).
Это обусловлено тем, что
формирование мономолекулярного слоя на поверхности сорбента происходит за счет
электростатических сил притяжения, причем эти силы притяжения больше сил
отталкивания полярных частей ФХ друг от друга вследствие одноименности зарядов.
Кроме того, катион ФХ имеет наименьший по сравнению с другими формами радиус
молекулы, что благотворно сказывается на стехиометрии процесса. Вышеназванные
причины и объясняют процесс образования первого слоя ФХ на поверхности сорбента
в кислой среде.
Немного иначе происходит
формирование мономолекулярного слоя на поверхности сорбента в нейтральной
среде. Здесь к матрице сорбента притягиваются уже цвиттер-ионы ФХ, обладающие
большим радиусом. Силы электростатического притяжения уже не так сильны, из-за
чего происходит формирование более рыхлой структуры и на поверхности сорбента
находится меньшее число молекул ФХ.
При дальнейшем увеличении
концентрации наступает формирование второго слоя, которое также завершается
быстрее в кислой среде, нежели в нейтральной.
До этого этапа все процессы сорбции
изучались с применением только сильнокислотных катионообменников или
сильноосновных анионообменников (АВ-17-8, АВ-17-2П, ЭДЭ-10-П). Представляется
интересным изучить сорбцию на слабокислотном катионообменнике КБ-4.

Рис. 3.2. Изотермы сорбции ФХ на
сорбенте КБ-4 в нейтральной и кислой средах
Для начала рассмотрим изотерму
сорбции в кислой среде (рис. 3.2). На первый взгляд она напоминает изотерму
сорбции на сильнокислотном катионообменнике, однако, сравнивая величины
поглощения с величиной ПОЕ, видно, что при выходе на плато наблюдается
сверхэквивалентная сорбция. Это можно объяснить совместным действием двух
механизмов - ионообменного и сорбции по матрице сорбента. Ввиду низкой
активности данного сорбента в кислых средах, небольшой (по сравнению с КУ)
величиной активности ионообменных групп мы получаем сорбцию как результат
одновременного действия двух сил. В данном случае процесс поочередного
формирования первого монослоя нивелируется именно одновременной сорбцией за
счет гидрофобного взаимодействия. Далее необходимо было провести сравнительный
анализ изотерм в зависимости от разного типа сорбентов в одинаковых условиях.

Рис. 3.3. Изотермы сорбции ФХ на сорбентах
КУ-2-8 и КБ-4 в нейтральной среде
Сравнивая изотермы сорбции обоих
катионитов в нейтральной среде (рис. 3.3), мы можем пронаблюдать, что на
сильнокислотном катионите КУ-2-8 уже в пределах малых равновесных концентраций
растворов ФХ (0,09 - 0,17 мг/мл) наблюдается формирование мономолекулярного
слоя за счет ионообменного взаимодействия, тогда как при использовании КБ-4
формирование данного слоя происходит за счет гидрофобного взаимодействия,
начиная со значения 0,29 мг/мл равновесной концентрации ФХ. Также на сорбенте
КУ-2-8 при повышении концентрации раствора происходит полимолекулярная сорбция
за счет гидрофобных взаимодействий, в то время как на сорбенте КБ-4 мы
наблюдаем только рост кривой без выхода на плато. Стоит отметить, что величины
поглощения ФХ при сорбции сильнокислотным катионообменником в идентичных
растоврах превышают аналогичное значение у слабокислотного сорбента почти в 4
раза.
Аналогичная ситуация наблюдается при
сорбции на данных катионообенниках и в кислой среде (рис. 3.4).

Рис. 3.4. Изотермы сорбции ФХ на
сорбентах КУ-2-8 и КБ-4 в кислой среде
Как уже говорилось выше, на
сильнокислотном катионообменнике ясно видны этапы формирования первого
монослоя, дальнейший рост величины поглощения и начальный этап формирования
второго слоя за счет сорбат-сорбатных взаимодействий. В случае использования
КБ-4 наблюдается плавное возрастание изотермы до значения емкости, равной 6,17
мг/г. Это значение величины поглощения в области перегиба на кривой сорбции
КБ-4 сопоставимо с аналогичным значением для изотермы КУ-2-8 в области второго
перегиба (8,04 мг/г), что может свидетельствовать о том, что в случае с КБ-4 мы
наблюдаем перегиб при образовании второго слоя сорбированного ФХ.
3.3 Анализ ИК-спектров
Для изучения влияния кислотности среды на
пространственную ориентацию молекул использовали спиртовые растворы ФХ.
Варьирование величины рН осуществляли добавлением HCl.
Растворы фосфолипидов наносили тонким слоем на подложку из монокристаллического
кремния и удаляли растворитель высушиванием при 40
ºС
в термостате. Широко используемые ранее методики получения ИК-спектров
образцов, таблетированных с KBr,
не всегда позволяют получить полную информацию о строении веществ, так как
бромистый калий может содержать воду, вследствие чего на спектрах появляются
дополнительные максимумы, перекрывающие характеристические полосы поглощения
ФЛ. Методика, основанная на кристаллизации веществ на подложке из кремния,
позволяет избежать отмеченных недостатков.
ИК-спектры образцов фосфолипидов получали на
спектрометре с Фурье-преобразованием «Vertex
70», с последующей обработкой программой GRAMS
4/32.

Рис. 3.5. ИК-спектр фосфатидилхолина (рН 7)

Рис. 3.6. ИК-спектр фосфатидилхолина (рН 2)
Таблица 3.1
Отнесение полос поглощения ФХ
|
Функциональная
группа
|
Связь
|
Частота,
см-1
|
|
|
pH 7
|
pH 12
|
|
  3500-32003500 - 3200 3500-32003500 - 3200
|
|
|
|

 2925 (νs)
2925 (νs)
(νas)
(δas)
(δs)2925 (νs)
(νas)
(δas)


1736
|
1737
|
|
|
|
|
  16551634, 1653 16551634, 1653
|
|
|
|
|
P - O - C
|
 10871102 10871102
|
|
|
|
  11741168 11741168
|
|
|
|
|
 30103010 30103010
|
|
|
|
  975984 975984
|
|
|
|
СПИСОК ЛИТЕРАТУРЫ
1. Преображенский
Н.А. Химия биологически активных природных соединений / Н.А. Преображенский,
Р.П. Евстигнеева. - М.: Химия, 1976. - С. 320-334.
. Филиппович
Ю. Б. Основы биохимии: учебник для студ. хим. и биол. специальностей пед.
ин-тов / Ю.Б. Филиппович. - М.: Высшая школа, 1985. - 502 с.
. Скатков
С.А. Нарушение липидного обмена и репродуктивная функция женского организма /
С.А. Скатков // Фармация. - 2001. - №6. - С. 30-32.
. Кольман
Я. Наглядная биохимия / Я. Кольман, К.-Г. Рем; перевод с нем. под ред. П.Д.
Решетова. - М.: Мир, 2000. - 469 с.
. Арутюнян
Н.С. Фосфолипиды растительных масел / Н.С. Арутюнян, Е.П. Корнена. - М.:
Агропромиздат, 1986. - С. 3-105.
. Ленинджер
А. Основы биохимии: в 3 т. / А. Ленинджер; перевод с англ. под ред. В.В.
Борисова, М.Д. Гроздовой, С.Н. Преображенского; под ред. В.А. Энгельгарта, Я.М.
Варшавского. - М.: Мир, 1985. - Т.1. - 365 с.
. Дэвис
Д. Биохимия растений / Д. Дэвис, Дж. Джованелли, Т. Рис; перевод с англ. под
ред. А.А. Бундель, А.Б. Вакара, Ж.В. Успенской; под ред. В.Л. Кретовича. - М.:
Мир, 1966. - 512 с.
8. Dawson
R.M.C. Lipid chromatographic Analysis // Dekker InS. New york, 1967. - v.1 -
pp.163-189.
. Насонов
Е.Л. Биохимия фосфолипидов / Е.Л. Насонов. - М.: Наука, 1999. - 572 с.
10. Bangham
A.D., Horne R.W. Negative staining of phospholipids and their strucrured
modification by surface agents as observed in electron microscope. J
Mol Biol. 1964, 8, 660-668.
11. Bangham
A.D., Standish M.M., Watkins J.C. Diffusion of univalent ions across the
lamelae of swollen phospholipids. J Mol Biol. 1965,
13, 238-252.
. Барсуков
Л.И., Липосомы. Соросовский обозревательный журнал. 1998, N 10, 2-9.
13. Bangham
A.D. In Liposomes Letters (Bangham A.ed), L., N.Y., Acad Press. 1983,
12-15.
. Геннис
Р.Б. Биомембраны. Молекулярная структура и функции. Перевод с английского, М.,
1997, 83.
15. Jackson
R.L. , Gotto A.M. Phospholipids in biology and medicine. N. Engl. J. Med. ,
1974 , 290, 24-29 and 87-93.
. Ипатова
О.М. Фосфоглив: механизм действия и применение в клинике. Под ред. академика
РАМН Арчакова А.И. М.: Изд. ГУ НИИ биомедицинской химии РАМН, 2005. с.318
. Ауэрман
Л.Я. Исследование поверхностно-активных свойств фосфотидного концентрата / Л.Я.
Ауэрман, Л.И. Пучкова // Известия вузов СССР. - 1960. - №5. - С. 75-79.
. Кучеренко
Н.Е. Липиды / Н.Е. Кучеренко, А.Н. Васильев. - Киев: Вища шк., 1985. - С.
24-25.
. Ясудо
и Оно. Выделение и количественное определение фосфолипидов/ Ясудо и Оно.
Специальный выпуск. 1967
. Кейтс
М. Техника липидологии / М. Кейтс. - М.: Мир, 1975. - 322 с.
. Василенко
И.А. Проблемы и перспективы производства фосфолипидов / Василенко И.А. //
Химико-фармацевтический журнал. - 1998. - №5.
. Шаршунова
М. Тонкослойная хроматография в фармации и клинической биохимии: в 2 т. / М.
Шаршунова, В. Шварц, У. Михалец; перевод со словацкого под ред. А.П. Сергеева,
А.Н. Ушакова; под ред. В.Г. Березкина, С.Д. Соколова. - М.: Мир, 1980. - 621 с.
. Гейсс
Ф. Основы тонкослойной хроматографии / Ф. Гейсс. - М., 1988. - С. 31-85.
. Джавадов
А.К. Определение фосфолипидов методом тонкослойной хроматографии с последующей
денситометрией / А.К. Джавадов // Лабораторное дело. - 1989. - №2. - С. 28-29.
. Мацуль
В.М. Использование метода проточной горизонтальной хроматографии для выделения
фосфатидилинозитолов из различных тканей / В.М. Мацуль, А.В. Каргаполов //
Вопросы медицинской химии. - 1990. - Т.36. №2. - С. 80-82.
. Джавадов
А.К. Определение фосфолипидов методом тонкослойной хроматографии с последующей
денситометрией / А.К. Джавадов // Лабораторное дело. - 1989. - №2. - С. 28-29.
. Сумина
Е.Г. Тонкослойная хроматография. Теоретические основы и практическое
применение: учебно-методическое пособие / Е.Г. Сумина, С.Н. Штыков, Н.В.
Тюрина. - Саратов: Изд-во Сарат. ун-та, 2002. - 120 с.
. Наканиси
К. Инфракрасные спектры и строение органических соединений: практ. руководство
/ К. Наканиси. - М.: Мир, 1965. - 216 с.
. Кесслер
И. Методы ИК-спектроскопии в химическом анализе / И. Кесслер; перевод с нем.
под ред. М.В. Шишкиной; под ред. М.М. Кусакова. - М.: Мир, 1964. - 286 с.