Гемоксигеназа и ее роль в функционировании сердечнососудистой системы
Курсовая
работа по теме:
Гемоксигеназа
и ее роль в функционировании сердечно-сосудистой системы
Список использованных сокращений
АЛК - 5-аминолевулиновая кислота
ГО - гем-оксигеназа
ГО-1 - гем-оксигеназа - 1
ГО-2 - гем-оксигеназа - 2
ГО-3 - гем-оксигеназа - 3gene - ген биливердина
крысы- heat shock proteins - белки теплового шока
Введение
Конец ХХ века был ознаменован существенным
расширением и переоценкой сложившихся представлений о тонких механизмах
регуляции различных функций организма, как в нормальных условиях, так и при
развитии патологий. Именно в это время появились и углубились представления о
таких важных регуляторах физиологических функций организма, как фосфолипидные
производные, многочисленные цитокины, регуляторы роста, оксид азота и многие
другие [1].
Среди них все более значимое место занимает
монооксид углерода, известный ранее исключительно как токсичное соединение,
нарушающее транспорт кислорода в организме и приводящее к развитию заболеваний
сердца и легких [2].
Однако проведенные в последние годы исследования
показали, что монооксид углерода и другие продукты, образующиеся в
гемоксигеназной реакции, могут принимать участие в регуляции физиологических
функций и даже выступать протекторами при возникновении ряда патологических
состояний [3].
По оказываемым физиологическим эффектам:
вазодилатация, сигналинг в нервной системе, действие монооксида углерода
подобно оксиду азота, однако, в отличие от него, не зависит от эндотелия [4].
Ряд проведенных исследований свидетельствует о
значительной роли гем-оксигеназы-1 в ответе организма на стрессовые состояния и
адаптации к ним, в то время как дефицит фермента приводит к тяжелым
патологическим состояниям [5].
Именно эти данные и усилили интерес к
исследованию роли гемоксигеназы в регуляции и поддержании функций организма
[1].
1. Характеристика гем -
гемоксигеназной системы
Метаболизм гема. Гем, железосодержащее
тетрагидропиррольное окрашенное вещество, является составной частью
О2-связывающих белков и различных коферментов оксидоредуктаз. Почти на 85%
биосинтез гема происходит в костном мозге, и лишь небольшая часть - в печени.
В синтезе гема участвуют митохондрии и
цитоплазма. Гем является важнейшей составляющей белка гемоглобина (приложения,
рис. 3).
Метаболизм гема представляет собой совокупность
сложных процессов его синтеза, деградации и транспорта. В норме основным
источником гема является его синтез de novo [21].
Существуют несколько биологически важных типов
гема (приложения, рис. 4, 5) [22, 25]:
|
Гем
a
|
Гем
b
|
Гем
c
|
Гем
o
|
|
Химическая
формула
|
C49H56O6N4Fe
|
C34H32O4N4Fe
|
C34H36O4N4S2Fe
|
C49H58O5N4Fe
|
|
Функциональная
группа при C3
|
Hydroxyfarnesyl
|
-CH=CH2
|
-CH-(CH3)-SH
|
Hydroxyfarnesyl
|
|
Функциональная
группа при C8
|
-CH=CH2
|
-CH=CH2
|
-CH-(CH3)-SH
|
-CH=CH2
|
|
Функциональная
группа при C18
|
-CH=O
|
-CH3
|
-CH3
|
-CH3
|
Пути биосинтеза гема удалось выяснить благодаря
работам Shemin (1946-1953 гг.), Granick (1949-1968 гг.) и др. Было установлено,
что для синтеза одной молекулы гема необходимо 8 молекул аминокислоты глицина
(NH2-CH2-COOH).
При помощи ферментов, содержащихся в ядерных
эритроцитах птиц, удалось воспроизвести in vitro биосинтез порфиринов из
глицина. Наиболее интенсивно этот биосинтез идет тогда, когда в инкубационной
среде находится янтарная кислота или ее соли - сукцинаты.
Биосинтез гема. Синтез тетрагидропиррольных
колец начинается в митохондриях. Из сукцинил-КоА, промежуточного продукта
цитратного цикла, конденсацией с глицином получается продукт,
декарбоксилирование которого приводит к 5-аминолевулинату. Отвечающая за эту
стадию 5-аминолевулинат-синтаза, является ключевым ферментом всего пути.
Экспрессия синтеза аминолевулинат-синтазы тормозится гемом, т. е. конечным
продуктом - это типичный случай торможения конечным продуктом, или
ингибирования по типу обратной связи [23].
После синтеза 5-аминолевулинат переходит из
митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген,
который уже содержит пиррольное кольцо. Порфобилиноген-синтаза ингибируется
ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче
обнаруживают повышенные концентрации 5-аминолевулината.
На последующих стадиях образуется характерная
для порфирина тетрапиррольная структура. Связывание четырех молекул
порфобилиногена с отщеплением NH2-групп и образованием уропорфириногена III
катализируется гидроксиметилбилан-синтазой. Для образования этого
промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза.
Отсутствие этого фермента приводит к образованию «неправильного» изомера -
уропорфириногена I [24].
Тетрапиррольная структура уропорфиринoгена III
все еще существенно отличается от гема. Так, отсутствует центральный атом
железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца
несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков).
Так как группы гема в белках функционируют в неполярном окружении, необходимо,
чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре
ацетатных остатка (R1) декарбоксилируются с образованием метильных групп.
Образующийся копропорфириноген III снова
возвращается в митохондрии. Дальнейшие стадии катализируются ферментами,
которые локализованы на/или внутри митохондриальной мембраны. Прежде всего, под
действием оксидазы две пропионатные группы (R2) превращаются в винильные.
Модификация боковых цепей заканчивается образованием протопорфириногена IX
[22].
На следующей стадии за счет окисления в молекуле
создается сопряженная π-электронная
система, которая придает гему характерную красную окраску. При этом расходуется
6 восстановительных эквивалентов. В заключение с помощью специального фермента,
феррохелатазы, в молекулу включается атом двухвалентного железа. Образованный
таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и
миоглобин, где он связан нековалентно, или в цитохром С, с которым связывается
ковалентно [25, 26]. Подробно схема биосинтеза гема приведена в приложениях на
схеме 1 и 2.
Скорость образования гема с одной стороны
зависит от активности ключевого фермента синтеза гема - 5-аминолевулинатсинтазы
(синтетаза 5-аминолевулиной кислоты), а с другой - накопление свободного гема в
ткани определяется также скоростью его разрушения гемоксигеназой [27].
Биосинтез гема, вероятно, контролируется по
принципу обратной связи, т. е. такой системы регуляции, при которой накопление
продукта, образующегося в ходе реакции, служит сигналом для торможения или
полного прекращения реакции. Работами Granick было показано, что скорость
синтеза гема зависит от реакции образования 5-аминолевулиновой кислоты. Можно
предположить, что гем подавляет образование синтазы АЛК [28].
Дополнительным источником может явиться гем,
высвобожденный из клеточных гемопротеинов, а в клетках, имеющих рецепторы к
гем- и гемоглобинсвязывающим белкам плазмы крови [29], также гем,
высвобожденный из гемоглобина эритроцитов [30].
Основными путями утилизации гема в клетке
являются синтез de novo гемопротеинов, связывание гемсвязывающими белками и
специфическими регуляторными сайтами, а также его деградация в гемоксигеназной
реакции [калиман баранник].
В норме процессы синтеза, деградации и
связывания гема находятся в динамическом равновесии, что предотвращает
накопление свободного гема [10], обладающего сильными прооксидантными
свойствами [31].
Характеристика фермента. В клетках млекопитающих
широко представлен уникальный класс ферментов - оксигеназ, катализирующих
окислительно-восстановительные реакции с участием молекулярного кислорода. В
настоящее время известно более 1000 индивидуальных ферментов этого класса и
более 1200 кодирующих их генов [6].
Оксигеназы разделяются на диоксигеназы,
внедряющие два атома кислорода в молекулу субстрата, и монооксигеназы,
катализирующие реакции с включением одного атома кислорода в субстрат, в то
время как другой восстанавливается до воды. Наиболее многочисленными монооксигеназными
реакциями являются реакции с участием цитохрома Р450 (КФ 1.14.14.1,
монооксигеназы со смешанными функциями) [7].
Монооксигеназы участвуют в синтезе и метаболизме
многих важных классов физиологических соединений - стероидных гормонов, желчных
кислот, витаминов, нейротрансмиттеров, жирных кислот, простагландинов,
ксенобиотиков [8]. Обычно в качестве восстановителя в монооксигеназных реакциях
участвует NADH или NADPH [1].
Монооксигеназы в клетке многочисленны и
разнообразны. Они катализируют реакции свободного окисления. Участие в
процессах, сопряженных с запасанием клеткой энергии, маловероятно.
К монооксигеназам относятся и гем-оксигеназы. ГО
(КФ 1.14.99.3) являются скоростьлимитирующими ферментами, катализирующими
превращения гема в биливердин, монооксид углерода (СО) и железо [9, 10].
Гемоксигеназы - оксигеназы со смешанными
функциями. В этом случае 1 атом поглощенной молекулы кислорода используется для
окисления вещества путем прямого присоединения к нему, а другой
восстанавливается до H2O в присутствии подходящего донора электронов.
Деградация гема гемоглобина происходит при
помощи двух механизмов: ферментативного и химического. Однако оба эти механизма
идут с утилизацией молекулярного кислорода О2 и нуждаются в восстановительных
агентах для восстановления железа гема из Fe3+ в Fe2+ [10]. В реакции,
катализируемой ГО, источником восстановительных эквивалентов является NADPH.
Субстраты, продукты и катализируемая реакция. ГО
специфически расщепляет ά - метеновый
мостик гема и метеновый атом углерода окисляется до СО, и два атома кислорода
включаются в тетрапиррол - биливердин [10].
Боковые гидрофобные цепи, таким образом,
ориентируют плоскость гема в гидрофобной щели белка, что обеспечивают
возможность встраивания одного атома кислорода в углеродный мостик между первым
и вторым кольцами порфирина в то время как другой атом кислорода
восстанавливается до воды. Последующее присоединение воды приводит к
возникновению нестабильной структуры, от которой отщепляется мостиковый углерод
в форме монооксида углерода, в результате чего и образуется биливердин. Этот
процесс можно выразить следующей суммарной реакцией:
геном гемоглобин митохондрия синтез
NADPH
ГЕМ Биливердин + СО + Fe2+
О2
Рис. 1
Для ГО наилучшим субстратом является протогемин
IX, называемый также метгем, связанный с альбумином (метгемальбумин), однако
метгемоглобин, гемоглобин - гаптоглобиновый комплекс также является субстратом
для ГО.
Не атакуются ГО такие субстраты, как
оксигемоглобин, карбоксигемоглобин и миоглобин. Непосредственным субстратом для
ГО является хелатный комплекс с металлом, а свободные порфирины не атакуются
[11].
Источником основной части биливердина,
образующегося в ретикулоэндотелиальной системе, является гем гемоглобина,
однако другие гемопротеины, такие как цитохром Р 450, триптофанпирролаза,
цитохром b5 и каталаза также атакуются ГО, то есть их гем вносит свой вклад в
образование пула биливердина.
Формы гемоксигеназы. На сегодня известны три
изоформы ГО. ГО-1 - индуцибельная форма фермента, отвечающая за адаптацию
организма к таким стрессам, как гипоксия, окислительный стресс, действие
тяжелых металлов и цитокинов [12] (приложения, рис. 1).
Гены, ответственные за синтез ГО-1 у человека
расположены в длинном плече 22 хромосомы в позиции 13.1 от оснований 34, 101,
636 до 34, 114, 748 [13, 18].
ГО-2 - конститутивная изоформа фермента (36
kDa), экспрессия которой происходит при нормальных физиологических условиях
[14] (приложения, рис. 2). Локализуется данная изоформа исключительно в
эндоплазматическом ретикулуме и активируется протеинкиназой С и рядом других
биологически активных соединений. Гены, ответственные за синтез ГО-2 у человека
и у мыши расположены в 16 хромосоме [15, 18].
Относительно недавно была открыта третья форма -
ГО-3 (36 kDa) - конститутивная форма ГО, на 90% гомологичная ГО-2. ГО-3
обнаружена в тканях многих органов: селезенке, легких, сердце, печени, нервной
ткани [16]. ГО-3 состоит из двух регуляторных субъединиц, берущих участие в связывании
гема. ГО-3 каталитически значительно менее активна, чем ГО-2, известно, что
работает она только в присутствии кислорода [17].
ГО-1 и ГО-2 наиболее подробно изучены и
охарактеризованы: ГО-1 была открыта более трех десятков лет назад, с момента
идентификации ГО-2 прошло около двадцати лет.
Ферменты являются продуктами активности генов,
различных по организации, структуре и расположению [18], и ни по
аминокислотному составу, ни по размеру или числу транскриптов близкого сходства
для них не выявлено [16, 19].
ГО-1, известная также под названием HSP 32,
меньше других изоформ, ее молекулярный вес около 30-33 kDa [20].
Проведенные исследования показали, что и ГО-1, и
ГО-2 - это в высшей степени консервативные ферменты: для крыс, мышей и человека
была показана высокая степень гомологии для ГО-1 (около 80 %), а для ГО-2 была
показана гомологичность свыше 90% среди таких представителей, так кролик, крыса
и человек.
2. Продукты гемоксигеназы
Продукты гемоксигеназной реакции являются
биологически активными соединениями и участвуют в защитных реакциях при
оксидативном стрессе [5]. Так, билирубин проявляет антиоксидантные свойства, СО
является важной регуляторной молекулой, а железо стимулирует активацию
экспрессии гена ферритина, в результате чего происходит связывание Fe2+ и
выведение его из реакции Фентона.
Катаболизм гема является единственной реакцией в
организме, которую можно наблюдать невооруженным глазом: после удара на месте
ушиба появляется кровоподтек - т. н. «синяк». Он окрашивает кожу в синевато -
черный или пурпурный цвет - это цвет гема, который попадает в кожу из
поврежденных при ударе эритроцитов. Сине-красный цвет гема постепенно меняется
на зеленый - цвет биливердина, который переходит в желтый цвет - цвет
билирубина.
Биливердин. После ферментативного освобождения
гема из гемоглобина или гемопротеинов посредством микросомальных гемоксигеназ
мембран цитоплазматического ретикулума посредством активирования кислорода и
при воздействии НАДФ-цитохром-с-редуктазы, происходит образование ά-гидрокси-гема.
При этом активированный кислород воздействует на ά-метиновые
мостики циклического тетрапиррола.
Благодаря этому расщепляется протопорфириновое
кольцо при освобождении монооксида углерода, и возникает комплекс биливердина с
железом. После гидролиза комплекса биливердина с железом на железо и биливердин
IX
ά
посредством биливердинредуктазы цитозоля происходит восстановление центрального
метинового кольца биливердина в биливердин IX ά 2
[32].
Поскольку три фермента (микросомальная
гемоксигеназа и NADPH - цитохром - Р 450 - редуктаза, а также
биливердинредуктаза цитозоля), которые катализируют образование билирубина из
гема, в форме ферментативного комплекса на поверхности эндоплазматического
ретикулума, биливердин на этом комплексе восстанавливается в билирубин [33].
Таким образом, образованный из биливердина
билирубин представляет собой субстрат для билирубин - УДФ -
глюкуронилтрансферазы, содержащейся в эндоплазматическом ретикулуме.
УДФ - глюкуронилтрансфераза катализирует
образование билирубинмоноглюкуронидов. Затем происходит синтез
билирубиндиглюкуронидов, осуществляемый УДФ - глюкуронилтрансферазой.
Для образования билирубиндиглюкуронидов из
билирубинмоноглюкуронидов обсуждались возможности спонтанного образования
диглюкуронидов или ферментативный перенос глюкуроновой кислоты от молекулы
билирубинмоноглюкуронида при связывании билирубиндиглюкуронидов посредством
билирубинглюкуронозид-глюкуронозилтрансферазы. Посредством глюкуронирования
нерастворимый в воде билирубин приобретает водорастворимость [33, 34].
Нерастворимость в воде образующегося при
разложении гема билирубина IX ά основывается
на том, что образуются внутримолекулярные водородные мостики между группой
пропионовой кислоты пиррольного кольца и азотом не находящихся по соседству
внешних пиррольных колец. Таким образом достигается стерическое складывание
билирубина, что уменьшает его гидрофобные, то есть липофильные свойства. По
этой причине неконъюгированный билирубин IXά диффундирует
в мозг, плаценту и слизистую кишечника [35].
При воздействии световой энергии с длиной волны
от 400 до 500 нм внешние пиррольные кольца молекулы билирубина IX
ά могут
поворачиваться вокруг двойной связи.
Посредством такой фотоизомеризации молекулы
билирубина в так называемый фотобилирубин больше не могут образовываться внутримолекулярные
водородные мостики. Таким образом, билирубин становится водорастворимым и,
следовательно, он может без конъюгации с глюкуроновою кислотой выделяться в
желчь. Эффект фотоизомеризации билирубина применяется в случае фототерапии
желтушных новорожденных [33].
Ежедневно у взрослого человека образуется около
250-350 мг билирубина на 1 кг массы тела при распаде гема. При этом главным
источником образования билирубина является гем гемоглобина. Около 70% ежедневно
образующихся желчных пигментов возникают из гемоглобина при распаде эритроцитов
в ретикуло-эндотелиальной системе (в селезенке, костном мозге и в печени) [36].
Участие печени в ежедневном образовании
билирубина составляет 10-37%, причем в печени главным источником служат
микросомальные цитохромы, каталаза, триптофанпирролаза и митохондриальный
цитохром b. Также в плазме связанные с гаптоглобином гемоглобин, метгемоглобин
или метгемальбумин служат источником печеночного образования билирубина,
поскольку гепатоциты используют компоненты гема для образования билирубина [35,
36].
Неконъюгированный билирубин в плазме имеет
высокое сродство с местом связывания альбумина, таким образом,
неконъюгированный билирубин в плазме появляется в нерастворенном виде [37, 38]
После транспорта билирубина через плазматическую
мембрану синусоида гепатоцитов билирубин связывается с транспортными белками
цитозоля [39].
Монооксид углерода. Как уже говорилось выше,
источником образования монооксида углерода (СО) является гем, из которого, при
действии фермента гемоксигеназы, также образуется билирубин и, кроме того,
высвобождается свободное железо [40].
И если образующийся при действии гемоксигеназы
билирубин обладает свойствами антиоксиданта, то угарный газ действует во многом
аналогично еще одному газообразному продукту нормальных метаболических
процессов - оксиду азота. Как и у оксида азота, главной мишенью действия
монооксида углерода является растворимая форма гуанилатциклазы. В головном
мозге монооксид углерода участвует в регуляции мозгового кровотока и функций синаптических
контактов [41].
В сердечно-сосудистой системе в целом его
образование является одним из факторов, противодействующим развитию гипертонии.
В легких он регулирует тонус бронхов. В гипоталамусе монооксид углерода
стимулирует секрецию кортиколиберина и вазопрессина при действии эндотоксина и
при стрессе. В матке монооксид углерода снижает сократительные свойства
миометрия [42].
В печени монооксид углерода опосредует регуляцию
тонуса желчевыводящих протоков [43].
Монооксид углерода, который является необходимым
участником сигнальной трансдукции и потенциальным вазодилятатором, с другой
стороны может выступать как блокатор гемопротеинов [44].
Железо. Железо, незаменимый элемент для роста и
выживания организмов, играет важную роль в многочисленных биологических
функциях.
Его участие особенно очевидно в транспорте
кислорода гемоглобином, в синтезе ДНК (в составе коэнзима редуктазы
рибонуклеотидов) и в активности оксидоредукции многочисленных митохондриальных
энзимов [45].
Взрослый человек несет в себе приблизительно 4 г
железа. Последнее обеспечивается за счет очень небольшой части поступающей с
пищей и в основном за счет рециклирования железа, начиная с лизиса старых
кровяных телец. В этом последнем механизме особенно задействованы макрофаги
селезенки и красного костного мозга, и в меньшей мере, клетки Kupffer.
От 60 до 70% железа инкорпорированы в
гемоглобин. Приблизительно 10% находится в миоглобине, цитохромах и энзимах
содержащих железо. Остальное железо переходит в запас железа или в форме
ферритина (легко мобилизируемая форма резерва) или в форме гемосидерина (трудно
мобилизуемая форма резерва). Плазматический транспорт включает
трансферритиновое железо и составляет приблизительно 1% железа от общего объема
организма [46].
Железо, находящееся в организме человека, можно
разбить на 2 большие группы: клеточное и внеклеточное. Соединения железа в
клетке, отличающиеся различным строением, обладают характерной только для них
функциональной активностью и биологической ролью для организма. В свою очередь их
можно подразделить на 4 группы [45]:
. гемопротеины, основным структурным элементом
которых является гем (гемоглобин, миоглобин, цитохромы, каталаза и
пероксидаза);
. железосодержащие ферменты негеминовой группы
(сукцинат-дегидрогеназа, ацетил - коэнзим А - дегидрогеназа, НАДН - цитохром
С-редуктаза и др.);
. ферритин и гемосидерин внутренних органов;
. железо, рыхло связанное с белками и другими
органическими веществами.
Ко второй группе внеклеточных соединений железа
относятся железо-связывающие белки трансферрин и лактоферрин, содержащиеся во
внеклеточных жидкостях.
Ежедневные потери железа чрезвычайно малы,
порядка 1 мг в день. В основном они осуществляются через пищеварительный тракт:
десквамация эпителиальных клеток кишечника, микрокровотечения и потери с желчью
[46].
Железо также теряется и при десквамации
эпителиальных клеток кожи, и в меньшей степени с мочой. Компенсация этих потерь
имеет фундаментальное значение и происходит путем абсорбции железа из пищи.
Интестинальная абсорбция представляет главный
этап, который должен тщательно регулироваться; человеческий организм не имеет
средств контроля за его экскрецией. Регуляция этой абсорбции сама находится под
воздействием общего содержания железа в организме, эритропоетической
активности, гипоксии и содержания железа и природы питания [46].
Энтероциты ворсинок двенадцатиперстной кишки и
проксимальной части jejunum ответственны почти за полную абсорбцию гемового и
негемового железа. Эти энтероциты являются результатом созревания и миграции
мультипотентных исходных клеток, располагающиеся в дуоденальных криптах. Чтобы
попасть из интестинального просвета в плазму, железо должно пересечь апикальную
мембрану, сам энтероцит, а затем базолатеральную мембрану [45].
Железо гема эндоцитируется с молекулой гема после
сливания с потенциальным, пока еще не идентифицированным, рецептором. Затем
железо освобождается в энтероците после отторжения молекулы гема
гем-оксигеназой.
В физиологических условиях при распаде
эритроцитов в РЭС 9/10 всего железа используется на образование новых
эритроцитов и 1/10 часть, которая выделяется из организма, компенсируется
поступлениями с пищей. Таким образом, в организме существует постоянный
кругооборот железа.
Биологическая и биохимическая значимость железа
определяется, прежде всего, его участием в связывании и транспорте кислорода,
клеточном дыхании, что является непременным условием существования всякой живой
клетки. Оно играет важную роль в энергетическом метаболизме в цикле Кребса и
митохондриальной электронно-транспортной цепи, участвует в реакциях
окислительного фосфорилирования и построении и активации антиоксидантных
ферментов, где детоксицирует активные центры кислорода, защищая, таким образом,
мембраны клеток от разрушения.
Интенсивность метаболизма железа зависит от его
расхода. Специфические и неспецифические механизмы защиты организма в
значительной степени зависят от обмена этого элемента. Обнаружена четкая
зависимость индекса фагоцитоза от коэффициента насыщения трансферрина железом.
При дефиците железа происходит снижение
фагоцитарного показателя (количество фагоцитов на 100 нейтрофилов) и уменьшение
продукции секреторного компонента IgA, а также увеличение синтеза IgE, что
облегчает инфицирование организма. В острую фазу патологического процесса
(нарушение иммунологического статуса, инфекция, воспаление, неоплазия)
изменяется нормальный цикл кругообращения железа в РЭС, ухудшается его
транспорт и реутилизация гемоглобином [46].
И биливердин, и билирубин обладают
антиоксидантными свойствами [47]. Монооксид углерода служит сигнальной
молекулой [48]. Освобождение железа в катаболизме гема стимулирует синтез
ферритина [49].
Таким образом, на основании вышесказанного,
продукты деградации гема в гемоксигеназной реакции - ионы железа, монооксид
углерода и биливердин, который затем превращается в билирубин, и, согласно
литературным данным, участвуют в адаптации метаболизма к действию стрессорных
факторов [21]: монооксид углерода выполняет регуляторные функции наряду с NO,
биливердин и билирубин действуют как антиоксиданты, а ионы железа участвуют в
регуляции метаболизма, главным образом, через взаимодействие с
железочувствительными элементами.
В настоящее время внимание исследователей
сосредоточено на биологических эффектах продуктов гемоксигеназной реакции,
потенциально выполняющих антиоксидантные, противовоспалительные и
антиапоптозные функции [9].
3. Регуляция активности
гемоксигеназы
За исключением некоторых органов и тканей
(прежде всего клеток головного мозга, эндотелиальных клеток и клеток
селезенки), в норме гемоксигеназная активность обеспечивается функционированием
ГО-2 [50].
Усиление синтеза ГО-1 является общим ответом
биологической системы на действие стресса. Такой ответ на стресс наблюдается
среди большинства исследованных тканей у большинства высших организмов: человека,
млекопитающих, сумчатых, птиц и рыб [50].
Данные об индукции ГО-1 как о защитной реакции
организма не новы - еще в 1992 году Nath и соавторы доказали, что
фармакологическое угнетение активности ГО-1 приводило к обструкции почечных
канальцев и развитию острой почечной недостаточности из-за избытка гема [40].
Исследования показали, что ГО-1 сильно
индуцируется и проявляет защитные свойства в ответ на окислительный стресс как
in vivo, так и in vitro, действие тяжелых металлов, цитокинов, гема и других
металлопорфиринов, оксида азота и пероксинитрита, эндотоксинов, пирогенов,
ксенобиотиков, арсенита натрия, ультрафиолетового излучения, гипоксии и
гипероксии, и радиационное излучение, перекиси водорода [9, 10, 40, 50].
В настоящее время ГО-1 рассматривается как
стрессорный белок под названием HSP 32 (белок теплового шока), однако ни
аминокислотной гомологии, ни шаперонной активности, свойственных для
представителей данного семейства белков, для ГО-1 не обнаружено [50].
Помимо этого, активация транскрипции при действии
гипертермии характерна не всем исследованным организмам, а лишь представителям
семейства грызунов (РИТТЕР 600 761), у которых при гипертермии наблюдается
накопление ГО-1 и соответствующих и-РНК в печени, сердце и мозге [51].
Другой класс белков стресс-ответа, так
называемых GRP (глюкоза-регулируемые белки), активирующиеся при глюкозном
голодании, также могли бы причислить ГО-1 в состав своего семейства, поскольку
было обнаружено усиление активности данного фермента при пищевом истощении
[52], однако существенного биохимического родства ГО-1 к данному семейству
белков, как и к белкам теплового шока, обнаружено не было.
При действии перекиси водорода индукция ГО-1
наблюдалась в фибробластах человека, доноры NO приводили к индукции ГО-1 в
эндотелиальных клетках аорты свиньи, легочном эпителии овец, в клетках линии
HeLa человека.
Индукция ГО-1 тяжелыми металлами наблюдалась при
действии хлорида кадмия на клетки линии HeLa человека, клетки гепатомы
человека, меланомы мышей, ооцитов хомяков, эмбриональные фибробласты мыши и при
действии хлорида кобальта на эмбриональные фибробласты цыпленка и клетки
гепатомы мыши и человека.
Пути индукции ГО-1 показаны на схеме,
приведенной ниже.
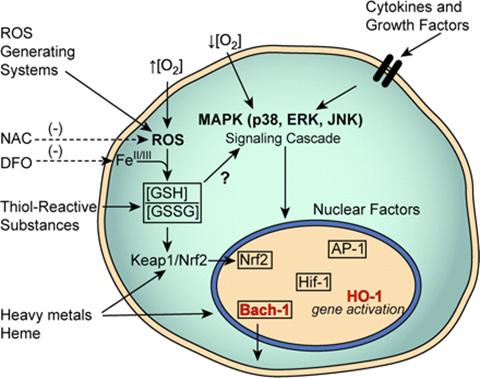
Схема 1 - Сигнальные пути, ведущие к активации
ГО-1
Активация ГО-1 также способствует формированию
защитных реакций при различных патологических состояниях, в том числе и при
заболеваниях сердечно-сосудистой системы.
В регуляции гемоксигеназной активности принимает
участие и оксид азота (NO). Известно, что NO индуцирует экспрессию ГО-1 на
транскрипционном уровне [53]. С другой стороны, были поведены исследования,
показавшие, что оксид азота способен ингибировать активность и ГО-1, и ГО-2
через нитрозилирование гема в активном центре фермента [54, 55].
Несмотря на обширный материал, касающийся
регуляции активности ГО и взаимосвязи гемоксигеназной и NO-синтазной систем
[57], механизмы регуляции гемоксигеназной активности до конца не изучены [58].
4. Биологическое значение
гемоксигеназной системы
Значимость биологической активности ГО-1 и ее
индукции наиболее четко продемонстрирована на примере таких патологических
состояний, как задержка роста, анемия и накопление железа в тканях, которые
наблюдаются у мышей с дефицитом ГО-1. В то время, как большинство мышей,
лишенных гена ГО-2 нормально растут и развиваются, большинство мышей, лишенных
гена ГО-1 характеризуются задержками роста, аномалиями развития и, в основном,
не доживают до взрослого возраста, а те, которые доживают, живут не более 40
недель [40].
В литературе есть сообщения о функционировании
ГО-1 как цитопротекторной молекулы [40, 59].
Ряд исследований свидетельствует в пользу
способности ГО-1 ингибировать апоптоз [59, 60], путем регулирования уровня
внутриклеточного железа, проявляющего сильные прооксидантные свойства. Апоптоз
- общеклеточный ответ на повреждающее действие окислителей, вовлекающий
активные формы кислорода в процесс запрограммированной клеточной гибели [61].и
соавторы [62] связывают цитопротекторное действие ГО-1 также со способностью
фермента снижать концентрацию железа во внутриклеточной среде и объясняют
данный эффект хелатацией железа, согласно другим источникам цитопротекторное
действие ГО-1 обусловлено образованием биливердина и билирубина [1].и коллеги
на фибробластах мышей продемонстрировали, что сверхэкспрессия ГО-1 приводит к
возникновению апоптоза, опосредованного фактором некроза опухоли - то есть к
(TNF)-ά
- зависимому
апоптозу [62].
Антиапоптический эффект ГО-1 не проявляется в
присутствии протопорфирина, специфического ингибитора активности ГО-1. Те же
авторы сообщают [62], что СО также приводит к (TNF)-ά
- индуцированному
апоптозу, не смотря на то, что апоптозпротекторный эффект может быть
опосредован СО эндогенного происхождения.
Антиапоптическое действие ГО-1 требует
дальнейшего детального изучения, возможно, что ГО-1 проявляет различную степень
антиапоптического эффекта в зависимости от вида живых организмов, типа клеток и
особенности действия проапоптического фактора [59].
Недавние исследования показали, что ГО-1
проявляет защитный эффект под действием стимулов и в условиях заболеваний,
особенно в ряде трансплантационных моделей. Обнаружено, что индукция экспрессии
ГО-1 в печени доноров удлиняет выживание трансплантата и улучшает длительность
их функций после увеличенного времени ишемии [9].
Показано, что ГО-1 участвует в защите клеток от
повреждений, вызванных ишемией-реперфузией [40].
Гем функционирует в организме как компонент ряда
важных гемопротеинов или непосредственно участвует в регуляторных процессах
[1]. Накопление свободного гема, в том числе в сосудах и сердечной мышце,
представляет большую опасность, поскольку ведёт к усилению образования активных
форм кислорода (АФК) с последующим повреждением клеток и тканей и развитием
различных патологий [2, 63].
Один из механизмов защиты от прооксидантного
действия гема - связывание и разрушение гема гемоксигеназой (ГО), чем
обусловлена также важная биологическая роль ГО [58].
Однако было бы ошибочно считать экспрессию ГО-1
исключительно позитивным явлением. Усиленная экспрессия ГО-1 при патологических
состояниях, считающихся потенциально повреждающими, оставляют открытым вопрос
относительно функциональной роли данного фермента и его участие в развитии
заболевания.
Известно, что усиление индукции ГО-1
сопровождает острую почечную недостаточность, атеросклероз, ишемию-репефузию,
отторжение трансплантата, болезнь Альцгеймера, сепсис, эндотоксимию, астму,
рак, заболевания эндокринной системы, ретинопатии, повреждения спинного мозга,
желудочные и легочные заболевания, железодефицитную анемию, и ряд других
патологических состояний [40].
Двойственность действия ГО-1 и сложности в
определении диапазонов индукции фермента с позитивным влиянием требуют
дальнейшего изучения и являются перспективным направлением, поскольку могут
дать возможность вмешиваться в патологический процесс при помощи изменений
уровня экспрессии ГО-1, используя генетические или фармакологические методы.
5. Гемоксигеназа и ее роль в
функционировании сердечно-сосудистой системы
Показано, что усиление экспрессии миокардиальных
стрессовых белков и антиоксидантных ферментов, свойствами которых обладает
ГО-1, защищает миокард от постишемических повреждений. К сожалению, механизмы,
лежащие в основе кардиопротекторных эффектов усиления экспрессии и активности
белков теплового шока в условиях ишемии, окончательно не изучены [40].
Кукоба Т. В. и соавторы показали, что
специфическое усиление экспрессии ГО-1 в миокарде трансгенных мышей приводит к
улучшению восстановления функций сердца в реперфузионный период дозозависимо от
уровня экспрессии ГО-1. Авторы также установили, что ГО-1 не только защищает
кардиомиоциты от постишемических повреждений в отсутствии противовоспалительных
клеток (поскольку эксперименты проводились на изолированном сердце), но и
противодействует реперфузионным повреждениям и воспалениям при проведении
экспериментов на сердце in vivo [63].
Однако, в то же время, литературные данные
свидетельствуют о том, что лишь умеренная индукция ГО-1 является позитивной, а
чрезмерная экспрессия (более чем в 10 - 15 раз) может наоборот даже усиливать
повреждения [1, 63].
Известно, что активация ГО является одним из
основных путей образования в организме монооксида углерода, способного
регулировать тонус сосудов и являющегося нейротрансмиттером.
Эффекты СО опосредованы активацией растворимой
гуанилатциклазы при помощи связывания СО с гемовой составляющей данного
фермента и последующим образованием цГМФ, стимуляцией различных типов калиевых
каналов и ингибированием цитохром Р 450-зависимой монооксигеназной системы в
гладкомышечных клетках сосудов [1].
Однако эффекты СО в 50 - 100 раз менее выражены,
чем подобные у NO, также модулирующего расслабление в гладкомышечных клетках
сосудов. Современные исследования показали, что система оксида азота не может
функционировать без присутствия монооксида углерода [1].
Образующийся в реакции монооксид углерода
обладает противовоспалительным эффектом и снижает активность и агрегацию
тромбоцитов благодаря образованию цГМФ [64]. Этот эффект является важным для
сердечно-сосудистой системы свойством.
Регуляция ГО в сердечно-сосудистой системе.
Известно, что острая гипоксия стимулирует увеличение содержания м-РНК ГО-1, а
также повышает содержание самого белка в тканях животных и в культуре клеток.
При этом показано, что в гладкомышечных клетках сосудов при гипоксии индукция
ГО-1 осуществляется на уровне генной транскрипции при помощи белкового фактора,
индуцированного гипоксией - HIF-1, который также регулирует транскрипцию
эритропоетина и эндотелиального фактора роста сосудов.
Однако некоторые исследователи считают, что
индукция ГО-1 в условиях гипоксии осуществляется при участии цитокинов и
фактора Nf-kB через HIF-1 независимые пути.
Установлено, что максимальное содержание м-РНК
ГО-1 в гладкомышечных клетках сосудов наблюдался через 12 часов после гипоксии.
Индукция ГО-1 в ответ на развитие гипоксического стресса была показана и для
эндотелиальных клеток сосудов. Полагают, что индукция ГО-1 в сердце крыс при
остром гипоксическом стрессе может осуществляться через активацию индуцибельной
формы NO-синтазы [74].
Известно, что при подавлении синтеза NO функцию
сосудорасслабляющего фактора выполняет монооксид углерода, главным источником
которого в клетках млекопитающих является гемоксигеназная реакция [1].
В связи с этим, литературные данные
свидетельствуют о повышении ГО-активности в условиях снижения образования NO,
что может быть компенсаторным механизмом для поддержания нормального тонуса
сосудов. Активность ГО в сосудистой стенке может возрастать за счет индукции
гемоксигеназы-1 свободным гемом [58].
Отмечено возрастание активности ГО-1 при ишемии
миокарда, заболеваниях сердечно-сосудистой системы, гипоксичных повреждениях -
однако, как уже говорилось выше, ряд авторов полагает, что нельзя считать это
повышение однозначно положительным явлением [1].
Интересным является тот факт, что в ряде
исследованных тканей экспрессия м-РНК ГО-1 усиливается после короткой
глобальной ишемии, в то время как уровень экспрессии ГО-2 не меняется даже
после длительной ишемии [1].
6. Регуляция активности
гемоксигеназы 1 на уровне генома
Гены ГО. Три исследованные изоформы ГО, являются
продуктами различных генов ho-1 и ho-2, известных также как hmox-1 и hmox-2
[50]. Ген ho-1 у человека, мыши и крысы и ген ho-2 у крысы имеют сходную
организацию и состоят из 5-ти экзонов и 4-х интронов [66]. В описанную
последовательности для гена BVR крысы также входят 5-ть экзонов и 4-е интрона
[48, 50].
Методом флуоресцентной гибридизации in situ была
показана локализация генов ho-1 и ho-2 в различных хроматиновых участках генома
человека: ген ho-1 локализован в локусе 22q12, а ген ho-2 в локусе 16p13.3
[50]. Гены BVάR и BVβR
человека локализованы также в различных хромосомах - в 7-й и 19-й
соответственно [48].
Субклеточная локализация. С момента открытия в
1968 году ферменты ГО-1 считались белками, связанными с эндоплазматическим
ретикулумом благодаря высокой активности ГО в микросомальной фракции. И ГО-1, и
ГО-2 содержат СООН-терминальный гидрофобный доменный сегмент, который
предполагает именно мембранную локализацию [67].
Конститутивная экспрессия кольцевых ДНК ГО-1
крысы в клетках почек обезьяны показала, что экспрессированный продукт был
локализован именно в эндоплазматическом ретикулуме [68].
Недавние исследования показали возможность
функциональной компартментализации ГО-1 и в других субклеточных структурах,
помимо эндоплазматического ретикулума. ГО-1 была обнаружена в ядре и
плазматической мембране. Относительно локализации ГО-1 в ядре имеется все еще
недостаточно информации: последние исследования свидетельствуют, что гем
способен стимулировать ядерную транслокацию ГО-1.
В ядрах клеток NIH3T3 была обнаружена ГО-2,
которая способствует облегчению выхода ГО-1 [69].
Ядерная локализация ГО-1 наблюдалась в
астроглиальных клетках, стимулированных глутаматом [70], При помощи электронной
микроскопии в клетках ретинальной ганглиомы обезьян ГО-2 была обнаружена как в
эндоплазматическом ретикулуме, так и в наружной ядерной мембране [71].
Регуляция транскрипции. ГО-1 индуцируется
гораздо более широким спектром воздействий, чем многие другие ферменты, среди них
гипоксия, гипероксия, гем, тепловой шок, эндотоксины, цитокины, перекись
водорода, тяжелые металлы и доноры NO.
Экспрессия ГО-1 регулируется на транскрипционном
уровне, хотя имеются внутривидовые различия на уровне регуляции ГО-1. Например,
у крыс промотор ГО-1 имеет в своем составе участок, содержащий зависимый от
температуры элемент. При действии теплового шока усиливается связывание
ядерного фактора теплового шока с данным участком промотора гена. В гене ГО-1
человека подобного участка нет [48].
В промоторе ГО-1 обнаружено значительное
количество регуляторных участков, включая сайты связывания для транскрипционных
факторов окислительного стресса, таких как ядерный фактор (NF), который
присутствует в гене человека, и белка - активатора-1 (АР-1) [59], роль которого
в регуляции транскрипции гена ГО-1 была открыта всего несколько лет назад [48,
59].
Одним из наиболее изученных с точки зрения
регуляции транскрипции является ген ГО-1 мыши. Он содержит один проксимальный и
два дистальных энхансера. Первый дистальный энхансер расположен на 4 Кб выше
сайта инициации транскрипции, а другой - на 10 Кб выше [59].
Некоторые факторы - активаторы, среди которых
липополисахариды (ЛПС) требуют наличия дистальных энхансеров для активации
гена, в то время как многие другие факторы, в том числе и факторы,
развивающиеся при действии гипоксии наличия дистальных энхансеров не требуют.
Стабилизация м-РНК. Данные литературы
свидетельствуют об активации экспрессии ГО-1 оксидом азота через
транскрипционный фактор AP-1 (aktivator protein-1) [58]. Другой известный путь
активации фермента этим соединением - повышение стабильности м-РНК
гемоксигеназы-1 [72]. Однако образование нитрозильных комплексов оксида азота с
гемом в активном центре ГО-1 и ГО-2 или в гем-регуляторных участках ГО-2
инактивирует эти изоферменты [58].
Регуляция ГО через взаимодействие с гемом. Как
известно, свободный гем проявляет сильные прооксидантные свойства [21],
которыми обязан, прежде всего, наличию атома железа, способного к изменению
степени окисления. Также встраивание гидрофобной молекулы гема в мембранные
структуры может привести к лабилизации жирнокислотных остатков липидных молекул
и окислению поврежденных мембранных белков.
В нормальных условиях базальный уровень
продукции гемоксигеназы-1 ингибируется фактором транскрипции Bach1 (BTB and CNC
homology 1), а свободный гем активирует синтез ГО-1 посредством дерепрессии
Bach1 [72].
Таким образом, в ответ на агрессивные
прооксидантные проявления гема усиливается и синтез ГО-1. Была показана
способность индуцировать активность ГО-1 гемом для макрофагов человека,
гепатомы мыши и человека, а также для клеток ретинального эпителия человека.
Способность индуцировать активность изоформы
ГО-1 была показана и для металлопорфиринов (кобальт и цинк связывающих: CoPPIX
и ZnPPIX) клеток гепатомы человека [50].
Также отмечена индукция ГО-1 и гемсвязывающих
белков HBP23 рецепторным связыванием комплекса гем-гемопексин [21].
Заключение
Гем функционирует в организме как компонент ряда
важных гемопротеинов или непосредственно участвует в регуляторных процессах
[57]. Накопление свободного гема, в том числе в сосудах и сердечной мышце,
представляет большую опасность, поскольку ведёт к усилению образования активных
форм кислорода с последующим повреждением клеток и развитием сердечно-сосудистых
заболеваний [57].
Один из механизмов защиты от прооксидантного
действия гема - связывание и разрушение гема гемоксигеназой (ГО, КФ 1.14.99.3)
[73].
Конститутивная изоформа ГО-2 определяет скорость
деградации гема в норме. Индуцибельный изофермент ГО-1 играет важную роль в
адаптации клеток и тканей в условиях стресса.
Индукция ГО-1 происходит в ответ на действие
стрессорных факторов различной природы. Общей чертой многих стрессорных
факторов является способность повышать содержание свободного гема в крови с
последующим поступлением его в другие ткани. Учитывая постоянный контакт клеток
сосудистой стенки и сердца с различными компонентами крови, в том числе
и с продуктами гемолиза, функционирование
гемоксигеназы в данной системе имеет большое значение.
Несмотря на все позитивне стороны активации ГО,
исследователи приходять к заключению, что нельзя считать экспрессию ГО-1
исключительно позитивным явлением, поскольку усиленная экспрессия ГО-1 при
патологических состояниях, считающихся потенциально повреждающими, оставляет
открытым вопрос относительно функциональной роли данного фермента и его участии
в развитии заболевания. Известно, что усиление индукции ГО-1 сопровождает
атеросклероз, ишемию-репефузию, гипоксию, сердечно - сосудистые заболевания и
ряд других заболеваний и патологий [40].
Поэтому двойственность действия ГО-1 и сложности
в определении диапазонов индукции фермента с позитивным влиянием требуют
дальнейшего изучения и являются перспективным направлением, поскольку могут
дать возможность вмешиваться в патологический процесс при помощи изменений
уровня экспрессии ГО-1, используя генетические или фармакологические методы, и
применять полученные знания для лечения и коррекции целого ряда заболеваний, в
том числе и заболеваний сердечно-сосудистой системы.
Список литературы
1. Кукоба
Т. В., Мойбенко О.О. Гемоксигеназа та монооксид вуглецю: захист чи пошкодження
клітин? // Фізіол. Журнал. - 2002. - Т.
48, № 5. - С. 79 - 92.
. Smith
M. A., Kutty R. K., Richey P. I., et. al. Heme oxigenase-1 is associated with
the neurofibrillary pathology of Alzheimer’s disease // Amer. J. Pathol. -
1994. - Vol. 145, N 1. - P. 42 - 47.
. Wang
R. Resurgence of carbon monoxide an endogenous gaseous vasorelaxing factor //
Can. J. Pharmacol. - 1998. - Vol. 76, p. 1. - P. 1 - 15.
. Furchgott
R. F., Jothianandan D. Endothelium-dependent and independent vasodilation
involving cyclic GMP^ relaxation induced by nitric oxide, carbon monoxide and
light // Blood. Vessels. - 1991. - Vol. 28, N 1 - 3. - P. 52 - 61.
. Vincent
S. H. Oxidative effects of heme and porphyrins on proteins and lipids // Semin.
Hematolol.
- 1989. - Vol. 26, N 2. - P. 105 - 113.
. Гуляева
Л. Ф., Вавилин В. А., Ляхович В. В. Ферменты биотрансформации ксенобиотиков в
химическом канцерогенезе. - Новосибирск, 2000. - 84 с.
. Зенков
Н. К., Ланкин В. З., Меньщикова Е. Б. Окислительный стресс. Биохимический и
патофизиологический аспекты. - М.: Наука/ Интерпериодика, 2001. - 343 с.
. Владимиров
Ю. А., Азизова О А., Деев А. И. и др. Свободные радикалы в живых системах //
Итоги науки и техники. Сер. Биофизика. - 1991. - Т. 29. - С. 1 - 249.
. Лиу
М., Вэнг Б., Жао К. и др. Индукция гемоксигеназы - 1 улучшает защиту
трансплантанта печени при хранении на холоде // Биохимия. - 2007. - Т. 72, вып.
5. - С. 674 - 681.
10. Maines
M. D. The Heme Oxygenase System; A Regulator of Second Messenger Gases // Annu.
Rev. Pharmacol. Toxicol. - 1997. - Vol. 37. - P. 517 - 554.
. Buelow
R., Tullius S. G., Volk H. D. (2002). Protection of grafts by hemoxygenase-1
and its toxic product carbon monoxide // Am. J. Transplant. - 2002 - Vol. 1, N
4. - P. 313-315.
. Yachie
A., Niida Y., Wada T., et al. Oxidative stress causes enhanced endothelial cell
injury in human heme oxygenase-1 deficiency // J. Clin. Invest. - 1999. - Vol.
103, N 1. - P. 129-135.
. Ishikawa
K. Heme oxygenase-1 against vascular insufficiency: roles of atherosclerotic
disorders // Curr. Pharm. Des. - 2003. Vol 9, N 30. - P. 2489 - 2497.
. McCoubrey
W.K., Ewing J.F., Maines M.D. Human heme oxygenase-2: characterization and
expression of a full-length cDNA and evidence suggesting that the two HO-2
transcripts may differ by choice of polyadenylation signal // Arch. Biochem.
Biophys. - 1992. - Vol. 295, N 1. - P. 13-20.
. Keyse
S. M., Tyrrell A. M. Heme Oxygenase is the major 32 KDa stress protein induced
in human skin fibroblasts of UVA radiation, hydrogen peroxide and sodium
arsenite // Pros. Natl. Acad. Sci. USA - 1989. - Vol. 86. - P. 99 - 103.
. Ozono
R. New biotechnological methods to reduce oxidative stress in the
cardiovascular system: focusing on the Bach1/heme oxygenase-1 pathway // Curr.
Pharmac. Biotech. - 2006. - Vol. 7, N 2. - P. 87-93.
. Kutty
R. K., Kutty G., Rodriguez I. R., et al. Chromosomal localization of the human
heme oxygenase genes: heme oxygenase-1 (HMOX1) maps to chromosome 22q12 and
heme oxygenase-2 (HMOX2) maps to chromosome 16p13.3 // Genomics. - 1994. - Vol.
20, N 3. - P. 513-516.
19. Shibahara
S., Müller R., Taguchi H., Yoshida T. Cloning and expression of c DNA for
rat heme oxygenase // Pros. Natl. Acad. Sci. USA - 1985. - Vol. 82. - P. 7865 -
7869.
. McCoubrey
W. K. Jr., Maines M. D. The structure, organization and differential expression
of the gene encoding and rat heme oxygenase-2 // Pros. Natl.
Acad. Sci. USA - 1985. - Vol. 82. - P. 155 - 161.
. Калиман
П. А., Баранник Т. В. Метаболизм гема и оксидативный стресс // Укр. біохім.
журнал. - 2001. - Т. 73. - С. 5 - 15.
22. Winslow
C. S. Heme A of Cytochrome c Oxidase structure and properties: comparisons with
hemes B, C, and S and derivatives // J. Biol. Chem. -
1975. - Vol. 250, N 19. - P. 7602-7622.
. Мецлер
Д. Биохимия. - М.: Мир, 1980. - В 3-х томах.
24. Hegg
E.L. Heme A Synthase Does Not Incorporate Molecular Oxygen into the Formyl
Group of Heme A // Biochemistry. - 2004. - Vol. 43, N 27. - P. 8616-8624.
. Timkovich
R., Cork M. S., Gennis R. B. Johnson P. Y. Proposed Structure of Heme d, a
Prostetic Group of Bacterial Terminal Oxidases // J. Amer. Chem. Soc. - 1985. -
Vol. 107, N 21. - P. 6069-6075.
. Hardison
R. The Evolution of Hemoglobin Studies: of a very ancient protein suggest that
changes in gene regulation are an important part of the evolutionary story //
Amer. Sci. - 2006. - Vol. 87, N 2. - P. 126.
27. Калиман
П. А., Падалко В. И. // Биохимия. - 1981. - T. 46. - C. 1482 -1486.
. Идельсон
Л. И. Гипохромные анемии. - М., Медицина, 1981.
29. Smith
A., Eskew A. Role of Hemopexin in Human T-Lymphocyte Proliferation // Exp.
Cell. Res. - 1997. - Vol. 232, N 2. - P. 246 - 254.
. Takami
M. Catabolism of heme moiety of hemoglobin.hap toglobin in rat liver cells in
vivo // J. Biol. Chem. - 1993. - Vol. 268. - Vol. 23. - P. 20335 - 20342.
. Gutteridge
J. M., Smith A. Antioxidant protection by haemopexin of haem-stimulated lipid
peroxidation // Biochem. J. - 1988. - Vol. 256, N 3. - P. 861
- 865.
. Гальперин
Э. И., Семяндяева М. И., Неклюдова Е. А. Недостаточность печени. - М.:
Медицина, 1978. - 328 с.
. Алажиль
Д., Одьевр М. Заболевания печени и желчных путей у детей: Пер. с англ. - М.:
Медицина, 1982. - 486 с.
. Блюгер
А. Ф., Новицкий И. Н. Практическая гепатология. -М.:Медицина, 1984. - 405 с.
. Мусил
Я. Основы биохимии патологических процессов: Пер. с чешск. - М.: Медицина,
1985. - 430 с.
. Логинов
А. С., Блок Ю. Е. Хронические гепатиты и циррозы печени. - М.: Медицина, 1987.
- 270 с.
. Хазанов
А. И. Функциональная диагностика болезнй печени. - М.: Медицина, 1988. - 304 с.
. Классификация
и критерии диагностики внутренних болезней. // Под ред. А.
Д.
Куимова.
- Новосибирск,
1995. - с.
107- 114.
. Klinische
Pathophysiologie. - Stuttgert - New York, 1987. - Р.
864 - 900.
40. Кукоба
Т.
В.,
Мойбенко
О.
О.
Гемоксигеназа
та
монооксид
вуглецю:
захист
чи
пошкодження
клітин?
// Фізіол.
журнал.
- 2002. - Т. 48, № 5. - С.
79 - 92.
. Agarval
A., Kim Y., Matas A. J. et al. Gas-generating system in acute renal allograft
rejection in the rat: co-induction of heme oxygenase and nitric oxide synthase
// Transplantation. - 1996. - Vol. 61, N 1. - P. 93 - 98.
. Wang
R. Resurgence of carbon monoxide: an endogenouse vasorelaxing factor// Can. J.
Pharm. - 1998. - Vol. 76, N 1. - P. 1 - 15.
. Graham,
B. L., Mink J. T., Cotton D. J. Effects of increasing carboxyhemoglobin on the
single breath carbon monoxide diffusing capacity // Am. J. Respir. Crit. Care
Med. - 2002. Vol. 165. - P. 1504-1510.
. Ernst
A., Zibrak J. D. Carbon monoxide poisoning // N. Engl. J. Med. - 1998. - Vol.
339, N 22. - P. 8922 - 8931.
. Adamson
J.W. Normal iron physiology. Seminars in Dialysis, 1999; 12: 219-23.
. Bothwell
Т.
Н.,
Charlton R. W., Cook J. D., Finch C. A. Iron metabolism in man. Oxford:
Blackwell Scientific, 1979. - p. 576.
. Stocker
R., Yamamoto Y., McDonagh A. F., et. al. Bilirubin is an antioxidant of
possible physiological importance// Science. - 1987. - Vol. 235. - P. 1043 -
1046. - Abstract.
. Ryter
S. W., Otterbein L. E., Morse D., et. al. Heme oxygenase/carbon monoxide
signaling pathways: regulation and and functional significance // Mol. Cell
Biochem - 2002. - Vol. 234-235. - P. 249 - 263.
. Balla
G., Jacob H. S., Balla J., et al. Ferritin. A cytoprotective antioxidant
strategem of endothelium //J. Biol. Chem. - 1992. - Vol. 37. - P. 18148 -
18153.
. Ryter
S. W., Alam J., Choi A. M. K. Heme oxygenase -1/ Carbon Monoxide: From Basic
Science to Therapeutic Applications // Phisiol. Rev. - 2006. - Vol. 86. - P.
583 - 650.
. Ewing
J. F., Raju V. S., Maines M. D. Induction of heart heme oxygenase - 1 (HSP32)
by hyperthermia: possible role in stress-mediated elevation of cyclic 3’:5’ -
guanosine monophosphate // J. Pharmacol. Exp. Ther. - 1994. - Vol. 271. - P.
408 - 414. - Abstract.
. Chang
S. H., Barbosa-Tessmann I., Chen C., et. al. Glucose deprivation induces heme
oxygenase - 1 gene expression by a pathway independent of the unfold protein
response // J. Biol. Chem - 2002. - Vol. 277. - P. 1933 - 1940.
. Bouton
C., Demple B. Nitric oxide-inducible expression of heme oxygenase-1 in human
cells // J. Biol. Chem. -2000. - Vol. 275, N 42. - P. 32688-32693.
. Jukket
M., Zheng Y., Yuan H. et al. // Ibid. -1998. - Vol. 273, N 36. - P.
23388-233297.
. Ding
Y., McCoubrey W. K., Maines M. D. Interaction of heme oxygenase-2 with nitric
oxide donors. Is the oxygenase an intracellular 'sink' for NO? // Eur. J.
Biochem. - 1999. - Vol. 264. - P. 854-861. - Abstract.
. Mancuso
C., Preziosi P., Grossman A.B., Navarra P. The role of carbon monoxide in the
regulation of neuroendocrine function // Neuroimmunomodulation. - 1997. - Vol.
4. - P. 225-229. - Abstract.
57. Калиман
П. А., Филимоненко В. П., Никитченко И. В. Гемоксигеназная активность в тканях
сосудов и сердца крыс при совместном введении ингибитора NO-синтаз и хлорида
гемина // Укр. біохім. журн. - 2008. - Т. 80, № 2. - С. 128 - 133.
58. Morse
D., Choi A. M. K. Heme oxygenase -1: the “Emerging Molecule” has arrived
//Amer. J. Resp. Cell Mol. Biol. - 2002. - Vol. 27, N 1. - P. 8 - 16.
. Wang,
R., Alam G., Zagariya A., et al. Apoptosis of lung epithelial cells in response
to TNF-alpha requires angiotensin II generation de novo // J. Cell. Physiol. -
2000. - Vol. 185. - P. 253-259.
. Ramos
C., Montano M., Garcia-Alvarez J., et al. Fibroblasts from idiopathic pulmonary
fibrosis and normal lungs differ in growth rate, apoptosis, and tissue
inhibitor of metalloproteinases expression // Am. J. Respir. Cell Mol. Biol. -
2001. - Vol. 24. - P. 591-598.
. Ferris
C. D., Jaffrey S. R., Sawa A. et al. Heme oxygenase -1 prevents cell death by
regulating cellular iron // Nat. Cell Biol. - 1999. - Vol. 1. - P. 152 - 157.
. Petrache
I., Otterbein L. E., Alam J. et al. Heme oxygenase-1 inhibits (TNF)-ά
- indused apoptosis in cultured fibroblasts// Am. J. Phisiol. Lung Cell. Mol.
Physiol. - 2000. - Vol. 278. - P. L312 - L329. - Abstract.
63. Кукоба
Т.
В.,
Мойбенко
О.
О.,
Коцюруба
А.
В.
Кардіопротективна
дія
індукції
гемоксигеназы-1
за
допомогою
геміну
при
ішемії-реперфузії
ізольованого
серця
щура
// Фізіол.
журнал.
- 2003. - Т. 49, № 6. - С.
14 - 21.
. Otterbrien
L. E., Bach F. H., Alam J. et al. Carbon monoxide has anti-inflammatory effects
involving the mitogen-activated protein kinase pathway // Natur. Med. - 2000. -
Vol. 278, Issue 1. - P. C92 - C101.
. Sime
P. J., Xing Z. F. L. , Graham K. G. , Csaky, Gauldie J. Adenovector-mediated
gene transfer of active transforming growth factor- beta1 induces prolonged
severe fibrosis in rat lung // J. Clin. Invest. - 1997. - Vol. 100. - P.
768-776.
. Yoshida
T., Biro P., Cohen T., Müller R.
M., Shibahara S. Human heme oxygenase cDNA and induction of its mRNA by hemin
// Eur. J. Biochem. - 1988. - Vol. 171. - P. 457-461. - Abstract.
. Ishikawa
K., Sato M., Yoshida T. Expression of rat heme oxygenase in Esherichia coli as
a catalytically active, full length form that binds to bacterial membranes //
Eur. J. Biochem. - 1991. - Vol. 202. - P. 161-165.
. Nguyen
X. N., Abate A., Yang G., Weng Y. H., Dennery P. A. / Nuclear translocation of
heme oxygenase-1: a novel signaling pathway (Abstract). // Proc. Int. Conf.
Heme Oxygenase (HO/CO) 2nd Catania, Sicily. - Italy 2002. - p. A52.
. Liu
Z. M., Chen G. G., Ng E. K., Leung W. K., Sung J. J., Chung S. C. Upregulation
of heme oxygenase-1 and p21 confers resistance to apoptosis in human gastric
cancer cells // Oncogene. - 2004. - Vol. 23. - P. 503-513.
. Ma
N., Ding X., Doi M., Izumi N., Semba R. Cellular and subcellular localization
of heme oxygenase-2 in monkey retina // J. Neurocytol. - 2004. - Vol. 33. - P.
407-415. - Abstract.
. Wu
L., Wang R. Carbon monoxide: endogenous production, physiological functions,
and pharmacological applications // Pharmacol. Rev. - 2005. - N 57. - P.
585-630.
. Zenke-Kawasaki
Y., Dohi Y., Katoh Y. et al. Heme Induces Ubiquitination and Degradation of the
Transcription Factor Bach1 // Mol. Cel. Biol. - 2007. - Vol. 27, N 19. - P.
6962-6971. - Abstract.
73. Каліман
П.
А.,
Павиченко
О.
В.
Індукція
гем-оксигенази
в
серці
та
судинах
і
пероксидна
резистентність
еритроцитів
щурів
за
умов
розвитку
гемолітичної
анемії
// Фізіол.
журнал.
- 2005. - Т. 51, № 5. - С.
31 - 35.
Приложения
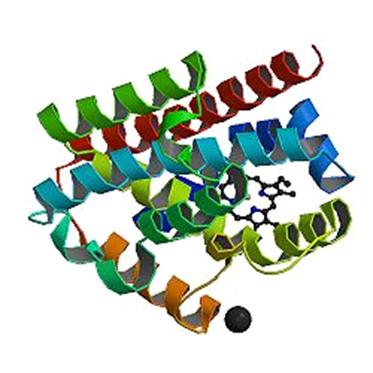
Рис. П1 - Гем-оксигеназа - 1

Рис. П2 - Гем-оксигеназа - 2

Рис. П3 - Структура гемоглобина человека
Зеленым цветом обозначены железосодержащие группы
гема, красным и синим цветом обозначены, соответственно, белковые цепи ά
и
β

Рис. П4 - Структура гема А
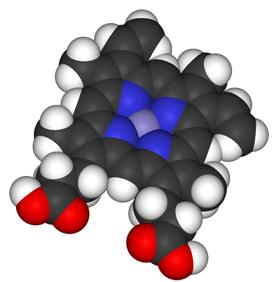

Рис. П5 - Различные пространственные модели гема
В
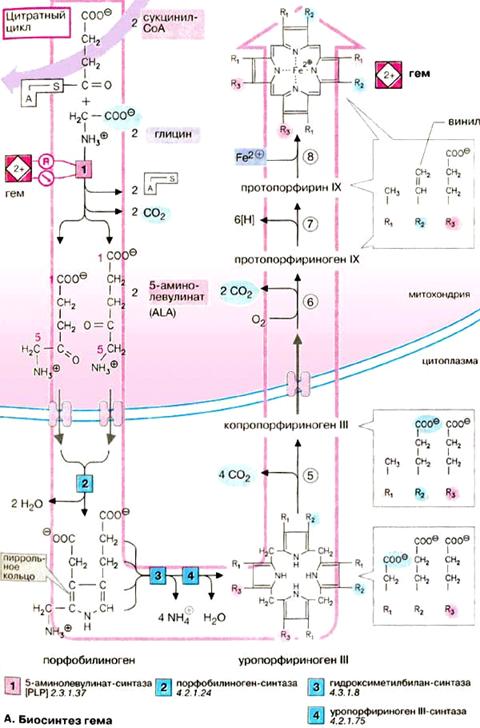
Схема П1 - Биосинтез гема

Схема П2 - Синтез гемма в цитоплазме и
митохондриях