Лабораторный практикум по молекулярной физике
МИНИСТЕРСТВО ВЫСШЕГО И СРЕДНЕГО
СПЕЦИАЛЬНОГО ОБРАЗОВАНИЯ РЕСПУБЛИКИ УЗБЕКИСТАН
САМАРКАНДСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ ИМЕНИ АЛИШЕРА НАВОИ
лабораторный
практикум по молекулярной физике
Рекомендовано к печати
учебно-методическим советом университета
Самарканд - 2009
Лабораторный практикум по молекулярной физике: Методическое пособие.-
Самарканд: Изд-во СамГУ, 2009. 104 с.
Пособие содержит описания 16 лабораторных работ по молекулярной физике и
предназначено для студентов, обучающихся в бакалавриате вузов по направлениям
«5440100-Физика» и «5440300-Астрономия».
Составители: А.А.Якубов,
К.Ф.ХУДОЙНАЗАРОВ, Д.М.МУСТАФАКУЛОВ
Ответственный редактор доктор физико-математических наук,
профессор СамГУ Ф.Х.Тухватуллин
Рецензенты: доктор физико-математических наук,
профессор СамГУ Ф.С.Ганиев,
кандидат физико-математических
наук, доцент СамГАСИ О.А.Абдуллаев
Самаркандский государственный университет им. А.Навои, 2009
Посвящается
светлой памяти
Эльдара Исламова
ВВЕДЕНИЕ В ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Физика наряду с другими естественными науками изучает свойства природы -
свойства окружающего нас материального мира. Предметом ее является изучение
простейших и в то же время наиболее общих форм движения материи.
Процесс познания в физике, как и в других науках, начинается либо с
наблюдения физических явлений в природных условиях, либо с изучения их в
искусственных условиях путем проведения специально поставленных опытов -
экспериментов. Обобщение экспериментальных данных приводит к разработке гипотезы.
Если гипотеза подтверждается новыми наблюдениями и экспериментами, если она не
только правильно объясняет изучаемые явления, но и позволяет на ее основе
правильно предсказать новые явления и новые свойства, она становится физической
теорией. Устанавливаемые теорией связи между физическими величинами становятся
физическими законами. Физический практикум помогает студентам
углублять учебного материала по физике, проверить на опыте важнейших идей и
законов физики, ознакомиться с техникой и методикой физического эксперимента,
выработать навыков самостоятельной исследовательской работы и, прежде всего,
навыков грамотного измерения физических величин, а также математически
обрабатывать результаты эксперимента.
Измерение физических величин и классификация погрешностей
Свойства материальных объектов обычно характеризуются определенными
физическими величинами. Каждой физической величине присуща своя качественная и
количественная определенность. Качественная определенность связана с тем
свойством материи, которое эта величина характеризует. Например, масса тел
характеризует инертные свойства тел. Количественная определенность физической
величины связана с ее численным значением по отношению к однородной с нею
величиной, принятой в качестве меры. Количественная сторона физической величины
определяется в результате измерения.
Измерение представляет собой познавательный процесс,
заключающийся в сравнении физической величины с однородной физической
величиной, принятой за единицу измерения, в результате которого устанавливается,
во сколько раз измеряемая величина больше или меньше соответствующей единицы
измерения. Непосредственно измерять данную величину (прямое измерение)
приходится очень редко. В большинстве случаев производят не прямые измерения
данной физической величины, а косвенные - через величины, связанные с
измеряемой физической величиной определенной функциональной зависимостью.
Измерить физическую величину абсолютно точно
невозможно, так как всякое измерение сопровождается той или иной ошибкой или
погрешностью. Разность между измеренным и истинным значениями физической
величины называется погрешностью (ошибкой) измерения. Погрешности или ошибки
измерений бывают систематические, случайные и промахи.
Систематической называют такую погрешность, которая
остается постоянной или закономерно изменяется при повторных измерениях. Такие
погрешности происходят от несовершенства измерительных приборов, неточности
метода исследования, каких-либо упущений экспериментатора, а также при
применении для вычислений неточных формул, округленных констант.
Систематические погрешности обычно дают отклонение
результата от истинного значения только в одну сторону (или в сторону
увеличения, или в сторону уменьшения).
Систематических погрешностей можно избежать путем
изучения приборов, которыми пользуются при выполнении работ, полной разработкой
теории опыта, а также введением соответствующих поправок в результат измерений.
Случайные погрешности - погрешности, появление которых
не может быть предупреждено, т.е. случайные погрешности в отличие от
систематических носят субъективный характер и возникают они в результате
действия случайных факторов. Они могут происходить по вине экспериментатора; от
несовершенства зрения, слуха или по другим причинам,- которые заранее нельзя
учесть.
Случайные ошибки могут изменять результаты в обе
стороны, то увеличивая, то уменьшая их.
Исключить при измерениях случайные ошибки невозможно,
но благодаря тому, что к случайным ошибкам можно применить законы теории
вероятности, можно уменьшить влияние этих ошибок на окончательный результат
измерений. Их можно уменьшить за счет многократного повторения измерений. При
этом влияние факторов, приводящих к завышению и к занижению результатов
измерений, может частично компенсироваться.
Промахи или просчеты - это ошибки, возникающие в
результате небрежности отсчета по приборам или неразборчивости в записи их
показаний. Единственное средство устранить их: внимательно сделать повторное
(контрольное) измерение. Эти ошибки в расчет не принимают.
Определение погрешностей при прямых измерениях
Пусть надо измерить некоторую величину. Пусть N1, N2, N3,
..., Nn - результаты отдельных измерений
данной величины, а n - число
отдельных измерений. Среднее арифметическое из этих результатов, т. е.
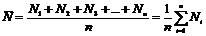 (1)
(1)
есть величина, наиболее близкая к истинному значению,
называемая средним значением измеряемой величины.
Отсюда следует, что каждое физическое измерение должно
быть повторено несколько раз.
Разности
ΔN1, ΔN2, ΔN3, ..., ΔNn
между средним значением  измеряемой величины и значениями N1, N2, N3,
..., Nn, полученными при отдельных измерениях, т. е.
измеряемой величины и значениями N1, N2, N3,
..., Nn, полученными при отдельных измерениях, т. е.

называются
абсолютными ошибками отдельных измерений и могут быть и положительными и отрицательными.
Для
определения средней абсолютной ошибки результата берут среднее арифметическое
абсолютных значений (модулей) отдельных ошибок, т. е.
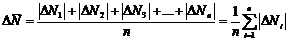 . (2)
. (2)
Отношения
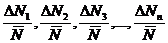 называются относительными ошибками отдельных
измерений.
называются относительными ошибками отдельных
измерений.
Отношение
средней абсолютной ошибки результата 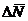 к его
среднему значению
к его
среднему значению  дает среднюю относительную ошибку результата
измерений
дает среднюю относительную ошибку результата
измерений
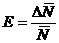 . (3)
. (3)
Относительные ошибки принято выражать в процентах
 .
.
Истинное
значение измеряемой величины
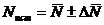 . (4)
. (4)
Не
следует думать, что величина Nист имеет два значения 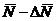 и
и 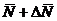 ; Nист имеет только одно значение, а знак «+» или « - »
показывает, что истинное значение измеряемой величины находится в интервале
; Nист имеет только одно значение, а знак «+» или « - »
показывает, что истинное значение измеряемой величины находится в интервале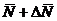 и
и 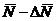 , т.е.
, т.е.  .
.
Теория
вероятностей дает более точную формулу для вычисления абсолютной ошибки результата,
устанавливая понятие так называемой наиболее вероятной ошибки результата ΔNm:
 . (5)
. (5)
В этом случае окончательное значение измеряемой
величины
 . (6)
. (6)
Если точность прибора такова, что при любом числе
измерений получается одно и то же число, лежащее где-то между делениями шкалы,
то приведенный метод оценки погрешности неприменим. В этом случае измерение
производится один раз, и результат измерения записывается так:
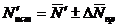 , (7)
, (7)
где
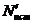 - искомый результат измерения;
- искомый результат измерения; 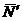 - средний результат, равный среднему арифметическому
из двух значений, соответствующих соседним делениям шкалы, между которыми
заключено остающееся неизвестным истинное значение измеряемой величины; ΔNпр -
предельная погрешность, равная половине цены деления шкалы прибора.
- средний результат, равный среднему арифметическому
из двух значений, соответствующих соседним делениям шкалы, между которыми
заключено остающееся неизвестным истинное значение измеряемой величины; ΔNпр -
предельная погрешность, равная половине цены деления шкалы прибора.
Иногда
положение какого-либо указателя, например мениска столбика ртути в термометре,
трудно различимо в пределах одного деления, равного, допустим, 0,10C.
Тогда за предельную погрешность измерения берется значение всего деления, а не
его половины.
Часто
в работах даются значения некоторых величин, измеренных заранее. В таких
случаях абсолютную погрешность принимают равной ее предельной величине, т. е.
равной половине единицы наименьшего разряда, представленного в числе. Например,
если дана масса тела т = 532,4 г, то Δm = 0,05 г,
следовательно,
т= (532,4±0,05) г.
Определение погрешностей для прямых измерений удобно
производить по следующей таблице:
|
№ измерения
|
Ni
|
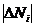 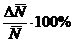 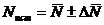 или или 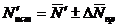
|
|
|
|
1
|
N1
|
ΔN1
|
-
|
-
|
|
2
|
N2
|
ΔN2
|
-
|
-
|
|
…
|
…
|
…
|
-
|
-
|
|
n
|
Nn
|
ΔNn
|
-
|
-
|
|
Среднее значение
|
...
|
...
|
...
|
...
|
Определение погрешностей при косвенных измерениях
В тех случаях, когда физическая величина не может быть
измерена непосредственно, прибегают к косвенным измерениям.
Пусть для нахождения величины N пришлось измерить какие-то величины х, у, z. Пусть величины N, х, у, z связаны функциональной зависимостью N =f (х, у, z).
В
этом случае средняя абсолютная ошибка 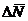 может
быть найдена по правилам дифференцирования, если значок дифференциала d
заменить значком ошибки Δ и выбрать знаки таким образом, чтобы величина ошибки
была максимальной, т. е.
может
быть найдена по правилам дифференцирования, если значок дифференциала d
заменить значком ошибки Δ и выбрать знаки таким образом, чтобы величина ошибки
была максимальной, т. е.
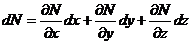 (8)
(8)
и
 .
(9)
.
(9)
В
частном случае, когда N = f (х), формула (9) принимает вид:
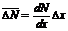 ,
,
т.
е. абсолютная ошибка функции равна абсолютной ошибке аргумента, умноженной на
производную этой функции.
Относительная
ошибка находится по формуле (3), т. е.
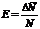 ,
,
а
так как дифференциал натурального логарифма
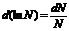 , (10)
, (10)
то
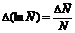
или
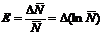 .
(11)
.
(11)
У
Таким образом, относительная ошибка результата равна
полному дифференциалу натурального логарифма функции, определяющей зависимость
данной величины от измеряемых величин. При вычислении надо брать сумму
абсолютных значений дифференциалов всех членов логарифма (все частные ошибки
складываются) с заменой значков d
значком Δ.
Относительную
ошибку измерения 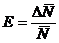 следует вычислять в такой последовательности:
следует вычислять в такой последовательности:
а) прологарифмировать расчетную формулу;
б) найти от логарифма полный дифференциал; если
ошибка отдельных измерений входит в результат дифференцирования несколько раз,
то надо сгруппировать все члены, содержащие одинаковый дифференциал; выражения
в скобках, стоящие перед дифференциалом, взять по модулю;
в) Знак дифференциала d заменить знаком средних конечных приращений Δ.
При этом знаки выбирают
так, чтобы абсолютная величина относительной ошибки была максимальной, т.е. все
знаки минус перед дифференциалами заменяют знаком плюс.
Пример.
При определении отношения теплоемкостёй Ср и СV газа γ методом Клемана и Дезорма расчетная формула имеет
вид: 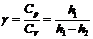 , где h1 и h2 высоты поднятия жидкости в коленах манометра. Надо
найти γист и
, где h1 и h2 высоты поднятия жидкости в коленах манометра. Надо
найти γист и 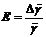 , если
результаты измерения следующие:
, если
результаты измерения следующие:
|
№ измерения
|
h1i
|
Δ h1i
|
h2i
|
Δ h2i
|
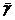 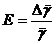 
|
|
|
|
1
|
16,1
|
0
|
4,0
|
0,1
|
|
|
1,34±0,12
|
|
2
|
16,0
|
0,1
|
4,1
|
0
|
|
|
|
|
3
|
16,2
|
0,2
|
4,1
|
0
|
|
|
|
|
4
|
16,1
|
0
|
4,0
|
0,1
|
|
|
|
|
5
|
16,1
|
0
|
4,3
|
0,2
|
|
|
|
|
Среднее значение
|
16,1
|
0,06
|
4,1
|
0,06
|
1,34
|
0,015
|
|
Нахождение всех величин следует проводить следующим
образом:
1. Вычисляют среднее арифметическое
каждой измеряемой величины. В данном случае h1 и h2.
Подставляют
в расчетную формулу найденные средние значения  и
и  и вычисляют среднее значение
и вычисляют среднее значение 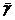 :
:
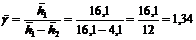 .
.
3. Вычисляют абсолютные ошибки отдельных
измерений |Δh1i| и |Δh2i| и всего измерения |Δh1| и |Δh2|.
4. Выводят формулу для вычисления
относительной ошибки по вышеприведенной схеме. Для этого:
а) логарифмируют расчетную формулу
 ;
;
б)
находят полный дифференциал
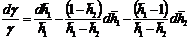 ;
;
в)
группируют все члены, содержащие одинаковый дифференциал, все минусы заменяют
плюсами, берут скобки по модулю и заменяют дифференциалы d на Δ, получают:
 .
.
В
полученную формулу подставляют числовые данные
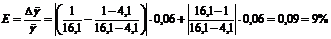 .
.
Вычисляют
абсолютную погрешность  .
.
5. Окончательный результат записывают в
виде:
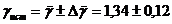 .
.
Вычисления
рекомендуется проводить с помощью калькулятора, производя округления по
правилам приближенных чисел. Необходимо твердо помнить, что точность результата
определяется точностью измерительных приборов и тщательностью исходных
измерений и не может быть повышена в дальнейшем путем искусственного набирания
знаков при производстве арифметических действий.
Графическая обработка результатов измерений
При обработке результатов изменений часто пользуются
графическим методом. Такой метод необходим тогда, когда требуется проследить
зависимость какой-либо физической величины от другой, например y= f(x). Для этого
производят ряд наблюдений искомой величины у для различных значений переменной
величины х. Для наглядности эту зависимость изображают графически.
В большинстве случаев пользуются прямоугольной
системой координат. Значения независимого аргумента х откладывают по оси
абсцисс в произвольно выбранном масштабе, а по оси ординат также в произвольном
масштабе откладывают значения у. Полученные на плоскости точки соединяют между
собой плавной кривой.
Если плавной кривой не получается, следовательно, в
наблюдениях допущены ошибки.
Пользуясь кривой, можно также в пределах произведенных
наблюдений интерполировать, т.е. находить значение величины у для таких
значений х, которые непосредственно не наблюдаются.
Для этого из любой точки оси абсцисс можно провести
ординату до пересечения с кривой; длина такой ординаты будет представлять
значение величины у для соответствующего значения величины х.
Для угловых величин удобнее применять полярную систему
координат.
По графикам можно найти эмпирическую формулу.
Выполнение работы и оформление отчета
Выполнение каждой лабораторной работы проводят по
следующей схеме:
1. Внимательно читают описание
лабораторной работы в данном практикуме.
2. Знакомятся с приборами и
принадлежностями, которые необходимы для проведения работы, и приступают к
установке приборов или сборке установки в соответствии с описанием. Иногда
работа проводиться на готовой установке.
3. Производят наблюдения и отсчеты. Эта
часть работы является наиболее ответственной и ее надо проводить очень
аккуратно и тщательно, согласно указаниям, которые даны в данном практикуме по
каждой работе для измерения и наблюдения данной физической величины. Все
результаты измерений записываются в таблицы записи результатов, которые даны в
конце каждой работы.
4. Обрабатывают результаты измерений:
вычисляют измеряемую величину по формулам и дают оценку погрешностей измерений.
Для оформления отчетов по физическому практикуму
необходимо иметь специальную тетрадь экспериментальной работы.
Заполнение тетради отчета проводят по следующей схеме:
1. Записывают номер и название работы.
2. Дают краткое описание теории метода и
приборов с показом схем приборов и установок (берут из данной работы
физического практикума) и подготавливают таблицу для записи измерений.
3. В таблицу записи измерений вписывают
результаты всех первичных измерений (берут из опытов).
4. По расчетной формуле проводят
вычисления искомой величины.
5. Вычисляют погрешности измерения.
6. При необходимости строят график.
Лабораторная работа № 1
определение отношения удельных теплоемкостей газов методом клемана и
дезорма
Принадлежности: прибор Клемана и Дезорма, ручной насос (или резиновая
груша), осушитель.
Цель работы: ознакомление с изопроцессами в газах, понятиями теплоемкости
газа при постоянном давлении и постоянном объеме, а также экспериментальное
определение отношения СР/СV для
воздуха.
Введение. Величина отношения теплоемкости при постоянном давлении к
теплоемкости при постоянном объеме (γ=Cp/CV=cp/сV) для газов играет важную роль в
теории идеальных газов, так как оно определяет число степеней свободы молекул.
Кроме того, это величина входит в уравнение адиабаты, т.е. она играет очень
большую роль при адиабатических процессах и при процессах, близких к ним. Для
примера укажем, что ею, в частности, определяется скорость распространения
звука в газах, от нее зависит течение газов по трубам со звуковыми скоростями и
достижение сверхзвуковых скоростей в расширяющихся трубах. Роль этой величины
заключается еще и в том, что, зная ее, можно не прибегать к измерениям CV, которые всегда трудны. Значение CV можно получить из измеренных
значений Cp и γ. Часто именно так и поступают.
Теория. Рассмотрим состояние газа с термодинамической точки зрения и
познакомимся с основными термодинамическими процессами в газе.
Термодинамическое состояние газа описывается в основном тремя
параметрами: объемом V,
давлением р и температурой Т. Уравнение, связывающее эти величины, называется
уравнением состояния вещества.
Уравнением состояния идеального газа является уравнение
Клапейрона-Менделеева, которое для одного моля газа имеет вид:
рVμ = RT , (1)
где Vμ - молярный объем, R - универсальная газовая постоянная.
Одним из путей изменения состояния газа является передача теплоты.
Количеством теплоты Q называется мера
изменения внутренней энергии тела, которое происходит при теплопередаче.
Отношение сообщенного телу количества теплоты δQ к вызванному этим процессом
повышению температуры dT
называется теплоемкостью C=δQ/dT. Различают
удельную теплоемкость с - теплоемкость единицы массы вещества, мольную
теплоемкость Сμ - теплоемкость одного моля вещества и т.д. Теплоемкость газов
зависит от температуры и условий нагревания. Принято рассматривать нагревание
газа или при постоянном давлении или при постоянном объеме. В соответствии с
этим для газов вводят понятие о двух теплоемкостях: теплоемкость при постоянном
давлении Ср и теплоемкость при постоянном объеме СV.
Выясним зависимость теплоемкости от условий, при которых производится
нагревание. Для этого воспользуемся уравнением состояния (1) и первым началом
термодинамики, которое можно сформулировать следующим образом: количество
теплоты δQ, переданное системе, затрачивается
на увеличение ее внутренней энергии dU и на работу δA, совершаемую системой против внешних сил:
δQ = dU +δA. (2)
По определению теплоемкости:
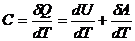 . (3)
. (3)
Из
последнего уравнения видно, что теплоемкость может иметь различные значения в
зависимости от способов нагревания газа, так как одному и тому же значению dT
могут соответствовать различные значения dU и δA. Элементарная
работа δA
равна:
δA= рdV.
Рассмотрим
изо- и другие процессы, протекающие в одном моле идеального газа.. Изотермический
процесс протекает при постоянной температуре (Т=const).
Уравнение состояния: рV=const (Закон Бойля-Мариотта). В этом случае внутренняя
энергия газа, определяемая для 1 моля по формуле  (где i -
число степеней свободы молекул газа), также остается постоянной. Поэтому dU=0
и по формуле (2) δQ= δA, т.о. все
подводимое тепло расходуется на работу.. Изохорический процесс протекает при
V=const. Уравнение состояния: р/Т=const (Закон
Шарля). В этом случае dV= 0 и δA = pdV = 0. Из первого начала термодинамики δQ=dU,
то есть вся подводимая к газу теплота идет на увеличение его внутренней
энергии. Тогда молярная теплоемкость газа при постоянном объеме будет равна:
(где i -
число степеней свободы молекул газа), также остается постоянной. Поэтому dU=0
и по формуле (2) δQ= δA, т.о. все
подводимое тепло расходуется на работу.. Изохорический процесс протекает при
V=const. Уравнение состояния: р/Т=const (Закон
Шарля). В этом случае dV= 0 и δA = pdV = 0. Из первого начала термодинамики δQ=dU,
то есть вся подводимая к газу теплота идет на увеличение его внутренней
энергии. Тогда молярная теплоемкость газа при постоянном объеме будет равна:
 (4)
(4)
или
 .
(4а)
.
(4а)
III. Изобарический процесс - это такой процесс, который протекает при
постоянном давлении (р=const).
Уравнение состояния: V/Т=const (Закон Гей-Люссака). Для этого
случая 1-закон термодинамики запишется в виде δQ = dU + рdV и
молярная теплоемкость будет равна:
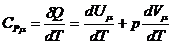 . (5)
. (5)
Из
уравнения газового состояния (1) получаем:
рdVμ + Vμdр = RdT. (6)
Но
р=const и dр=0. Следовательно, рdVμ=R dT. Подставляя это выражение в
уравнение (5) и заменяя dUμ через СVμdT
(согласно (4)), получим окончательно
CPμ = CVμ + R . (7)
Это
важное соотношение называется уравнением Роберта Майера.
Таким
образом, при изобарическом процессе газу нужно сообщить, кроме тепла, идущего
на увеличение внутренней энергии, еще некоторое добавочное количество тепла,
эквивалентное произведенной им внешней работе. Следовательно, Cр>CV.
Используя
(4а), выражение (7) можно записать в виде
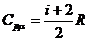 .
(7а)
.
(7а)
IV. Адиабатический процесс - процесс, протекающий без теплообмена с
окружающей средой. Для адиабатического протекания процесса система должна быть
окружена совершенно нетеплопроводными стенками, что практически осуществить
нельзя, то всякий реальный процесс может происходить лишь как более или менее
точное приближение к адиабатическому. Возможно в трех случаях осуществить
процесс, в идеализированных условиях являющийся адиабатическим:
1. Процессы, протекающие в сосуде Дьюара - сосуде с двойными
посеребренными стенками, из пространства между которыми выкачан воздух. В таком
сосуде практически не будет передачи теплоты через стенки. Более грубым
приближением к адиабатическим процессам являются процессы, происходящие в
цилиндрах паровых машин, изолированных асбестовыми листами.
2. Процессы протекающие быстро. Процесс теплопередачи требует
некоторого времени, поэтому при быстром сжатии, например, теплота не успевает
распространиться из данного объема; в течение некоторого времени можно полагать
δQ = 0 и процесс можно рассматривать
как адиабатический. Подобное явление наблюдается при накачивании насосом,
например, велосипедной шины, когда насос сильно нагревается вследствие
адиабатического сжатия воздуха.
. Процессы, протекающие в очень больших объемах газа, например, в
атмосфере. Если в атмосфере произойдет уменьшение давления - разрежение, то
температура понизится. Если разрежение газа и понижение температуры произошло в
объеме нескольких десятков кубических километров, то для выравнивания
температуры передача теплоты должна произойти из соседних более нагретых слоев
воздуха, расположенных на расстояниях нескольких километров, на что требуется
значительное время.
Для адиабатического процесса (δQ=0) первое начало термодинамики будет
иметь вид dUμ + δA = 0 или
δA=-dUμ=-CVμ dT, (8)
т.е. при адиабатическом процессе расширения или сжатия работа совершается
газом только за счет изменения запаса внутренней энергии. Для вывода уравнения
адиабатического процесса, подставим значение δA=рdVμ в выражение (8):
рdVμ = - CVμ dT. (9)
Разделив уравнение (6) на (9) и учитывая (7), получим:
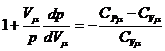 . (10)
. (10)
Введем
обозначение:
 .
(11)
.
(11)
γ называется показателем адиабаты или коэффициентом Пуассона. (Можно
писать 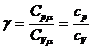 , так как Сμ=с∙μ.
Здесь Срμ, СVμ и ср, сV -
соответственно молярные и удельные теплоемкости при постоянном давлении и при
постоянном объеме, μ
- молярная масса.)
, так как Сμ=с∙μ.
Здесь Срμ, СVμ и ср, сV -
соответственно молярные и удельные теплоемкости при постоянном давлении и при
постоянном объеме, μ
- молярная масса.)
Тогда
(10) перепишется в виде: 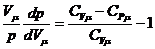 или
или 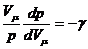 ,
,
откуда
разделяя переменные и интегрируя, получим:

Откуда
 или
или 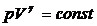 . (12) Выражение (12) есть уравнение
адиабатического процесса, называемое также уравнением или законом Пуассона.
. (12) Выражение (12) есть уравнение
адиабатического процесса, называемое также уравнением или законом Пуассона.
Из
кинетической теории следует (см. выражения (4а) и (7а)), что  ,
, 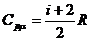 и γ зависит от числа степеней свободы молекул, из которых
состоит газ:
и γ зависит от числа степеней свободы молекул, из которых
состоит газ:
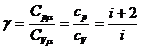 ,
,
где
i - число степеней свободы. Численное значение γ различно для одно-, двух- и трехатомных молекул.
V. Рассмотренные
выше изотермический, изохорический, изобарический и адиабатический процессы
имеют общую особенность - они происходят при постоянной теплоемкости. В
изотермическом процессе (dT=0) теплоемкость равна ±∞, в изохорическом - СV, в
изобарическом - Ср, в адиабатическом (δQ=0)
теплоемкость равна нулю. Процесс, в котором теплоемкость остается постоянной,
называется политропным. Исходя из первого начала термодинамики при условии
постоянства теплоемкости (С=const) можно вывести уравнение политропы:
 ,
,
где
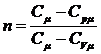 - показатель политропы (
- показатель политропы (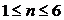 ). Из уравнения политропы получаются уравнения других
изопроцессов: при С=0, n=γ получается уравнение адиабаты; при С=∞, n=1 -
уравнение изотермы; при С=Ср, n=0 - уравнение изобары, при С=СV, n=±∞
- уравнение изохоры. Таким образом, все рассмотренные выше процессы являются
частными случаями политропного процесса.
). Из уравнения политропы получаются уравнения других
изопроцессов: при С=0, n=γ получается уравнение адиабаты; при С=∞, n=1 -
уравнение изотермы; при С=Ср, n=0 - уравнение изобары, при С=СV, n=±∞
- уравнение изохоры. Таким образом, все рассмотренные выше процессы являются
частными случаями политропного процесса.
Показатель
адиабаты (или коэффициент Пуассона) 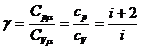 можно
определить экспериментально.
можно
определить экспериментально.
Одним
из методов определения коэффициента γ для воздуха является метод Клемена и Дезорма. Этот метод также называют
методом адиабатического расширения, так как этот метод основан на применении
уравнений адиабатического и изохорического процессов.
Описание
прибора и теория метода. Клеман и Дезорм в 1819 году предложили простой метод
определения отношения теплоемкостей  для
газов. Прибор Клемана и Дезорма состоит из стеклянного сосуда (баллона) А,
соединенного с манометром М и кранами К1 и К2 (рис.1). Сосуд с помощью этих
кранов может присоединяться с атмосферой или ручным воздушным насосом (или
резиновой грушей).
для
газов. Прибор Клемана и Дезорма состоит из стеклянного сосуда (баллона) А,
соединенного с манометром М и кранами К1 и К2 (рис.1). Сосуд с помощью этих
кранов может присоединяться с атмосферой или ручным воздушным насосом (или
резиновой грушей).
Суть
метода состоит в следующем. Пусть первоначально в сосуде было атмосферное
давление. Кран К1 открыт, а кран К2 закрыт. Если с помощью ручного насоса (или
резиновой груши), быстро накачать в сосуд небольшое количество воздуха (во
избежание попадания водяных паров в сосуд, воздух поступает через осушитель О)
и закрыть кран К1, то давление в сосуде повысится; но если это повышение было
произведено достаточно быстро, манометрический столбик не сразу займет
окончательное положение, так как сжатие воздуха было адиабатическим, и,
следовательно, температура его повысилась. (В действительности же нагнетание
воздуха занимает некоторое время, и поэтому процесс этот нельзя считать строго
адиабатическим.) Окончательная разность уровней в манометре (h1)
установится только тогда, когда температура воздуха внутри сосуда сравняется
благодаря теплопроводности стенок с температурой окружающего воздуха. Обозначим
через Т1 абсолютную температуру окружающего воздуха и через р1 - давление газа
внутри сосуда, соответствующее показанию манометра h1; ясно что
 , (13)
, (13)
где
р0 - атмосферное давление (конечно, при этом р0 и h1 должны быть
выражены в одинаковых единицах). Эти два параметра Т1 и р1 характеризуют
состояние газа, которое мы назовем первым состоянием газа (состояние I:
Т1, р1).
Если
теперь быстро открыть кран К2, то воздух в сосуде будет расширяться
адиабатически, пока давление его не сделается равным р0; при этом он охладится
до температуры Т2; это будет вторым состоянием газа (состояние II:
Т2, р0). Если сразу после открывания снова закрыть кран К2, то давление внутри
сосуда начнет возрастать вследствие того, что охладившийся при расширении воздух
в сосуде станет снова нагреваться. Возрастание давления прекратится, когда
температура воздуха в сосуде сравняется с внешней температурой Т1; это будет
третьим состоянием газа (состояние III: Т1, р2). Обозначим давление
воздуха в сосуде в этот момент через р2 и соответствующее показание манометра -
через h2. Ясно, что
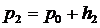 .
(14)
.
(14)
Так
как переход от состояния II к состоянию III произошел без изменения
объема, то мы вправе применить здесь закон Гей-Люссака
 .
(15)
.
(15)
К
процессу адиабатического расширения, т.е. к переходу из состояния I в
состояние II, может быть применен закон Пуассона, который удобно
написать в следующей форме:
 .
.
Подставляя
сюда значение р1 из уравнения (13) и переставляя члены, получим
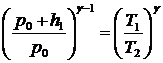
или
 .
.
Так
как h1/p0 и (Т1-Т2)/Т2 - величины малые сравнительно с
единицей, то, разлагая оба двучлена по биному Ньютона и ограничиваясь членами
первого порядка малости, получим
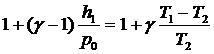 ,
,
откуда
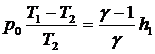 .
.
Но
выражение, стоящее в левой части уравнения, есть не что иное, как h2;
действительно, подставив в уравнение (15) значение р2 из уравнения (14) и
разрешив его относительно h2, получим
 .
.
Следовательно,
можно написать
 ,
,
откуда
окончательно находим
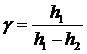 .
(16)
.
(16)
Из
этой формулы видно, что для определения γ достаточно измерить разницу высот уровней жидкости в коленах манометра.
Порядок выполнения работы
1. Закрывают кран К2. Открывают кран К1 (т.е. сосуд А соединяют с
ручным воздушным насосом или с резиновой грушей). С помощью ручного воздушного
насоса (или резиновой груши) нагнетают воздух в сосуд А до тех пор, пока
разность уровней жидкости в коленах манометра М не достигнет значения 10-15 см.
Потом кран К1 закрывают. При накачивании воздух сжимаясь, нагревается;
следовательно, необходимо выждать 2-3 мин., пока благодаря теплообмену
температура в сосуде не станет равной комнатной. После этого измеряют
манометром избыточное давление воздуха h1 (в см водяного столба).
. Открывают кран К2 (т.е. сосуд А соединяют с атмосферой) и когда
уровни жидкости в манометре М выравниваются, быстро закрывают его
(рекомендуется закрывать кран тот час же после прекращения звука, создаваемого
выходящим воздухом). Выждав 2-3 мин, пока газ, охлажденный при адиабатическом
расширении, нагревается до комнатной температуры, измеряют по манометру избыточное
давление h2. Следует помнить, что h1 и h2 отсчитываются как разность уровней жидкости в обоих коленах
U-образного манометра М.
. Опыт следует повторить не менее десяти раз, изменяя в каждом
случае величину h1. Для каждой
пары значений h1 и h2 по формуле (16) определяют величину отношения
теплоемкостей. За истинное значение γ принимают среднее арифметическое.
Находят абсолютные и относительные погрешности эксперимента. Результаты заносят
в таблицу.
|
№ опыта
|
h1, см
|
h2, см
|
γ
|
Dγ
|
(Dγср/ γср)∙100,
%
|
γист= γср± Dγср
|
|
1
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
...
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
|
|
|
Контрольные вопросы
1. Порядок выполнения работы.
2. Изотермический, изохорический, изобарический, адиабатический и
политропные процессы в газах.
. Теплоемкость, удельная и молярная теплоемкость.
. Почему теплоемкость газа зависит от условий нагревания?
. Почему СР>CV
?
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
2. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
. Физический
практикум. Механика и молекулярная физика. / Под ред. проф. В.И.Ивероновой. М.:
Наука, 1967. 352 c.
Лабораторная работа № 2
ОПРЕДЕЛЕНИЕ
СКОРОСТИ ЗВУКА В ГАЗАХ И ОТНОШЕНИЯ УДЕЛЬНЫХ ТЕПЛОЕМКОСТЕЙ ГАЗОВ МЕТОДОМ СТОЯЧЕЙ
ВОЛНЫ
Принадлежности: звуковой генератор, осциллограф, система сообщающихся
сосудов, телефоны.
Цель работы: ознакомление с механизмом образования стоячих волн,
определение скорости звука в воздухе и отношения теплоемкостей методом стоячей
волны.
Введение. Величина отношения теплоемкости при постоянном давлении к
теплоемкости при постоянном объеме (γ=Cp/CV=cp/сV) для газов играет важную роль в
теории идеальных газов, так как оно определяет число степеней свободы молекул.
Кроме того, это величина входит в уравнение адиабаты, т.е. она играет очень
большую роль при адиабатических процессах и при процессах, близких к ним. Для
примера укажем, что ею, в частности, определяется скорость распространения
звука в газах, от нее зависит течение газов по трубам со звуковыми скоростями и
достижение сверхзвуковых скоростей в расширяющихся трубах. Роль этой величины
заключается еще и в том, что, зная ее, можно не прибегать к измерениям CV, которые всегда трудны. Значение CV можно получить из измеренных
значений Cp и γ. Часто именно так и поступают.
Один из самых удобных и точных методов определения γ
основан на измерении
скорости звука в газе.
Теория. См. также теорию лабораторной работы № 1.
Звуком называются механические (упругие) волны, частоты которых лежат в
пределах от 16 до 20000 Гц. Механические волны с частотами ниже 16 Гц называют
инфразвуками, а свыше 20000 Гц - ультразвуками.
Скорость звуковых волн в газах (и жидкостях)
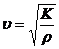 , (1)
, (1)
где
К - модуль объемной упругости среды, ρ - плотность среды.
По
закону Гука для объемной деформации изменение dp давления газа
при малом изменении dV его объема прямо пропорционально относительной
объемной деформации:
 . (2)
. (2)
Для
идеального газа значение К зависит от вида термодинамического процесса сжатия
(расширения) газа. При очень медленном изменении объема газа процесс можно
считать изотермическим, а при очень быстром - адиабатическим. В первом случае pV=const,
так что Vdp+pdV=0 и Кизот=р. Во втором случае pVγ=const, где γ - показатель
адиабаты, так что Кад=γр.
Таким
образом, скорость упругих волн в идеальном газе зависит от их частоты. Это
явление называется дисперсией волн. Возможны следующие два предельных случая.
При очень малой частоте процесс деформации газа близок к изотермическому и
скорость волны
 , (3)
, (3)
а
при большой частоте он близок к адиабатическому и скорость волны
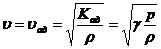 . (4)
. (4)
Опыты
показывают, что скорость звука (слышимых звуковых волн) в газах практически не
зависит от частоты и соответствует формуле (4). Звуковые колебания происходят
настолько быстро, что сжатие и растяжение газа можно считать адиабатическими
(изменение температуры, связанное со сжатиями и разряжениями в звуковой волне,
не успевает выравниваться за период).
Плотность
газа в формуле (4) можно выразить из уравнения Клапейрона-Менделеева как
 , (5)
, (5)
где
m - молярная масса газа, R- универсальная
газовая постоянная, Т - абсолютная температура газа.
Подставляя
это выражение в формулу (4), получим 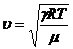 , откуда
, откуда
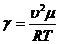 . (6)
. (6)
По
формуле (6) можно определить γ, если
известна скорость звука в воздухе при температуре Т.
В
данной работе скорость звука определяется методом стоячей волны. Стоячие волны
- это волны, образующиеся при наложении двух бегущих волн с одинаковыми
частотами и амплитудами, распространяющихся навстречу друг другу. Возникновение
стоячих волн является частным случаем интерференции волн.
Рассмотрим
образование стоячей волны в цилиндрической трубе с воздухом, закрытой с обоих
концов. Пусть падающая вдоль положительного направления оси х волна 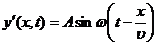 (здесь у - смещение (отклонение от положения
равновесия) частицы среды, х - расстояние частицы среды от источника колебаний,
t - время, А - амплитуда (максимальное смещение), ω=2π/T=2πν=2πυ/λ - циклическая частота, Т - период колебания, ν - частота колебания, υ - скорость волны, λ
- длина волны) отражается от более
плотной среды (в выполняемой работе - от поверхности жидкости - воды). При этом
фаза колебания меняется на противоположную фазу (на p). Отраженная волна
(здесь у - смещение (отклонение от положения
равновесия) частицы среды, х - расстояние частицы среды от источника колебаний,
t - время, А - амплитуда (максимальное смещение), ω=2π/T=2πν=2πυ/λ - циклическая частота, Т - период колебания, ν - частота колебания, υ - скорость волны, λ
- длина волны) отражается от более
плотной среды (в выполняемой работе - от поверхности жидкости - воды). При этом
фаза колебания меняется на противоположную фазу (на p). Отраженная волна 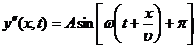 ,
распространяясь в противоположном направлении оси х, интерферирует с падающей
волной. Сложив уравнения падающей и отраженной волн, получим уравнение стоячей
волны:
,
распространяясь в противоположном направлении оси х, интерферирует с падающей
волной. Сложив уравнения падающей и отраженной волн, получим уравнение стоячей
волны:
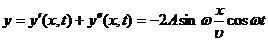 . (7)
. (7)
Из
уравнения стоячей волны (7) вытекает, что в каждой точке этой волны происходят
колебания той же частоты ω
с амплитудой  , зависящей от координаты х рассматриваемой точки.
, зависящей от координаты х рассматриваемой точки.
В
точках среды, где
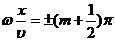 (m=0,
1, 2, ...), (8)
(m=0,
1, 2, ...), (8)
амплитуда
колебаний достигает максимального значения, равного 2А. В точках среды, где
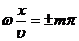 (m=0,
1, 2, ...), (9)
(m=0,
1, 2, ...), (9)
амплитуда
колебаний обращается в нуль. Точки, в которых амплитуда колебаний максимальна
(Аст=2А), называются пучностями стоячей волны, а точки, в которых амплитуда
колебаний равна нулю (Аст=0), называются узлами стоячей волны. Точки среды,
находящиеся в узлах, колебаний не совершают.
Из
выражений (8) и (9) можно получить соответственно координаты пучностей и узлов:
 (m=0,
1, 2, ...), (10)
(m=0,
1, 2, ...), (10)
 (m=0,
1, 2, ...). (11)
(m=0,
1, 2, ...). (11)
Из
формул (10) и (11) следует, что расстояния между двумя соседними пучностями и
двумя соседними узлами одинаковы и равны λ/2.
В
интервале между соседними узлами находятся точки, колеблющиеся с различными
амплитудами, но в одинаковых фазах, т.е. одновременно достигающие максимума. В
смежном интервале характер колебаний такой же, но фаза будет противоположна.
Форма стоячей волны в различные моменты времени («мгновенные фотографии») через
 представлена на рис.1. Точки, лежащие на прямых а1а1,
а2а2, а3а3, а4а4, являются узловыми; точки, лежащие на прямых А1А1, А2А2, А3А3,
А4А4 - пучностями.
представлена на рис.1. Точки, лежащие на прямых а1а1,
а2а2, а3а3, а4а4, являются узловыми; точки, лежащие на прямых А1А1, А2А2, А3А3,
А4А4 - пучностями.
Обычно
стоячие волны возникают при распространении упругих колебаний в телах
ограниченных размеров. Вследствие многократных отражений от границ тела с
окружающей средой падающая волна вызывает множество отраженных волн. В
результате взаимодействия падающей и отраженных волн в теле возникает колебание
очень сложной формы. Если размеры тела таковы, что отраженные волны,
взаимодействуя, усиливают друг друга, то амплитуда результирующего колебания
возрастает - наступает резонанс.
Рассмотрим
условие резонанса колебаний в трубе с воздухом, закрытой с обеих сторон.
Покажем, что если линейная длина столба равна 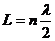 (n -
целое), то в нем возникает резонанс. Действительно, при отражении на одном
конце трубы образуется узел (так как при отражении от более плотной среды,
частицы воздуха, находящиеся рядом с торцовыми поверхностями трубы, смещаться
не могут и лежат, следовательно, в узлах звуковых колебаний). Расстояние между
соседними узлами, как показано выше, равно
(n -
целое), то в нем возникает резонанс. Действительно, при отражении на одном
конце трубы образуется узел (так как при отражении от более плотной среды,
частицы воздуха, находящиеся рядом с торцовыми поверхностями трубы, смещаться
не могут и лежат, следовательно, в узлах звуковых колебаний). Расстояние между
соседними узлами, как показано выше, равно  , а так
как длина столба предполагается равной
, а так
как длина столба предполагается равной 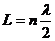 , то и
другой неподвижный конец оказывается в узле. Пусть волна, вышедшая из одного
конца, доходит до другого и отражается с изменением фазы на π. Затем волна идет обратно и снова отражается с
изменением фазы на π.
В результате вторично отраженная волна
имеет такую же фазу, как и падающая (т.е. усиливает падающую волну) (см.
рис.2). Вследствие многократных последующих отражений амплитуда резко
возрастает - наступает резонанс. Из формулы (9) следует, что если изменить
длину резонирующего воздушного столба на величину
, то и
другой неподвижный конец оказывается в узле. Пусть волна, вышедшая из одного
конца, доходит до другого и отражается с изменением фазы на π. Затем волна идет обратно и снова отражается с
изменением фазы на π.
В результате вторично отраженная волна
имеет такую же фазу, как и падающая (т.е. усиливает падающую волну) (см.
рис.2). Вследствие многократных последующих отражений амплитуда резко
возрастает - наступает резонанс. Из формулы (9) следует, что если изменить
длину резонирующего воздушного столба на величину  , то полученный столб также будет резонировать. Таким
образом, наименьшая разность длин двух воздушных столбов, в которых возникает
резонанс, равна
, то полученный столб также будет резонировать. Таким
образом, наименьшая разность длин двух воздушных столбов, в которых возникает
резонанс, равна
 ,
,
откуда
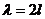 .
(10)
.
(10)
Подбор
резонансных условий может производиться двумя методами. Можно менять частоту
звука и, следовательно, длину звуковой волны в трубе. Другой метод, который и применяется
в настоящей работе, заключается в том, что изменяется длина воздушного столба
при неизменной частоте колебаний. Длина воздушного столба постепенно
увеличивается или уменьшается, и наблюдается ряд последовательных резонансов.
Возникновение резонанса легко наблюдать на осциллографе по резкому увеличению
амплитуды колебаний.
Скорость
распространения волны υ
связана с длиной волны l и частотой колебаний n соотношением  , откуда с учетом (10) получим
, откуда с учетом (10) получим
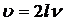 .
(11)
.
(11)
В
данной работе частота задается источником звука - звуковым генератором. Поэтому
скорость звука можно определить, непрерывно уменьшая (или увеличивая) длину
воздушного столба и находя расстояние l между двумя последовательными
резонансами.
Описание
прибора. Прибор для измерения скорости звука изображен на рис. 3. Длинный
цилиндрический сосуд С сообщается с водяным резервуаром ВР при помощи
резинового шланга. К верхнему отверстию сосуда прикреплены телефоны Т1
(динамик) и Т2 (микрофон), один из которых является передатчиком колебаний, а
другой приемником. Телефон Т1 возбуждается генератором звука ГЗ, сигнал
воспринимается телефоном Т2 и подается на осциллограф Ос.
Когда
возбужденный генератором ток протекает через катушки телефонной трубки Т1, ее
мембрана приходит в вынужденные колебания и начинает издавать звук. Воздушные
звуковые волны, распространяясь в сосуде С, отражаются от поверхности воды и
начинают распространяться в обратном направлении. Перемещая уровень воды вверх
либо вниз поднятием или опусканием резервуара с водой ВР (по принципу
сообщающихся сосудов), можно добиться резонанса, т.е. установлению стоячих
волн. Этому соответствует резкое увеличение амплитуды воспринимаемых телефоном
Т2 электрических колебаний, воспроизводимых на экране осциллографа. Измерив
расстояние l, на которое переместится уровень воды в сосуде С при
переходе от одной точки с максимальной амплитудой к следующей, можно найти по
формулам (11) и (6), υ
и γ.
Порядок выполнения работы
1. Включают звуковой генератор. Настраивают его на определенную
частоту (ν1=800 Гц).
2. Включают осциллограф. Находят на экране осциллографа колебания
воздушного столба.
. Опускают вниз резервуар с водой ВР; при этом уровень воды в
сосуде С перемещается вниз. Отмечают по шкале Шк, нанесенной на боковой
поверхности сосуда С, положения уровней воды, при которых наблюдается резонанс
(устанавливаются стоячие волны). Этому соответствует резкое увеличение
амплитуды электрических колебаний, наблюдаемых на экране осциллографа. Далее по
шкале Шк измеряют расстояние l
между соседними отметками.
. Поднимая резервуар с водой ВР вверх, повторяют измерения
величины l при подъеме уровня воды в сосуде С.
. Из всех значений l
находят среднее арифметическое lср.
По формуле (11) рассчитывают скорость звука υ в воздухе.
. Изменив частоту звуковых колебаний звукового генератора (ν2=900 Гц и ν3=1000
Гц), повторяют пункты
4-6.
. Определяют по лабораторному термометру абсолютную температуру Т
воздуха в комнате.
. Подставляя значения скорости звука υ,
молярной массы воздуха m=29×10-3 кг/моль, универсальной газовой
постоянной R=8,31 Дж/(моль∙К) и абсолютной
температуры воздуха Т в формулу (6) рассчитывают значение γ
для воздуха. Находят
среднее значение γ, абсолютные и относительные погрешности эксперимента.
. Результаты заносят в таблицу:
|
№
|
n, Гц
|
lср, м
|
l=2lср, м
|
Т, К
|
γ
|
Dγ
|
(Dγср/ γср)∙100, %
|
γист = γср±Dγср
|
|
1
|
800
|
|
|
|
|
|
|
|
|
|
2
|
900
|
|
|
|
|
|
|
|
|
|
3
|
1000
|
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
|
|
|
Контрольные вопросы
1. Порядок выполнения работы.
2. Механизм образования стоячих волн.
. Почему можно применять уравнение адиабатического процесса к
газу, в котором распространяется волна?
. Уравнение адиабатического процесса. Показатель адиабаты. Число
степеней свободы молекул.
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
2. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
. Физический
практикум. Механика и молекулярная физика. / Под ред. проф. В.И.Ивероновой. М.:
Наука, 1967. 352 c.
Лабораторная работа № 3
ОПРЕДЕЛЕНИЕ
ТЕРМИЧЕСКОГО КОЭФФИЦИЕНТА ДАВЛЕНИЯ ГАЗА ПРИ ПОМОЩИ ГАЗОВОГО ТЕРМОМЕТРА
Принадлежности: газовый термометр, два широких
стеклянных сосуда, термометр.
Цель работы: ознакомление c
газовым термометром, определение термического коэффициента давления воздуха.
Теория. Всякое изменение состояния тела (системы тел) называется
термодинамическим процессом. Физические величины, определяющие состояние тела,
называются термодинамическими параметрами (параметрами состояния).
Изохорическим (изохорным) процессом называется термодинамический процесс,
протекающий при постоянном объеме системы. Изохорный процесс в идеальном газе
описывается законом Шарля: при постоянном объеме давление данной массы газа
прямо пропорционально его температуре:
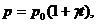 (1)
(1)
или
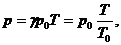 (2)
(2)
где
р0 и р - давление газа при начальной (t=00C или Т0=273,15
К) и конечной температурах,  -
термический коэффициент давления, который характеризует относительное
увеличение давление газа при нагревании его на один градус. Для идеальных газов
γ=(1/273,15)K-1.
В реальных газах γ
зависит от температуры и природы газа.
-
термический коэффициент давления, который характеризует относительное
увеличение давление газа при нагревании его на один градус. Для идеальных газов
γ=(1/273,15)K-1.
В реальных газах γ
зависит от температуры и природы газа.
По
молекулярно-кинетической теории закон Шарля можно объяснить следующим образом.
Нагревание газа увеличивает среднюю скорость молекул. Если замкнутый объем
поддерживать постоянным, то при нагревании молекулы чаще и с большей силой
будут сталкиваться со стенками, и на стенки будет действовать большая сила. При
постоянном объеме происходит увеличение давления, оказываемого газом. Почему
давление увеличивается с температурой линейно? Ключом к ответу является
зависимость средней скорости молекул от квадратного корня из температуры.
Давление возникает вследствие столкновений молекул со стенками, а число
столкновений в секунду возрастает пропорционально скорости молекул. Однако сила
давления на стенку во время столкновения определяется импульсом молекулы,
который также линейно зависит от скорости. Таким образом, как число
столкновений, так и их эффективность увеличиваются с ростом скорости.
Следовательно, можно сделать вывод, что давление возрастает как квадрат средней
скорости и поэтому пропорционально температуре. Эта качественная аргументация
количественно выражается основным уравнением кинетической теории идеальных газов:
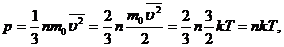
где
р - давление газа, n - число молекул в единице объема, т.е. концентрация, m0 -
масса молекулы, 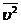 - среднее значение квадрата скорости молекул, k -
постоянная Больцмана, Т - абсолютная температура.
- среднее значение квадрата скорости молекул, k -
постоянная Больцмана, Т - абсолютная температура.
Описание прибора и теория метода. Для определения
температурного коэффициента давления газа применяется газовый термометр
(рис.1), который состоит из стеклянного баллона А, наполненного сухим воздухом;
к баллону припаяна стеклянная капиллярная трубка а и трубка е с краном К. К
концу капилляра а припаяна более широкая трубка в в виде сообщающего сосуда
диаметром 3-5 мм, которая с помощью хлорвиниловой трубки соединена с
резервуаром B. Сообщающиеся сосуды а, в и
резервуар В наполнены ртутью. Все эти части укреплены на вертикальной подставке
L с миллиметровой шкалой С.
Непосредственно у места соединения капилляра а с трубой в нанесена метка n0, положение которой определяется по
шкале С. Поднятием или опусканием резервуара В можно сохранить постоянным объем
газа в сосуде А. Сосуд А погружен в сосуд Б с водой. Спираль Г служит для
нагревания воду в сосуде Б и, следовательно, газа в сосуде А. Температура
задается и поддерживается постоянной контактным термометром КТ и реле. Реле
включается в электрическую сеть через лабораторный трансформатор ЛАТР.
Если газ в сосуде А нагревается от температуры t1 (обычно комнатная) до t2, то по уравнению Клапейрона можно
записать:
 (3)
(3)
где
р1, р2 и V1, V2 - соответственно давление и объем газа в сосуде А
при температурах Т1=273,15+t1 и Т2=273,15+t2.
Так
как T=273,15+t и по закону Шарля γ=(1/273,15)K-1,
то (3) уравнение можно писать в таком виде:
 (4)
(4)
где
γ
- термический коэффициент давления газа.
Полагая,
что объем сосуда А при нагревании изменяется, получим:
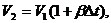 (5)
(5)
где
β
- термический коэффициент объемного
расширения стекла (из которого изготовлен сосуд А), Δt=t2-t1.
Подставим
значение V2 из формулы (5) в формулу (4):
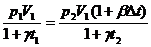 .
.
Преобразуем
полученное равенство, пренебрегая произведением (γβ) ввиду его малости. Имеем
 . (6)
. (6)
Если
учесть объемное расширение ртути, то давление газа в сосуде А при температуре t1
будет
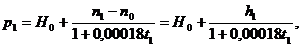
где
0,00018 1/град есть коэффициент объемного расширения ртути, n1-
положение ртутного мениска в трубке в при температуре t1, h1=n1-n0 -
разность обоих уровней, H0 - атмосферное давление. Ввиду малости коэффициента
объемного расширения ртути, можно пренебречь вторым членом знаменателя. Тогда
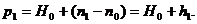 (7)
(7)
Точно
также можно найти давление газа в сосуде А при температуре t2:
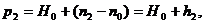 (8)
(8)
где
n2 - положение ртутного мениска в трубке в при
температуре t2, h2=n2-n0 - разность обоих уровней. Подставив (7) и (8) в (6)
получим:
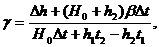 (9)
(9)
где
Δh=h2-h1.
Термический коэффициент давления γ газа определяется по формуле (9).
Порядок выполнения работы
1. Открыв кран К, сосуд А заполняется сухим
воздухом при комнатной температуре и кран К закрывается.
2. Отсчитывают температуру воды в сосуде Б при
помощи термометра КТ, которая и будет начальной температурой t1 воздуха в сосуде А.
3. Перемещая резервуар В, добиваются того, чтобы
ртутный мениск в трубке а совпадал с меткой n0. Положение n0
определяется по шкале С.
. Отсчитывают по шкале С положение вершины
мениска ртути в трубке в - это будет n1. Тогда разность обоих уровней h1= n1-n0.
5. Значение атмосферного давления H0 во время опыта определяется по
лабораторному барометру.
6. Нагревают воду в широком стеклянном сосуде Б
(следовательно воздуха в сосуде А) до температуры 40-500С. При нагревании
воздуха в сосуде А давление воздуха возрастает и уровень ртути в трубке а
начинает опускаться, а в трубке в - подниматься. Спустя 10-12 минут, когда
уровень ртути в трубках а и в перестанет изменяться, поднимают резервуар В до
такого уровня, когда мениск ртути в трубке а будет совпадать с меткой n0. Отсчитывают по шкале С положение
мениска в трубке а - n0 и в
трубке в - n2. Тогда разность обоих уровней h2=n2-n0. После
измерения h2 тотчас же отпускают резервуар В в
нижнее положение.
7. Отсчитывают температуру горячей воды t2 при помощи термометра КТ.
8. Найденные значения t1, h1,
Н0, h2 и t2 подставляют в уравнение (9) и определяют значение γ.
Измерения проводятся несколько
раз при различных температурах. Находят среднее значение γ,
абсолютную и
относительную ошибку.
|
№
|
t1, 0C
|
n0, мм рт. ст.
|
n1, мм рт. ст.
|
h1, мм рт. ст.
|
H0, мм рт. ст.
|
n2, мм рт. ст.
|
h2, мм рт. ст.
|
t2, 0C
|
γ,
1/град
|
Δγ,
1/град
|
(Δγср/γср)∙100, %
|
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
Окончательный
результат написать в виде γ= γср±Δγср.
Примечание
1. Во время опыта к крану К и сосуду А не
прикасаться.
2. Принять значение термического коэффициента
расширения стекла равным β=25∙10-6 град-1.
Контрольные вопросы
1. Законы идеальных газов. Уравнение состояния
идеального газа (уравнение Клапейрона-Менделееева).
2. Физический смысл термического коэффициента
давления.
. Как объясняет молекулярно-кинетическая теория
повышение давления газа при его нагревании?
. Устройство и принцип действия термометров
(газовых, жидкостных и др.).
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
2. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
. Физический
практикум. Механика и молекулярная физика. / Под ред. проф. В.И.Ивероновой. М.:
Наука, 1967. 352 c.
Лабораторная работа № 4
ОПРЕДЕЛЕНИЕ
КОЭФФИЦИЕНТА ВНУТРЕННЕГО ТРЕНИЯ И СРЕДНЕЙ ДЛИНЫ СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ
ВОЗДУХА
Принадлежности: капилляр, водяной манометр, сосуд с
водой, осушитель воздуха, секундомер.
Цель работы: ознакомление с теорией и методом определения коэффициента
внутреннего трения и средней длины свободного пробега молекул газа.
Краткая теория. Явлением внутреннего трения (вязкости) называется
появление сил трения между слоями газа или жидкости, движущимися друг
относительно друга параллельно и с разными по величине скоростями. Явление
внутреннего трения описывается законом Ньютона:
 ,
,
где
F - сила внутреннего трения, 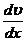 - градиент скорости (изменение скорости движения
слоев на единицу длины в направлении внутренней нормали к поверхности слоя), S -
площадь поверхности слоя. Величина η называется коэффициентом внутреннего трения или (динамическим)
коэффициентом вязкости.
- градиент скорости (изменение скорости движения
слоев на единицу длины в направлении внутренней нормали к поверхности слоя), S -
площадь поверхности слоя. Величина η называется коэффициентом внутреннего трения или (динамическим)
коэффициентом вязкости.
Молекулы
газа имеют конечные размеры и при тепловом движении непрерывно соударяются друг
с другом. Между двумя последовательными соударениями молекулы, двигаясь равномерно
и прямолинейно, проходят некоторые расстояния, называемые длинами свободных
пробегов λ.
Средней длиной свободного пробега  называется среднее расстояние, которое молекула
проходит без столкновения. Она равна:
называется среднее расстояние, которое молекула
проходит без столкновения. Она равна:

где
d - эффективный диаметр молекулы, n -
число молекул в единице объема газа.
Теория
метода и описание прибора. Для измерения коэффициента внутреннего трения можно
воспользоваться методом истечения жидкости или газа через узкую капиллярную
трубку. Объем газа V, протекающего сквозь узкую трубку с круглым
внутренним сечением за время τ, определяется
формулой Пуазейля
 ,
,
где
r - радиус капилляра, l - длина
капилляра, Δp -
разность давлений на концах капилляра. Из этого уравнения коэффициент
внутреннего трения выразится соотношением
 , (1)
, (1)
в
котором все величины правой части доступны непосредственному измерению, а
следовательно им можно воспользоваться для экспериментального определения
коэффициента внутреннего трения.
Для
определения коэффициента внутреннего трения воздуха воспользуемся установкой,
изображенной на рис.1. Когда из сосуда 3 выливается вода, давление в нем
понижается и через капилляр 2 засасывается воздух, проходящий через
осушительный фильтр 1 с СаСl2. Вследствие внутреннего трения давления на концах
капилляра неодинаковы. Разность этих давлений Δp измеряется
водяным манометром 4 (определяется по формуле Δp=ρgΔh, где ρ - плотность
воды, g - ускорение свободного падения, Δh -
разность уровней воды в манометре). Длина l и радиус
капилляра r могут быть измерены непосредственно. Так как объем V
воздуха, прошедшего за время τ (определяется
секундомером) через капилляр, равен объему вылитой из сосуда 3 воды, то V
определяется по шкале, нанесенной на боковой поверхности сосуда 3,
градуированной в литрах (V можно определять также с помощью мензурки 6).
Коэффициент
внутреннего трения связан со средней длиной свободного пробега 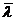 соотношением:
соотношением:
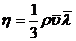 ,
(2)
,
(2)
где
ρ
- плотность газа при данной температуре;  - средняя арифметическая скорость молекул. Известно,
что
- средняя арифметическая скорость молекул. Известно,
что
 (3)
(3)
и
 , (4)
, (4)
где μ - молярная масса газа, р - давление
газа.
Из
формул (2), (3) и (4) следует, что 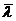 можно
определить по формуле:
можно
определить по формуле:
 . (5)
. (5)
Порядок выполнения работы
1. При измерениях сосуд 3 наполняют
водой. Открывают кран 5 и выжидают несколько минут, пока установится
стационарное течение (при этом разность уровней жидкости Δh в коленах манометра будет
постоянной) и включают секундомер.
2. После того, как вытечет 1-2 литра
воды (V), выключают секундомер и определяют τ.
3. Определяют температуру Т воздуха по
лабораторному термометру.
4. По формуле Δp=ρgΔh определяют Δp. Здесь ρ=1000
кг/м3 - плотность воды, g=9,81 м/с2 - ускорение свободного
падения, Δh -
разность уровней воды в манометре.
По
формулам (1) и (5) определяют η и 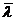 . При этом учитывают, что для используемого в
настоящей работе капилляра l=0,14 м и r=5∙10-4 м, а также для
воздуха μ=0,029
кг/моль. Давление газа р равно
атмосферному давлению, которое находится по лабораторному барометру (при этом
учитывают, что
. При этом учитывают, что для используемого в
настоящей работе капилляра l=0,14 м и r=5∙10-4 м, а также для
воздуха μ=0,029
кг/моль. Давление газа р равно
атмосферному давлению, которое находится по лабораторному барометру (при этом
учитывают, что
1 мм рт.ст.≈133 Па). Находят средние значения
искомых величин, абсолютные (Δ) и относительные (N) погрешности эксперимента.
№ l, м r, м Δh, м Δp, Па τ, с V, м3 η, Па∙с Δη, Па∙с N, % T, К р,
Па 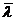 ,
,
мΔ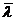 ,
,
мN,
|
%
|
|
|
|
|
1
|
0,14
|
5∙10-4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
|
|
|
|
|
Окончательный
результат написать в виде η= ηср±Δηср и 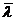 =
= ±
± .
.
Контрольные вопросы
1. Что такое длина свободного пробега?
2. Как
известно, воздух состоит из смеси газов. Что следует понимать под 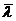 ?
?
3. Почему коэффициент внутреннего трения
жидкостей убывает с увеличением температуры, а у газов - возрастает?
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
2. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
. Физический
практикум. Механика и молекулярная физика. / Под ред. проф. В.И.Ивероновой. М.:
Наука, 1967. 352 c.
Лабораторная работа № 5
ОПРЕДЕЛЕНИЕ
КОЭФФИЦИЕНТА ОБЪЕМНОГО РАСШИРЕНИЯ ЖИДКОСТЕЙ МЕТОДОМ ДЮЛОНГА И ПТИ
Принадлежности: сообщающийся сосуд, оба конца которого заключены в
стеклянные муфты; парообразователь; электроплитка; баллон с водой для
охлаждения одного из колен сосуда; соединительные трубки.
Цель работы: ознакомление с теорией объемного расширения жидкостей и
методом определения коэффициента объемного расширения данной жидкости.
Введение. Явление расширения жидкостей при нагревании в повседневной
жизни имеет широкое практическое применение. Расширение тел при нагревании
используют для создания приборов, измеряющих температуру, т.е. термометров. В
лабораторных, медицинских и бытовых термометрах термометрическим телом является
ртуть или другие жидкости, а термометрической величиной является изменение
объема ртути или других жидкостей с изменением температуры. Явление расширения
жидкостей при нагревании учитывается при расчете системы водяного отопления,
для чего системы труб всегда снабжают расширительным баком, а также при
хранении химических реактивов; во-первых, их хранят в темном прохладном
помещении, во-вторых, сосуды заполняют не полностью, а оставляют немного места,
так как, если жидкость нагревается в замкнутом сосуде, который препятствует ее
расширению, то в ней появляются огромные напряжения (силы давления),
действующие на стенки сосуда и могущие их разрушить.
И вообще, где используется жидкость, всегда учитывается ее объемное
расширение.
Теория. Тепловое расширение жидкостей обусловлено двумя причинами:
. В жидкостях тепловое движение молекул (атомов) состоит из сочетания
колебаний молекул около положений равновесия (как в твердых телах) и
происходящих время от времени скачков молекул из одного положения равновесия в
другое. Повышение температуры означает увеличение энергии колебаний, и,
следовательно, и рост амплитуды этих колебаний. Если бы колебания молекул были
строго гармоническими, то каждая молекула настолько же приближалась бы к одному
из своих соседей, насколько удалялась от другого, и увеличение амплитуды ее
колебаний не привело бы к изменению среднего межмолекулярного расстояния, а
значит, и к тепловому расширению.
В действительности молекулы совершают ангармонические (т.е. не
гармонические) колебания. Это обусловлено характером зависимости сил
взаимодействия между молекулами от расстояния между ними. Зависимость эта
такова, что при больших расстояниях между молекулами силы взаимодействия между
молекулами проявляются как силы притяжения, а при уменьшении этого расстояния
меняют свой знак и становятся силами отталкивания, быстро возрастающими с уменьшением
расстояния. Это приводит к тому, что при возрастании амплитуды колебаний
молекул вследствие нагревания жидкости рост сил отталкивания между молекулами
преобладает над ростом сил притяжения. Другими словами, молекуле «легче»
удалиться от соседа, чем приблизиться к другому. Это, конечно, должно привести
к увеличению среднего расстояния между молекулами, т.е. к увеличению объема
жидкости при его нагревании. Отсюда следует, что причиной теплового расширения
жидкостей (и твердых тел) является ангармоничность колебаний молекул.
. В жидкости существуют «микропустоты» - пространства, где отсутствуют
молекулы. При нагревании жидкости концентрация этих «микропустот» растет, что
приводит к увеличению объема жидкости.
Количественно тепловое расширение жидкостей характеризуется коэффициентом
объемного расширения, которое определяется следующим образом. Пусть жидкость
первоначальным объемом V0 при
температуре t0 при изменении температуры на Δt=t - t0
градусов изменяют свой объем на ΔV=Vt - V0,
где Vt - объем жидкости при температуре t. Коэффициент объемного расширения
определяется из соотношения
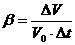 , (1)
, (1)
т.е.
коэффициент объемного расширения равен относительному изменению объема при
изменении температуры на один градус.
Из
этой формулы следует, что объем жидкости Vt при
температуре t определяется формулой
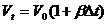 . (2)
. (2)
Коэффициент
объемного расширения уменьшается с повышением давления (которое препятствует
расширению) и растет с повышением температуры. Из закона соответственных
состояний следует, что для всех жидкостей при одинаковых приведенных
температурах коэффициент теплового расширения должен быть одним и тем же.
При
увеличении объема тел их плотность уменьшается во столько раз, во сколько увеличивается
объем (ρ=m/V).
Поэтому из (2) для плотности можно написать
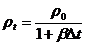 . (3)
. (3)
Описание
метода и прибора. Можно указать следующие методы, применяемые для определения
коэффициента объемного расширения жидкостей:
.
Метод непосредственного измерения увеличения объема жидкости при повышении
температуры.
.
Метод сообщающихся сосудов (применяемый в данной работе).
.
Метод определения плотности жидкости при различных температурах.
При
нагревании какой-либо жидкости мы наблюдаем не истинное ее расширение, а только
кажущееся, так как кроме жидкости расширяется и сам сосуд, в котором находится
данная жидкость. Чтобы определить истинный коэффициент теплового расширения
жидкости, надо учитывать увеличение объема сосуда, для чего необходимо знать
его коэффициент расширения, что усложняет задачу. Расширение сосудов можно не
учитывать в методе сообщающихся сосудов.
В
данной работе используется классический способ определения коэффициента
объемного расширения, предложенный Дюлонгом и Пти и усовершенствованный Реньо.
Метод основан на использовании равновесия двух столбов жидкости в сообщающихся
сосудах, когда жидкости в них имеют различную температуру. В этом случае высоты
столбов обратно пропорциональны плотностям жидкости в них.
Схема
прибора показана на рис.1. Исследуемая жидкость заполняет трубку АСВ, которой
придана показанная на рисунке форма. Оба вертикальных колена трубки помещаются
в термостаты В2 и В1, представляющие собой сосуды, через которые пропускается
вода с заданной температурой. С помощью этих сосудов - «рубашек»
устанавливается требуемая разность температур в обоих коленах трубки.
На
рис.1, как это видно из разности уровней, правое колено более холодное, чем
левое. Благодаря этому плотности жидкости в правом (холодном) ρ1 и левом (горячем) ρ2 коленах будут различными и высота столбов жидкости h1 и h2 в
этих коленах становятся не равными. В этом случае имеет место соотношение:
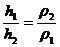 . (4)
. (4)
Пусть
плотность жидкости при температуре 0 0С - ρ0, тогда из (3):
 ;
;  ,
,
где
t1 и t2 - температуры жидкости в правом (холодном) и левом
(горячем) коленах. Подставляя эти значения плотностей в уравнение (4), получаем
следующее соотношение между температурами и высотами столбов жидкости в
сообщающихся сосудах:
 ,
,
откуда
для β
получается выражение:
 . (5)
. (5)
Так
как давление столба жидкости не зависит от его диаметра, а только от его высоты
и от плотности жидкости, то поправку на тепловое расширение материала трубки
можно не вводить.
Порядок выполнения работы
1. По термостату В1 пропускают поток воды с постоянной (комнатной)
температурой t1.
2. Включают электроплитку, нагревают воду в парообразователе и
пропускают водяной пар по термостату В2.
3. Температуру
водяного пара t2 определяют по таблице зависимости температуры
кипения воды от давления, для чего по лабораторному барометру определяют
давление атмосферы Натм (Эту температуру можно найти и по формуле 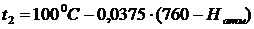 ).
).
. После
того как разность высот жидкостей в коленах А и В достигнет некоторой величины
и перестанет изменяться, не включая электроплитку, измеряют высоты жидкости h2 и h1 в
коленах А и В, непосредственным отсчетом по шкале прибора.
. По
найденным значениям t1, t2, h1 и h2, определяют коэффициент объемного расширения
исследуемой жидкости по формуле (5).
. Опыт
повторяют не менее 3-х раз. Находят βср и ошибки измерений.
. Полученные
данные записывают в таблицу.
|
№
|
t1 (0C)
|
t2 (0C)
|
h1 (см)
|
h2 (см)
|
β
(град-1)
|
Δβ
(град-1)
|
(Δβср/ βср)∙100 (%)
|
|
1
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
. Окончательный результат записывают в виде β=
βср± Δβср.
Контрольные вопросы
1. Порядок выполнения работы.
2. Почему жидкости при нагревании расширяются?
. Каков физический смысл коэффициента объемного расширения?
. Зависит ли коэффициент объемного расширения от температуры?
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
2. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
Лабораторная работа № 6
ОПРЕДЕЛЕНИЕ
КОЭФФИЦИЕНТА ВНУТРЕННЕГО ТРЕНИЯ ЖИДКОСТЕЙ МЕТОДОМ СТОКСА
Принадлежности: стеклянный цилиндр, масштабная
линейка, секундомер, шарики, штангенциркуль.
Цель работы: ознакомление методом определения
коэффициента внутреннего трения (вязкости) жидкостей.
Краткая теория. Явлением внутреннего трения (вязкости)
называется появление сил трения между слоями газа или жидкости, движущимися
друг относительно друга параллельно и с разными по величине скоростями.
Опыт
показал, что сила внутреннего трения F пропорциональна величине
площади соприкосновения движущихся слоев S и градиенту
скорости 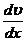 (градиентом скорости называется изменение скорости υ на единицу длины х в направлении, перпендикулярном
направлению движения слоев (рис. 1)) (Закон Ньютона):
(градиентом скорости называется изменение скорости υ на единицу длины х в направлении, перпендикулярном
направлению движения слоев (рис. 1)) (Закон Ньютона):
 .
(1)
.
(1)
Коэффициент
пропорциональности h называется коэффициентом внутреннего трения (или
вязкости). Коэффициент вязкости есть физическая величина, численно равная силе
внутреннего трения, которую испытывает единица поверхности одного из
взаимодействующих слоев со стороны другого слоя, если градиент скорости между
слоями равен единице. В системе СИ: 
Описание метода и прибора. Коэффициент вязкости может
быть определён методом падающего шарика в вязкой среде - методом Стокса. На
шарик, свободно падающий в вязкой жидкости, действуют:
1. Сила тяжести:
 ,
(2)
,
(2)
где r -
радиус шарика; rш - плотность шарика; g -
ускорение свободного падения.
2. Выталкивающая сила (сила Архимеда):
 , (3)
, (3)
где rж - плотность жидкости.
3. Сила сопротивления движению, обусловленная
силами внутреннего трения между слоями жидкости (сила Стокса):
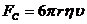 , (4)
, (4)
где υ - скорость шарика.
Подчёркиваем, что здесь играет роль не трение шарика о
жидкость, а трение отдельных слоев жидкости друг о друга, так как при
соприкосновении твёрдого тела с жидкостью к поверхности тела тот час же
прилипают молекулы жидкости. Тело обволакивается слоями жидкости и связано с
ними молекулярными силами. Непосредственно прилегающий к телу слой жидкости
движется вместе с телом со скоростью движения тела. Этот слой увлекает в своём
движении соседние слои жидкости, которые на некоторый период времени приходят в
плавное движение (если малые скорости и малые шарики). Направление этих сил
показано на рис. 2.
Равнодействующая сил, действующих на шарик:
R = Fтяж -
(FA + FC ). (5)
Вначале скорость движения шарика будет возрастать, но
так как по мере увеличения скорости шарика сила сопротивления будет возрастать,
то наступит тот момент, когда сила тяжести будет уравновешена суммой сил FС и FA, равнодействующая сила R станет равной нулю, т.е.
тяж - (FA + FC) = 0. (6)
С этого момента движение шарика становится равномерным
с какой-то скоростью υ=const.
Подставляя в (6) значение Fтяж, FC, FA, получим для коэффициента вязкости
выражение
 . (7)
. (7)
Экспериментальная установка состоит из стеклянного
цилиндра, наполненного исследуемой жидкостью (см. рис.2). На цилиндр нанесены
две горизонтальные метки, расположенные друг от друга на расстоянии l (верхняя
метка должна быть ниже уровня жидкости на 5-6 см).
Измерения и
обработка результатов измерения
1. Плотности шарика и исследуемой жидкости берут
из справочных таблиц. Примечания: 1. Если плотности шариков невозможно найти из
справочных таблиц по причине неизвестности материалов шариков, то необходимо
найти плотности шариков по формуле ρ=m/V, где m -
масса шарика (находится взвешиванием шарика), V - объем шарика (находится по формуле V=πd3/6 или V=4πr3/3, здесь d - диаметр шарика, r - радиус шарика). 2. В стеклянном цилиндрическом сосуде в качестве
исследуемой жидкости находится машинное масло. Плотность его равна ρ=900
кг/м3.
. Определить радиус r шарика штангенциркулем.
. Масштабной линейкой измерить расстояние l
между метками, нанесенными на цилиндре.
. Опустить шарик в жидкость как можно ближе к
оси цилиндра. Глаз наблюдателя должен быть установлен прямо против верхней
метки. В момент прохождения шариком верхней метки запустить секундомер и
остановить его, когда шарик достигнет нижней метки. Отсчёт по секундомеру даст
время t прохождения шариком пути.
. Определить скорость шарика по формуле υ=l/t.
. По формуле (7) определить значение
коэффициента внутреннего трения исследуемой жидкости.
. Опыт повторить для 2-3 шариков. Определить среднее
значение η, абсолютные и относительные погрешности эксперимента.
Полученные результаты занести в таблицу отсчёта.
|
№
|
ρш, кг/м3
|
ρж, кг/м3
|
r, м
|
l, м
|
t, с
|
υ, м/с
|
h, Па∙с
|
Dh, Па∙с
|
(Δhср/hср)∙100, %
|
|
1
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
8. Окончательный
результат записать в виде η=ηср±Δηср.
Контрольные вопросы
1. Физический смысл коэффициента вязкости.
2. В чём заключается метод данной работы? Опишите
силы, действующие на шарик в жидкости.
. Почему секундомер пускают в ход не в момент
опускания шарика в жидкость, а позже?
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
2. Физический
практикум. Механика и молекулярная физика. / Под ред. проф. В.И.Ивероновой. М.:
Наука, 1967. 352 c.
Лабораторная работа № 7
ОПРЕДЕЛЕНИЕ
КОЭФФИЦИЕНТА ВНУТРЕННЕГО ТРЕНИЯ ЖИДКОСТЕЙ КАПИЛЛЯРНЫМ ВИСКОЗИМЕТРОМ
Принадлежности: установка с капиллярным вискозиметром,
пипетка, пикнометр, секундомер, эталонная и исследуемые жидкости, термометр.
Цель работы: ознакомление методом определения
коэффициента внутреннего трения (вязкости) жидкостей.
Краткая теория. Явлением внутреннего трения (вязкости)
называется появление сил трения между слоями газа или жидкости, движущимися
друг относительно друга параллельно и с разными по величине скоростями. Явление
внутреннего трения описывается законом Ньютона:
 ,
,
где
F - сила внутреннего трения, S - площадь
поверхности слоя, 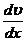 - градиент скорости - изменение скорости движения
слоев на единицу длины в направлении, перпендикулярном направлению движения
слоев.
- градиент скорости - изменение скорости движения
слоев на единицу длины в направлении, перпендикулярном направлению движения
слоев.
Величина
η
называется коэффициентом внутреннего
трения или (динамическим) коэффициентом вязкости. Коэффициент вязкости есть
физическая величина, численно равная силе внутреннего трения, которую
испытывает единица поверхности одного из взаимодействующих слоев со стороны
другого слоя, если градиент скорости между слоями равен единице. В системе СИ: 
Теория
метода. Для определения коэффициента вязкости жидкости используется закон
Пуазейля для ламинарного течения по трубам (капиллярам):
 , (1)
, (1)
где
V - объем жидкости, протекающий за время t
через трубу, r - радиус трубы, Δp - разность
давлений на концах трубы, l - длина трубы, η - коэффициент вязкости жидкости.
Пользуясь
этим выражением, зная величины V, r, l и Δp, можно определить коэффициент вязкости η жидкости.
Однако
удобнее пользоваться формулой Пуазейля для определения относительного
коэффициента вязкости. В самом деле, если взять две жидкости (соответствующие
величины для одной из них отметим знаком 0 и другой - 1) и измерить времена t0 и t1
истечения одинаковых объемов V этих жидкостей через один и тот же капилляр
(одинаковые r и l), то будем иметь согласно формуле (1):
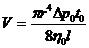 и
и 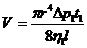 .
.
Разделив
второе уравнение на первое, получим
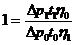 или
или 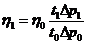 . (2)
. (2)
Если
жидкость вытекает под действием силы тяжести, то Δp1/Δp0 = ρ1/ρ0, где ρ0 и ρ1- плотности жидкостей, и соотношение (2) можно написать
в виде
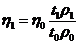 . (3)
. (3)
Таким
образом, зная времена истечения взятых жидкостей t1 и t0 и
их плотности ρ0 и ρ1, можно
определить относительный коэффициент внутреннего трения 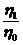 , а найдя из таблиц значения η0 вычислить и абсолютную величину η1.
, а найдя из таблиц значения η0 вычислить и абсолютную величину η1.
Описание
прибора. Применяемый в этой работе капиллярный вискозиметр представляет собой U-образную
стеклянную трубку abecd (рис. 1), широкое колено ab которой
заканчивается внизу расширением b, а другое колено состоит из капилляра е,
заканчивающегося наверху расширением с, который переходит в более широкую
трубку d. Под расширением с и над ним в трубках d и e
нанесены две метки т и п, ограничивающие вполне определенный объем жидкости,
время истечения которого измеряется при опыте.
Капиллярный
вискозиметр закрепляют в зажимах К на штативе S и опускают в
стакан G с водой так, чтобы уровень воды был выше верхней
метки т; вискозиметр должен быть установлен вертикально, что проверяют при
помощи отвеса. В стакан G опускают также термометр T и мешалку M.
Измерения.
Вискозиметр сначала хорошо прополаскивают водой, а затем небольшим количеством
исследуемой жидкости. После этого, установив вискозиметр по отвесу, выпускают
при помощи пипетки в широкое колено аb определенный, постоянный при
всех опытах объем исследуемой жидкости. Далее осторожно всасывают жидкость (с
помощью груши, водоструйного насоса или иным способом) через резиновую трубку f,
надетую на трубку d, и наполняют расширение с выше метки т. Отпустив
трубку, наблюдают истечение жидкости и пускают в ход секундомер в тот момент,
когда мениск проходит через метку т, а в момент, когда мениск проходит через
метку п, останавливают секундомер. Таких наблюдений производят несколько. Так
определится время t истечения исследуемой жидкости, помещающейся в
расширении с. После этого проделывают тот же опыт с водой и для нее также
определяют время истечения t0.
Вслед
за этим по справочным таблицам определяют плотность ρ исследуемой жидкости, плотность ρ0 и коэффициент внутреннего трения η0 воды (при той же температуре, при которой измерялось
время истечения).
Искомый
коэффициент трения η вычисляется по формуле (3)
 .
.
Результаты
заносят в таблицу:
|
№
|
t, с
|
t0, с
|
ρ,
кг/м3
|
ρ0,
кг/м3
|
η0,
Па∙с
|
η,
Па∙с
|
Δη,
Па∙с
|
(Δηср/ ηср)∙100, %
|
|
1
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
Окончательный
результат представляют в виде η= ηср± Δηср.
Контрольные вопросы
. Явление внутреннего трения. Закон Ньютона для внутреннего трения.
. Почему коэффициент внутреннего трения жидкости убывает с увеличением
температуры, а газов - возрастает?
. Уравнение Френкеля-Андраде для коэффициента вязкости жидкости.
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
. Физический
практикум. Механика и молекулярная физика. / Под ред. проф. В.И.Ивероновой. М.:
Наука, 1967. 352 c.
Лабораторная работа № 8
ОПРЕДЕЛЕНИЕ
КОЭФФИЦИЕНТА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ЖИДКОСТЕЙ МЕТОДОМ ОТРЫВА КАПЕЛЬ
Принадлежности: две одинаковые бюретки с кранами, два сосуда для слива
жидкостей из бюреток, воронка, эталонная и исследуемая жидкости.
Цель работы: ознакомление с явлением поверхностного натяжения,
молекулярной природой этого явления и одним из методов определения коэффициента
поверхностного натяжения, а также практическое определение этого коэффициента
для одной жидкости.
Введение. Поверхностное натяжение - одно из наиболее распространенных
явлений в природе. Его изучение имеет большое значение не только для физики, но
и для химии, молекулярной биологии, медицины. Определяя коэффициент поверхностного
натяжения, можно различать изомеры одной и той же жидкости, контролировать
качество расплавленного металла, ставить диагноз больным, можно определять
молекулярную массу жидкостей, неизвестную концентрацию в растворах, а также
степень чистоты жидкостей. Явление капиллярности, смачиваемость и
несмачиваемость жидкостей, скорость распространения акустических волн,
растворимость растворов также непосредственно связаны с поверхностным
натяжением жидкостей. Особенности теплового движения в поверхностных слоях
обусловливают адсорбционные явления, при которых изменяется химический состав
поверхностного слоя. Адсорбционные слои могут резко повышать устойчивость
эмульсий, пен, суспензий. Явления в поверхностных слоях приводят к рассеянию
света этими слоями, определяют долговечность материалов и конструкций в данной
среде, обуславливают процессы выветривания горных пород и почвообразования,
испарения и конденсации влаги, а также многие процессы в живых организмах.
Таким образом, изучение поверхностных явлений имеет большое значение во
многих отраслях науки и техники.
Теория. Наиболее характерным свойством жидкого состояния вещества
является наличие резкой границы, разделяющей жидкость и ее пар (который может
быть смешан и с другими газами). Поверхностный слой жидкости, представляющий
переход от жидкости к пару, отличается особыми свойствами.
Сравним состояния молекулы В, находящейся в поверхностном слое и молекулы
А, находящейся внутри жидкости (рис.1). Поскольку молекулы в жидкости
расположены с равномерной плотностью, то равнодействующая молекулярных сил,
действующих на А, равна нулю. Поэтому молекулы в жидкости, хотя и притягиваются
ко всем соседним молекулам, но не испытывают никаких специфических перемещений
под влиянием этих сил.
Иначе обстоит дело с молекулой В. Сфера молекулярного действия, как видно
из рис.1, лишь частично окажется внутри жидкости, часть же ее будет лежать вне
жидкости. Над ее поверхностью находится вещество в газообразном состоянии,
например пар данной жидкости. Концентрация молекул в паре мала, поэтому их
действием можно пренебречь. Следовательно, на молекулу В действуют лишь
молекулы, лежащие в той части сферы действия, которая расположена внутри
жидкости. Силы, с которыми они действуют на молекулу В, в среднем не будут
компенсированы; возникает результирующая сила F, направленная внутрь жидкости.
Таким образом, на каждую молекулу, лежащую от поверхности жидкости на
расстоянии, меньшем радиуса молекулярного действия, действуют силы,
направленные нормально к поверхности внутрь жидкости. Поверхностный слой
оказывает на всю жидкость давление, называемое внутренним или молекулярным
давлением, которое по природе аналогично добавочному давлению в реальных газах,
обусловливающему поправку в уравнении Ван-дер-Ваальса.
Под действием результирующей силы F, действующей на поверхностные молекулы, последние
погружаются в жидкость. Вследствие теплового движения небольшая часть молекул
вновь выходит на поверхность. Втягивание молекул внутрь происходит с большей
скоростью, чем движение молекул к поверхности. Число молекул в поверхностном
слое будет непрерывно уменьшаться. Поверхность жидкости будет сокращаться до
тех пор, пока не наступит динамическое равновесие, т.е. количество молекул,
уходящих из поверхностного слоя и возвращающегося в него за одно и то же время,
будет одинаковым. Таким образом, при отсутствии внешних сил, например, силы
тяжести, поверхность жидкости принимает наименьшее значение, возможное при
данном объеме, а именно - форму шара.
Для увеличения поверхности необходимо совершить работу, которая
затрачивается на вывод молекул из глубины на поверхность жидкости.
Очевидно,
для изменения поверхности жидкости на величину ΔS нужно
совершить работу, равную ΔА = σ ΔS, откуда  . Т.е. при ΔS=1, σ= ΔА.
. Т.е. при ΔS=1, σ= ΔА.
Эта
работа вызывает приращение поверхностной энергии ΔW пленки,
которая называется свободной энергией поверхности, так как при сокращении
поверхности жидкости она подобно потенциальной энергии переходит в другие формы
энергии или тратится на работу перемещения жидкости, т.е. ΔW = ΔA. Тогда
ΔW = σ·ΔS, (1)
где
коэффициент пропорциональности σ называется
коэффициентом поверхностного натяжения жидкости или просто поверхностным
натяжением. Отсюда σ=ΔW/ΔS. Таким
образом, поверхностное натяжение можно определить как свободную поверхностную
энергию жидкости, приходящуюся на единицу площади ее поверхности.
Данное
явление можно рассматривать с другой точки зрения. Действие сил молекулярного
давления, под влиянием которых жидкость принимает сферическую форму, аналогично
тому, как если бы поверхность жидкости представляла собой растянутую пленку,
стремящуюся сжаться. Все явления, которые вызваны существованием молекулярного
давления, объясняются путем рассмотрения действия такой растянутой пленки. Для
того чтобы растянутую пленку удержать в равновесии, к линии ее границы (рис.2)
надо приложить касательную к поверхности жидкости силы F, называемую
силой поверхностного натяжения. Чтобы с помощью силы F передвинуть
границу пленки длиной l на отрезке Δh, нужно
совершить работу ΔА = σ∙ΔS. Но
ΔА = F·Δh; ΔS=l·Δh. С учетом этого получим:
= σ·l или σ=F/l. (2)
Итак,
сила поверхностного натяжения прямо пропорциональна длине границы пленки l.
Коэффициент поверхностного натяжения численно равен силе, действующей на
единицу длины границы поверхности жидкости. Эта сила направлена перпендикулярно
к любому элементу длины, разграничивающей поверхность жидкости, и касательна к
ее поверхности. В системе СИ коэффициент поверхностного натяжения измеряется в
Н/м или Дж/м2, в системе СГС - дин/см или эрг/см2.
Величина
коэффициента поверхностного натяжения зависит от рода жидкости, температуры и
давления. Для данной жидкости зависимость коэффициента поверхностного натяжения
от температуры выражается формулой
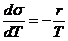 , (3)
, (3)
где
r - количество теплоты, затраченное на образование
единицы поверхности пленки. Из (3) следует, что с повышением температуры σ уменьшается и при стремлении температуры жидкости к
критической температуре Тк значение σ стремится к нулю. С ростом давления значение σ в определенной степени растет.
Поверхностное
натяжение объясняет многочисленные явления, характерные для жидкого состояния
вещества, например, образование капель при вытекании жидкости через малое отверстие,
образование пены, кривизну поверхности жидкости в сосуде, явления смачивания и
несмачивания.
Добавление
некоторых веществ в жидкость даже в небольшой концентрации существенно
уменьшает поверхностное натяжение жидкости. К ним принадлежат мыло, ряд жирных
кислот и многие другие. Такие вещества называются поверхностно-активными
веществами (ПАВ). Так как молекулы ПАВ притягиваются молекулами растворителя
слабее, чем молекулы самого растворителя, то из поверхностного слоя внутрь
жидкости преимущественно втягиваются молекулы растворителя и в поверхностном
слое увеличивается концентрация молекул растворенного вещества, уменьшая тем
самым поверхностное натяжение раствора. Поверхностный слой оказывается
обедненным молекулами растворителя и обогащенным молекулами растворенного
вещества. Это явление носит название адсорбции. Им объясняется устойчивость
жидких пленок, пены и т.д., она зависит от температуры, давления и
взаимодействия молекул адсорбента и адсорбируемого вещества между собой.
Существуют и такие вещества (соль, сахар), добавление которых к воде повышает
ее поверхностное натяжение.
Значение
коэффициента поверхностного натяжения σ можно определить различными способами: методом отрыва капель, методом
отрыва кольца, методом Ребиндера и др.
В
этой работе σ
определяется методом отрыва капель.
Теория
метода. Метод основан на том, что поверхностное натяжение не позволяет жидкости
сразу вылиться из трубы. По мере вытекания жидкости поверхностная пленка капли
получает сужение или шейку радиуса r. Отрыв капли происходит при
условии, что сила тяжести 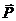 капли преодолевает силу поверхностного натяжения
капли преодолевает силу поверхностного натяжения 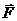 , действующую по периметру шейки капли (рис.3). В
момент равновесия перед отрывом капли
, действующую по периметру шейки капли (рис.3). В
момент равновесия перед отрывом капли
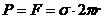 . (4)
. (4)
Откуда
коэффициент поверхностного натяжения жидкости
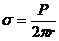 . (5)
. (5)
Однако
ввиду того, что радиус r шейки отрывающейся капли определить трудно, поступают
следующим образом. Пусть некоторый объем трубки V содержит
вначале n1 капель одной жидкости, а потом n2
капель другой; ρ1
и ρ2 - соответственно плотности этих жидкостей. Тогда используя (4), можно
записать, что вес рассматриваемого объема V одной жидкости
P1 = ρ1gV
или n1σ12π·r
= ρ1gV , (6)
где
Р1 - вес одной капли жидкости. Аналогично для другой жидкости в этом же объеме V
имеем:
2σ22π·r = ρ2gV . (6’)
Разделив
(6) на (6’) получим:
 или
или  .
.
Откуда
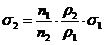 .
(7)
.
(7)
В
этой формуле σ1
- коэффициент поверхностного натяжения
эталонной жидкости (обычно этой жидкостью является вода) определяется по
справочной таблице, ρ1
и ρ2 - плотности эталонной и исследуемой жидкостей.
Выполнение
работы сводится к измерению числа капель эталонной и исследуемой жидкостей,
вытекающих из одного и того же объема трубки, заполняемой поочередно этими
жидкостями.
Описание
прибора. Прибор для определения коэффициента поверхностного натяжения данным
способом очень прост. Он состоит из бюретки с краном (рис.4). Во избежание
загрязнения бюретки разными жидкостями обычно берут несколько совершенно
одинаковых бюреток и наносят на одинаковых уровнях метки М1 и М2, заполняют
разными жидкостями и закрепляют на круговом штативе.
Порядок выполнения работы
1. Заполняют 2 бюретки жидкостями выше верхней метки М1: одну
исследуемой, другую - эталонной (водой).
2. Открывая кран бюретки с эталонной жидкостью, заставляют жидкость
медленно капать (приблизительно 1 капля в секунду). Считают число капель
вытекающей жидкости n1 с момента
прохождения уровня жидкости через верхнюю метку М1 бюретки до момента
прохождения уровня жидкости через нижнюю метку М2. Заносят значения n1 в таблицу.
. Повторяя аналогичный опыт с исследуемой жидкостью, заполняющей
другую бюретку, находят число капель n2 и также записывают в таблицу.
. Значения плотностей жидкостей эталонной ρ1
и исследуемой ρ2,
а также коэффициент
поверхностного натяжения σ1 эталонной жидкости при температуре проведения опытов
находят по справочным таблицам.
. Подставляя полученные значения в формулу (7), рассчитывают
коэффициент поверхностного натяжения исследуемой жидкости σ2.
6. Эксперимент повторяют несколько раз, находят среднее значение и
ошибку опыта. Данные заносят в таблицу.
|
№
|
ρ1,
кг/м3
|
ρ2,
кг/м3
|
σ1,
Н/м
|
n1
|
n2
|
σ2,
Н/м
|
Δσ2,
Н/м
|
(Δσср/ σср)∙100, %
|
|
1
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
. Окончательный результат написать в виде σ=
σср± Δσср.
Контрольные вопросы
1. Порядок выполнения работы.
2. Молекулярная природа силы поверхностного натяжения.
. Физический смысл коэффициента поверхностного натяжения с силовой
и энергетической точки зрения. Единицы его измерения.
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
Лабораторная работа № 9
ОПРЕДЕЛЕНИЕ
КОЭФФИЦИЕНТА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ЖИДКОСТЕЙ МЕТОДОМ ОТРЫВА КОЛЬЦА
Принадлежности: воронка с краном, набор разновесок, исследуемая жидкость,
сосуд для слива жидкости из воронки, термометр, кольцо, пружинный динамометр,
штатив.
Цель работы: ознакомление с явлением поверхностного натяжения,
молекулярной природой этого явления и одним из методов определения коэффициента
поверхностного натяжения, а также практическое определение этого коэффициента
для одной жидкости.
Введение. См. Лабораторную работу № 8.
Теория. См. Лабораторную работу № 8.
Теория метода. Поверхностное натяжение можно также определить путем
измерения силы, которую нужно приложить перпендикулярно к поверхности жидкости
для отрыва различных твердых тел от этой поверхности. Так как отрываемое тело
смачивается этой жидкостью, то вместе с ним поднимается некоторое количество
жидкости, т.е. свободная поверхность жидкости будет увеличиваться. Вследствие
стремления этой поверхности сократиться проявляется сила поверхностного
натяжения. Если сила, действующая на тело, равна по величине силе
поверхностного натяжения (точнее, несколько больше ее), то тело оторвется.
Рассмотрим кольцо с наружным диаметром D и толщиной d,
касающиеся поверхности жидкости (рис.3).
При поднятии кольца над поверхностью жидкости между кольцом и
поверхностью жидкости образуется пленка. Внешняя поверхность этой пленки тянет
кольцо вниз с силой σπD, внутренняя поверхность также тянет вниз с σπ(D-2d). Результирующая сила, удерживающая кольцо равна
σπD
+ σπ(D-2d)
= 2σπ(D-d).
В момент отрыва кольца F = 2σπ(D-d), откуда
 .
(4)
.
(4)
Так
как диаметр и толщина кольца могут быть измерены штангенциркулем, то
определение коэффициента поверхностного натяжения σ сводится к определению силы отрыва кольца F,
которая может быть рассчитана различными методами. Один из них применяется в
данной работе. Схема установки приводится на рис.4.
Описание
прибора. На штативе Шт закреплена воронка В с краном К и динамометром Д
(рис.4). К нижнему концу пружины динамометра прикреплены последовательно
чашечка для разновесов Ч и металлическое кольцо М. В воронку налита исследуемая
жидкость. Внизу под воронкой располагается сосуд С для слива жидкости.
Порядок
выполнения работы
1. Измеряют штангенциркулем толщину d и внешний диаметр D кольца и записывают результаты в таблицу.
2. Заполняют воронку В исследуемой жидкостью и измеряют термометром
ее температуру.
. Перемещая воронку вдоль Шт, осторожно подводят уровень жидкости
в ней до соприкосновения с кольцом М.
. Открывают кран К и жидкость выливается в сосуд С. Уровень
жидкости в воронке понижается, увлекая за собой кольцо М.
. В момент отрыва кольца от жидкости отмечают положение указателя
Ук динамометра на шкале. Кран К закрывают, и перемещают вниз по Шт воронку В.
. Помещая в чашечку Ч разновески, вновь растягивают пружину
динамометра Д до отмеченного ранее положения указателя. Вес этих разновесок (Р=mg) равен силе отрыва кольца от
жидкости F, т.е. F=P=mg.
. Полученные значения d, D и F подставляют в формулу (4) и находят σ
данной жидкости.
. Повторяют эксперимент не менее 3 раз. Определяют среднее
значение σ, абсолютную и относительную ошибку эксперимента.
|
№
|
d, м
|
D, м
|
m, кг
|
F=P=mg, Н
|
σ,
Н/м
|
Δσ,
Н/м
|
(Δσср/ σср)∙100, %
|
|
1
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
. Окончательный результат написать в виде σ=
σср± Δσср.
Контрольные вопросы
1. Порядок выполнения работы.
2. Молекулярная природа силы поверхностного натяжения. Как
направлена эта сила?
. Физический смысл коэффициента поверхностного натяжения с силовой
и энергетической точки зрения. Единицы его измерения.
. От чего зависит коэффициент поверхностного натяжения жидкости?
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
Лабораторная работа № 10
ОПРЕДЕЛЕНИЕ
КОЭФФИЦИЕНТА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ЖИДКОСТЕЙ МЕТОДОМ РЕБИНДЕРА
Принадлежности: прибор Ребиндера, аспиратор, сосуд для слива жидкости.
Цель работы: ознакомление с явлением поверхностного натяжения, молекулярной
природой этого явления и одним из методов определения коэффициента
поверхностного натяжения, а также практическое определение этого коэффициента
для одной жидкости.
Введение. См. Лабораторную работу № 8.
Теория. См. Лабораторную работу № 8.
Описание прибора и теория метода. Прибор Ребиндера (рис.3) состоит из
сосуда 1 с исследуемой жидкостью, внутрь которого вставлен капилляр 2 так,
чтобы кончик его был на некотором расстоянии от границы жидкости (1-2 мм).
Сосуд 1 с помощью системы трубок соединяется с аспиратором 3. Если из
аспиратора 3 вытекает вода, то давление воздуха внутри сосуда 1 понижается и
при некотором его значении р под действием атмосферного давления р0 через
капилляр в жидкость продавливается пузырек воздуха. Разность (р0-р) измеряется
манометром 4.
Давление внутри газового пузырька в жидкости в момент отрыва равно
атмосферному р0. Это давление уравновешивается давлением р над поверхностью
жидкости в сосуде 1 и избыточном давлением р1, обусловленным кривизной
поверхности пузырька (гидростатическим давлением можно пренебречь, так как
глубина погружения пузырька мала):
р0 =р + р1. (4)
Согласно формуле Лапласа избыточное давление под изогнутой поверхностью
жидкости равно
 , (5)
, (5)
где
σ
- коэффициент поверхностного натяжения
жидкости, R1 и R2 - радиусы кривизны поверхности жидкости в двух
взаимно перпендикулярных сечениях.
Так
как для сферической поверхности R1 = R2 = R, то
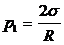 .
(6)
.
(6)
Давление
в пузырьке будет максимальным, когда радиус его будет минимальным, т.е. равным
радиусу капилляра r. Тогда из (4) и (6) получим
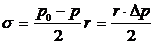 . (7)
. (7)
Величина
 есть постоянная прибора, которая определяется
измерением Δр0 для жидкости с известным коэффициентом
поверхностного натяжения:
есть постоянная прибора, которая определяется
измерением Δр0 для жидкости с известным коэффициентом
поверхностного натяжения: 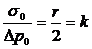 . Тогда
. Тогда 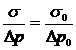 , откуда
для исследуемой жидкости
, откуда
для исследуемой жидкости
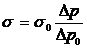 . (8)
. (8)
Если
разность высот жидкости в манометре (подкрашенная вода) равна h, а
плотность этой жидкости при комнатной температуре ρ, то
Δр = ρgh. (9)
Подставляя
(9) в (8), получим
 .
(10)
.
(10)
Для
воды при t=200С σ0 = 72∙10-3
Н/м, Δр0 = 242,55 Па. Поэтому для расчета коэффициента
поверхностного натяжения исследуемой жидкости достаточно измерить разность
высот h жидкости в манометре в момент отрыва пузырьков
воздуха от капилляра 2.
Порядок выполнения работы
1. Наливают в сосуд 1 прибора Ребиндера исследуемую жидкость, в
аспиратор 3 воду.
2. Проверив глубину погружения капилляра 2 в исследуемую жидкость,
открывают кран К аспиратора 3 до тех пор, пока от кончика капилляра начинают
равномерно отрываться пузырьки воздуха. Измеряют разность уровней h жидкости в манометре и заносят в
таблицу.
. Подставляя значения σ0 = 72∙10-3 Н/м, Δр0 = 242,55 Па, ρ=1000
кг/м3 (для воды), g=9,8 м/с2 и h в формулу (10), рассчитывают значение σ
для исследуемой
жидкости.
. Повторяют опыт несколько раз (не менее трех). Находят среднее
значение σ, абсолютную (Δσ) и относительную (N) ошибку эксперимента.
|
№
|
σ0,
Н/м
|
Δр0, Па
|
ρ,
кг/м3
|
g, м/с2
|
h, м
|
σ,
Н/м
|
Δσ,
Н/м
|
N, %
|
|
1
|
72∙10-3
|
242,55
|
1000
|
9,8
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
5. Окончательный результат написать в виде σ=
σср± Δσср.
Контрольные вопросы
1. Порядок выполнения работы.
2. Молекулярная природа силы поверхностного натяжения. Как
направлена эта сила?
. Физический смысл коэффициента поверхностного натяжения с силовой
и энергетической точки зрения. Единицы его измерения.
. От чего зависит коэффициент поверхностного натяжения жидкости?
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
Лабораторная работа № 11
ОПРЕДЕЛЕНИЕ
УДЕЛЬНОЙ ТЕПЛОЕМКОСТИ ЖИДКОСТЕЙ ПРИ ПОМОЩИ ЭЛЕКТРОКАЛОРИМЕТРА
Принадлежности: два равноценных электрокалориметра, два термометра,
реостат, амперметр, технические весы, разновесы, эталонная и исследуемая
жидкости.
Цель работы: ознакомление с процессами теплообмена, определение удельных
теплоемкостей жидкости при помощи электрокалориметра.
Введение. Определение удельной теплоемкости веществ имеет большое
значение для изучения тепловых и акустических свойств веществ, а также для
конструирования и подбора материалов отопительных и охладительных систем.
Теория. Внутренняя энергия вещества - это полная энергия частиц (атомов,
молекул, ионов электронов, протонов, нейтронов), составляющих данное вещество.
Полная энергия частиц слагается из их кинетической и потенциальной энергий.
Кинетическая энергия - это энергия поступательного, колебательного и
вращательного движения частиц; потенциальная энергия обусловлена силами
притяжения и отталкивания, действующими между частицами. Величина внутренней
энергии меняется при теплообмене. Теплообменом называется переход внутренней
энергии от одного тела к другому вследствие неодинаковости температур этих тел.
При соприкосновении двух тел с различной температурой, молекулы более нагретого
тела, сталкиваясь с молекулами менее нагретого тела, передают им часть своей
кинетической энергии. Такой процесс продолжается до тех пор, пока температура
не станет одинаковой.
Для нагревания различных веществ одинаковой массы потребляется различное
количество теплоты. Например, железный цилиндр нагревается быстрее, чем такая
масса воды. Причина в том, что разные тела имеют разную теплоемкость.
Количество теплоты, необходимое для нагревания вещества на 1 К (или на 1
0С), называют теплоемкостью, а количество теплоты, необходимое для нагревания 1
кг вещества на 1 К (или на 1 0С) называют удельной теплоемкостью. Если
обозначить удельную теплоемкость через с, массу через m, начальную и конечную температуру тела соответственно через t1 и t2, количество теплоты, необходимое для нагревания тела массой
m от t1 до t2
градусов, через Q, то
 . (1)
. (1)
Описание
прибора и теория метода. Общая схема прибора приведена на рис.1.
Он
состоит из двух одинаковых калориметров I, II с
одинаковыми термометрами t1, t2. Эти калориметры снабжены электрическими
нагревателями. Один электрокалориметр наполняется эталонной жидкостью с
известной удельной теплоемкостью, обычно дистиллированной водой, а другой -
исследуемой жидкостью. Если пропустить электрический ток через нагреватели, то
из них выделяется тепло. Количество выделившегося в каждом калориметре тепла
определяется по закону Джоуля-Ленца равенством
=0,24
I2Rτ, (2)
где
I - сила тока, R -
сопротивление нагревателя, τ - время
протекания тока через электрическую цепь калориметра.Если сопротивление обоих
нагревателей взять одинаковыми, то в калориметрах выделяется одинаковое
количество теплоты, т.е. Q1 = Q2, где
Q1 - количество
теплоты, полученное первым калориметром:
 , (3)
, (3)
2
- количество теплоты, полученное вторым калориметром:
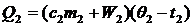 , (4)
, (4)
здесь
m1, m2 - массы жидкостей в I и II
калориметрах, с1, с2 соответственно их удельные теплоемкости, t1, θ1 - начальная и конечная температура в первом калориметре,
t2, θ2 - начальная и конечная температура во втором
калориметре, W1 - водяной эквивалент первого калориметра,  ,
,  -
удельная теплоемкость материала первого калориметра,
-
удельная теплоемкость материала первого калориметра,  - масса первого калориметра, W2 - водяной
эквивалент второго калориметра,
- масса первого калориметра, W2 - водяной
эквивалент второго калориметра,  ,
, 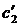 - удельная теплоемкость материала второго калориметра,
- удельная теплоемкость материала второго калориметра,
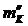 - масса второго калориметра.
- масса второго калориметра.
Приравнивая
выражения для Q1 и Q2, получаем формулу для расчета удельной теплоемкости
исследуемой жидкости, налитой во второй калориметр:
 . (5)
. (5)
В
первый калориметр наливается дистиллированная вода.
Порядок выполнения работы
1. Определяется
массы калориметров 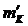 и
и 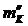 .
.
. Наливаются
эталонная и исследуемая жидкости в калориметры, и определяются их массы m1 и m2.
Чтобы избежать различных ошибок, массу исследуемой жидкости желательно брать
несколько больше, чем эталонной. Так как из формулы (5) получается следующее
соотношение между водяными эквивалентами калориметров и повышениями температуры
в них:  , то есть повышение температуры (θ1-t1) и (θ2-t2) в калориметрах с эталонной и исследуемой жидкостью
должно зависеть от теплоемкостей этих жидкостей.
, то есть повышение температуры (θ1-t1) и (θ2-t2) в калориметрах с эталонной и исследуемой жидкостью
должно зависеть от теплоемкостей этих жидкостей.
. По
термометрам определяются начальные температуры эталонной и исследуемой
жидкости, соответственно t1 и t2.
. Пропускается
ток через электрокалориметры и нагреваются жидкости на 4-60С. Во избежание
тепловых потерь в окружающую среду величины (θ1- t1) и (θ2- t2) не должны превышать 4-60С.
. Затем
выключаются ток и через 30-40 с определяются конечные температуры жидкостей в
калориметрах, соответственно θ1 и θ2.
6. Удельные
теплоемкости материала калориметра и эталонной жидкости находятся из справочных
таблиц.
. На
основании найденных величин по формуле (5) определяется удельная теплоемкость
исследуемой жидкости с2.
. Опыт
повторяется не менее трех раз и определяется среднее значение с2, абсолютные (Δс2) и относительные (N) ошибки
измерений. Окончательный результат написать в виде c2=c2ср±Δc2ср.
№  ,
,
кг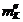 ,
,
кг ,
,
 W1,
W1,
 W2,
W2,
 c1,
c1,
 m1,
m1,
кгm2,
кгt1,
Кt2,
Кθ1,
Кθ2,
Кc2,
 Δc2,
Δc2,
 N,
N,
|
%
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
|
|
896
|
|
|
4182
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
Контрольные вопросы
1. Ход выполнения работы.
2. Внутренняя энергия идеальных и реальных газов и жидкостей.
. Теплоемкость и удельная теплоемкость идеальных газов, реальных
газов и жидкостей.
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
Лабораторная работа № 12
ОПРЕДЕЛЕНИЕ
УДЕЛЬНОЙ ТЕПЛОТЫ ПАРООБРАЗОВАНИЯ ЖИДКОСТЕЙ КАЛОРИМЕТРОМ
Принадлежности: специальная установка,
парообразователь, электроплитка, калориметр, термометр, технические весы с
разновесами.
Цель работы: ознакомление с процессом парообразования
и методом определения удельной теплоты парообразования.
Теория. Процессы, связанные с переходом вещества из
жидкой фазы в газообразную и обратно, очень распространены в природе и технике,
поэтому изучение их особенностей имеет большое практическое значение.
Переход вещества из конденсированной (жидкой или
твердой) фазы в газовую называется парообразованием. Различают следующие виды
парообразования: испарение (парообразование со свободной поверхности жидкой
фазы, в случае твердого тела - сублимация) и кипение (парообразование, которое
происходит не только со свободной поверхности жидкости, но и внутри самой
жидкости).
Рассмотрим процесс кипения жидкости. Нальём в
стеклянный сосуд воду, опустим в неё термометр и проследим за её нагреванием до
кипения. Чтобы могло происходить испарение, необходимо наличие поверхностного
раздела, т.е. пустое пространство над жидкостью. Однако эту поверхность можно
получить и внутри жидкости, так как любая жидкость способна в той или иной мере
поглощать газы. При нагревании растворённые в жидкости газы начинают выделяться
в виде пузырьков. Пузырьки внутри жидкости могут существовать в том случае,
если давление пара в них равно или чуть больше внешнего давления, при котором
находится жидкость. Внутрь пузырьков идет испарение. Когда давление внутри
пузырьков становится равным давлению над поверхностью жидкости, пузырьки
выходят на поверхность жидкости и, лопаясь, выбрасывают пар. Это явление
называется кипением жидкости.
Итак, кипение жидкости наступает в том случае, когда
температура всей жидкости одинакова, а давление насыщенного пара этой жидкости
разно внешнему давлению на её поверхность.
Опыт показывает, что во время кипения жидкости её
температура остается неизменной, а вся энергия, получаемая жидкостью от
нагревателя, затрачивается на превращение жидкой фазы вещества в газообразную.
Количество теплоты, необходимое для превращения в пар единицы массы жидкости,
находящейся при температуре кипения, называется удельной теплотой
парообразования (испарения):
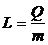 .
.
физический величина измерение погрешность
Удельная
теплота парообразования вещества равна удельной теплоте конденсации. При
конденсации происходит выделение теплоты.
Температура,
при которой давление насыщенного пара жидкости равно внешнему давлению на её
поверхность, называется температурой кипения жидкости, так как при этой
температуре происходит кипение.
Описание
прибора и теория метода. Рассмотрим, как экспериментально определяют теплоту
парообразования вещества, например, воды (рис.1).
Пар,
образующийся в колбе (парообразователе) 2 при кипении воды, по трубке поступает
в расширение 3, где осаждаются вылетевшие с паром капельки воды, а затем дальше
по трубке поступает в калориметр 4. Калориметр (от лат. calor
- тепло и греч. metreo - измеряю) в настоящей работе, это - металлический
стакан, снабженный термометром и мешалкой, с внешним пластмассовым кожухом; для
уменьшения потерь за счет теплопроводности между стаканом и внешним кожухом
оставлен воздушный промежуток.
Пусть
масса внутреннего стакана калориметра mK, масса воды в нем mВ,
их температура t1 (комнатная). Водяной пар с температурой t2,
попав в воду калориметра конденсируется и внутренний стакан калориметра с водой
нагревается до температуры q. Масса водяного пара mП,
сконденсировавшегося во внутренним стакане калориметра, определяется путём
взвешивания внутреннего стакана калориметра после опыта.
Расчёт
удельной теплоты парообразования воды L производится с помощью уравнения
теплового баланса, которое составляется следующим образом. Нагревались, т.е.
получали теплоту во время опыта внутренний стакан калориметра и находившаяся в
нем вода:
ПОЛУЧ
= QК +QВ
или
ПОЛУЧ = сКmК(q - t1) + сBmB(q - t1), (1)
где
сК и сB - соответственно удельные теплоемкости внутреннего
стакана калориметра и воды.
Отдавали
теплоту пар при конденсации и образовавшаяся из него вода при остывании от
температуры t2 до q. Пар при его конденсации в
жидкость отдает теплоту QПК=LmП, где L - удельная теплота парообразования воды. Остывающая
вода, получившаяся при конденсации пара, отдает теплоту QПВ=
сBmП(t2-q). Следовательно:
ОТДАН
=QПК + QПВ = LmП + сBmП(t2-q). (2)
Так как процесс происходит в калориметре, т.е. без
теплообмена с окружающей средой, уравнение теплового баланса имеет вид
QПОЛУЧ.= QОТДАН
или QК +QВ= QПК + QПВ
или LmП +
сBmП(t2 -q) =
сКmК(q -t1) + сBmB(q -t1). (3)
Из этого уравнения находим, что
 . (4)
. (4)
Порядок выполнения работы
1. Взвесить пустой внутренний стакан калориметра,
т.е. определить mК.
2. Налить в стакан калориметра воду до половины
объема и взвесить, т.е. определить массу калориметра и воды вместе, т.е. m=mК +mВ.
Отсюда mВ= m - mК,
т.е. определяется mВ.
. При помощи термометра определить температуру
воды в калориметре и самого калориметра, т.е. найти t1.
. Установить парообразователь 2 на
электроплитку 1 и включить её в сеть 220 В.
5. Температуру кипения воды t2 определить из таблицы зависимости
температуры кипения от давления. Давление определить по лабораторному
барометру. (Температуру кипения воды можно определить и по формуле t2=1000C - 0,0375(760 - H), где Н - атмосферное давление в помещении во время опыта.)
6. Опустить трубку от парообразователя 2 в воду
калориметра 4 и пропускать пар через воду. Когда температура воды повысится на
5-100С по сравнению с комнатной, остановят пропускание пара (для этого
парообразователь снимается с электроплитки) и записывают максимальную
температуру воды калориметра. Эта температура будет последней температурой q воды и калориметра.
7. Взвесить внутренний стакан калориметра с
водой, через которую пропускали пар, т.е. находится общая масса калориметра,
воды и воды, которая сконденсировалась из пара, т.е. mК + mВ + mП = mОБЩ. Естественно, что масса пара mП, равна массе воды mПВ, сконденсировавшейся в калориметре.
8. Найти массу mП по формуле mП=mОБЩ - mК - mВ.
9. Удельные теплоемкости материала калориметра сК
и воды сВ взять из таблиц.
. По формуле (4) вычислить удельную теплоту пapooбразования L.
11. Опыт производить не менее трёх раз. Определить
среднее значение L, абсолютные (ΔL) и относительные (N) погрешности эксперимента.
Полученные данные занести в таблицу:
№ сК,
 сВ,
сВ,
 mК,
mК,
кгmВ,
кгmП,
кгt1,
Сt2,
Сq,
СL,
 DL,
DL,
 (DLср/Lср)∙100,
(DLср/Lср)∙100,
. Написать окончательный результат в виде L=Lср±ΔLср.
Контрольные вопросы
1. Чем отличается кипение от испарения?
2. Что называется теплотой парообразования?
. Что называется удельной теплотой
парообразования и в каких единицах она измеряется?
. Может ли кипеть вода при 20 0C?
. Испаряются ли твёрдые тела?
. Можно ли охлаждением заставить воду кипеть?
. От каких условий зависит скорость испарения
жидкости?
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
2. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
Лабораторная работа № 13
ОПРЕДЕЛЕНИЕ ВЛАЖНОСТИ
ВОЗДУХА МЕТОДОМ ПСИХРОМЕТРА
Принадлежности: психрометр, стакан с дистиллированной водой.
Цель работы: ознакомление с понятиями абсолютной и относительной
влажности, а также с принципом работы психрометра, определение влажности
воздуха психрометром.
Введение. Так как Земля на 2/3 покрыта водой, то в состав атмосферы
входит водяной пар, и все процессы в жизни и в технике, связанные с испарением
воды, зависят от состояния водяного пара в воздухе. Оказывается, что в течение
года в атмосферу Земли испаряется около 4,25·1014 т воды с поверхностей
океанов, морей и др., и около 1/4 этой воды выпадает в виде осадков на сушу.
Конечно, количество водяных паров в воздухе везде различно. Вблизи морей и
океанов воздух более влажный, чем в глубине материков.
Влажность воздуха оказывает большое влияние на организм человека,
животных, на деревянные, металлические изделия и на всю окружающую среду в
целом.
Если воздух, окружающий Землю, охладится ниже точки росы, то может
образоваться туман, облака, роса или иней в зависимости от условий их
образования. По влажности воздуха можно предсказать погоду, которая имеет
большое значение в деятельности человека. Степень влажности воздуха имеет
большое влияние на многие процессы, протекающие на Земле, например, на развитие
флоры и фауны, на урожай сельскохозяйственных культур, на продуктивность
животноводства. Не меньшую роль играет влажность и во многих отраслях
современной техники, например в процессах сушки и хранения готовых изделий и
т.д.. Следовательно, измерение и регулирование влажности имеет большое
практическое значение.
Теория. Одной из основных частей воздуха является водяной пар, который
обычно присутствует в воздухе в значительно меньшем количестве, чем нужно для
насыщения.
Пар называется насыщенным, когда число возвращающихся в жидкость молекул
равно числу молекул, покидающих жидкость за тот же промежуток времени
(динамическое равновесие). Давление пара, если он насыщен, называется давлением
насыщенного (насыщающего) пара (или иногда просто давлением пара).
Величина, характеризующая содержание водяных паров в воздухе, называется
влажностью воздуха. На практике различают абсолютную и относительную влажность
воздуха. Количество (масса) водяных паров в граммах, содержащихся в 1 м3
воздуха, называется абсолютной влажностью воздуха ρ.
Т.е. она выражается в
г/м3. Отношение абсолютной влажности воздуха к тому количеству водяного пара,
которое необходимо для насыщения 1 м3 воздуха при данной температуре,
называется относительной влажностью r. Она выражается в процентах. Таким образом, относительная влажность
характеризует степень насыщения воздуха водяным паром.
Относительную влажность воздуха измеряют числом, показывающим, сколько
процентов составляет абсолютная влажность ρ от плотности водяного пара ρН, нужной для насыщения воздуха при
имеющейся у него температуре:
 (1)
(1)
Оказывается,
что относительную влажность воздуха можно определять по давлению паров, так как
практически давление пара пропорционально его плотности. Поэтому r можно
определять как отношение давление водяного пара р, содержащегося в воздухе, к
давлению насыщенного водяного пара рН при данной температуре:
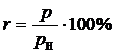 (2)
(2)
Таким
образом, относительная влажность определяется не только абсолютной влажностью,
но и температурой воздуха. Давления насыщенного водяного пара при различных
температурах тщательно измерены, и на основе этих измерений составлены таблицы
(см. табл.1), поэтому значение рН берут из таблиц, а значение р находят из опыта
и по формуле (2) вычисляют относительную влажность.
Определение
влажности воздуха производится обычно или методом определения точки росы или
методом психрометра.
Метод
психрометра. Метод психрометра (от греч. psychria - холод
и metreo - измеряю) - наиболее распространенный метод
измерения влажности воздуха. Сущность его состоит в следующем: пусть два
одинаковых термометра находятся в одинаковых потоках воздуха. Показания этих
термометров, естественно, должны быть одинаковыми. Если же баллончик одного из
термометров будет обернут мокрым батистом, то показания термометров будут
различными. Благодаря испарению воды с батиста, смоченный термометр показывает
температуру t1 более низкую, чем сухой термометр t2.
Чем меньше влажность окружающего воздуха, тем интенсивнее будет испарение и тем
ниже показания смоченного термометра. Отсчеты по двум термометрам дадут
разность температур, которая и будет характеризовать влажность воздуха. При
установившемся режиме испарения, когда температура термометра тоже установится,
приток тепла Q1 извне равен расходу тепла Q2 на испарение
воды с поверхности термометра.
По
закону Ньютона за единицу времени имеем
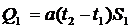 , (3)
, (3)
где
(t2 - t1) - наибольшая разность температур сухого и
смоченного термометров, S1 - поверхность баллончика смоченного термометра, a -
коэффициент пропорциональности.
По
закону Дальтона, испарение в единицу времени определяется выражением 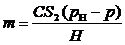 , где m - масса испарившейся воды, S2 - площадь
испаряющей поверхности, Н - давление атмосферного воздуха, рН - упругость
насыщенного водяного пара при температуре испаряющейся жидкости, т.е. при
температуре t1, р - упругость водяного пара, находящегося в
воздухе, С - коэффициент пропорциональности, зависящий от скорости потока
воздуха.
, где m - масса испарившейся воды, S2 - площадь
испаряющей поверхности, Н - давление атмосферного воздуха, рН - упругость
насыщенного водяного пара при температуре испаряющейся жидкости, т.е. при
температуре t1, р - упругость водяного пара, находящегося в
воздухе, С - коэффициент пропорциональности, зависящий от скорости потока
воздуха.
Количество
тепла Q2 может быть записано в виде
 , (4)
, (4)
где
L - удельная теплота испарения воды.
При
Q1=Q2 и S1=S2 получаем 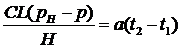 , откуда
, откуда
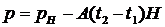 , (5)
, (5)
где
 - постоянная применяемого прибора. Величина этой
постоянной определяется в основном скоростью потока и находится
экспериментально.
- постоянная применяемого прибора. Величина этой
постоянной определяется в основном скоростью потока и находится
экспериментально.
Описание
прибора. Устройство применяемого в данной работе стандартного аспирационного
психрометра изображено на рис.1 (аспиратор (от лат. aspiro - дую,
вдыхаю, выдыхаю) - прибор для отбора воздуха). Он служит для измерения
влажности и температуры воздуха.
Прибор
состоит из двух одинаковых ртутных термометров, закрепленных в специальной
оправе, имеющей заводной механизм с вентилятором, протягивающим воздух около
резервуаров термометров. Путь воздушных потоков (скорость около 2 м/с) показан
стрелками. Пружина заводного механизма заводится ключом К. Перед работой
резервуар правого термометра обертывается батистом в один слой и смачивается
чистой дистиллированной водой при помощи груши, пипетки или иным способом.
Прибор
работает следующим образом. Вращением вентилятора в прибор всасывается воздух,
который, обтекая резервуары термометров, проходит по воздухопроводной трубке к
вентилятору и выбрасывается им наружу через прорези. Благодаря протеканию
потока воздуха вокруг резервуаров термометров сухой термометр будет показывать
температуру этого потока, а показания смоченного термометра будут меньше, так
как он будет охлаждаться вследствие испарения воды с поверхности батиста,
облегающего его резервуар. Влажность воздуха определяется по показаниям сухого
и смоченного термометров по специальным психрометрическим таблицам или
психрометрическому графику, а температура воздуха - по показаниям сухого
термометра.
Порядок выполнения работы
1. Покрытый батистом баллончик правого термометра смачивается
дистиллированной водой поднятием стакана. Потом стакан опускается вниз. Нужно
следить, чтобы при смачивании вода не попала на другой термометр.
. Ключом К заводят вентилятор (5-6 оборотов ключа) и следят за
показанием термометра.
. Когда показания установятся (через 4-5 мин), записывают
показания смоченного t1 и
сухого t2 термометров; вентилятор при этом
должен работать полным ходом. При отсчете показаний термометров следует прежде
отсчитать десятые доли градусов и записать их и только после этого целые
значения.
. Абсолютная влажность по стандартному аспирационному психрометру
определяется формулой
р=рН(при t1) - 0,000662(t2 - t1) H. (6)
Величину рН давления насыщенного водяного пара при температуре мокрого
термометра t1 берут из справочных таблиц. (t2-t1) - разность показаний сухого и смоченного термометров.
Атмосферное давление Н определяют, пользуясь лабораторным барометром.
5. Если
из справочных таблиц взять величину давления насыщенного пара при температуре
окружающего воздуха, т.е. сухого термометра t2, то легко
определить по формуле  (2) относительную влажность. Удобнее, однако,
пользоваться психрометрической таблицей относительной влажности воздуха, с
помощью которого, зная температуры смоченного t1 и сухого t2
термометров, сразу определяется величина относительной влажности.
(2) относительную влажность. Удобнее, однако,
пользоваться психрометрической таблицей относительной влажности воздуха, с
помощью которого, зная температуры смоченного t1 и сухого t2
термометров, сразу определяется величина относительной влажности.
. Опыты
проводят не менее трех раз. Определяют среднее значение r,
абсолютные и относительные погрешности опытов. Полученные результаты заносятся
в следующую таблицу. Окончательный результат написать в виде r=rср± Δrср.
|
№
|
t1,
0C
|
t2,
0C
|
рН (при t1),
мм рт. ст.
|
Н, мм рт. ст.
|
р, мм рт.ст
|
рН (при t2),
мм рт. ст.
|
r, %
|
Δr, %
|
(Δrср/
rср)∙100, %
|
|
1
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
Контрольные вопросы
1. Порядок выполнения работы.
2. Насыщенный пар.
. Абсолютная и относительная влажность.
. Методы определения влажности воздуха.
. Устройство психрометра.
. Почему при испарении жидкость охлаждается?
. Какие факторы влияют на скорость испарения?
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
2. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
. Физический
практикум. Механика и молекулярная физика. / Под ред. проф. В.И.Ивероновой. М.:
Наука, 1967. 352 c.
Лабораторная работа № 14
ОПРЕДЕЛЕНИЕ
КОЭФФИЦИЕНТА ЛИНЕЙНОГО РАСШИРЕНИЯ ТВЕРДЫХ ТЕЛ
Принадлежности: механические дилатометры, исследуемые металлические
стержни, парообразователь, электроплитка, индикатор, соединительные трубки.
Цель работы: ознакомление со строением твердых тел и причинами их
теплового расширения, определение коэффициента линейного расширения некоторых
твердых тел.
Введение. Тепловое расширение твердых тел имеет большое значение в
повседневной жизни. Электрические и телеграфные провода в жаркую летнюю погоду
провисают заметно больше, чем во время зимних морозов; поэтому провода, при
помощи которых передвигаются троллейбусы, электрические поезда, на летний
период натягивают, чтобы избежать замыкания, а в зимний период, наоборот,
расслабляют. Крепление металлических крышек на стеклянных банках можно
ослабить, поливая крышки горячей водой.
Тепловое расширение различных материалов при одном и том же повышении
температуры различно. Это принимают во внимание при конструировании различных
приборов. Например, при конструировании термометров, которые состоят из двух
кусков разных металлов, соединенных вместе и подобранных так, чтобы один из них
при увеличении температуры расширялся гораздо больше другого. И тогда это так
называемая биметаллическая полоска изменяет свой радиус кривизны, как показано
на рис.1.
Такую свернутую в спираль полоску используют в бытовых холодильниках, в
утюгах, в бытовых плитах для регулировки температуры. Спираль перемещает
стрелку, указывающую температуру и управляет выключателем, запускающим и
останавливающим нагревательную систему. При проектировании моста также предусматривают
изменение температуры, которое может привести к изменению его длины, для чего
один конец моста закрепляют, а другой ставится на специальные ролики, чтобы
некоторые балки и плиты могли скользить друг по другу, во избежание изгибов.
Ту же проблему решают и при прокладке железнодорожных рельсов и железных
паропроводов (паропроводы снабжают пружинящими изгибами в виде петель -
комплексаторов (рис.2.)).
Очень часто мы наблюдаем, как лопаются банки при наливании в них горячей
воды. Это происходит вследствие неравномерного нагрева стекла, т.е. сначала
прогреваются и расширяются внутренние части и расширяют при этом внешнюю
поверхность посуды. Таким образом, при неравномерном нагревании тел в них
возникают напряжения, которые могут привести к их разрушению. Во избежание
этого посуду изготовляют из тонкого стекла, чтобы она быстро прогревалась по
всей толщине (например, при изготовлении термосов, химической посуды,
термостойкой посуды).
Теория. Тепловым расширением называется увеличение линейных размеров и
объемов тел, происходящее при повышении их температуры. Линейное тепловое
расширение характерно для твердых длинных тел. Объемное тепловое расширение
происходит как в твердых телах, так и в жидкостях при их нагревании.
Рассмотрим причины, приводящие к тепловому расширению твердых тел. В
твердом теле частицы (атомы, молекулы, ионы) совершают лишь колебания около
равновесного положения (в аморфных твердых телах эти положения равновесия
расположены хаотично, в кристаллических твердых телах расположены упорядоченно
(в узлах кристаллической решетки)). Повышение температуры тела означает
увеличение энергии теплового движения, т.е. тепловых колебаний атомов,
следовательно, и рост амплитуды этих колебаний. Если бы колебания атомов были
строго гармоническими, то каждый атом настолько же приближался бы к одному из
своих соседей, насколько удалялась от другого, и увеличение амплитуды его
колебаний не привело бы к изменению среднего межатомного расстояния, а значит,
и к тепловому расширению.
В действительности атомы совершают ангармонические (т.е. не
гармонические) колебания. Это обусловлено характером зависимости сил
взаимодействия между атомами от расстояния между ними. Зависимость эта такова,
что при больших расстояниях между атомами силы взаимодействия между атомами проявляются
как силы притяжения, а при уменьшении этого расстояния меняют свой знак и
становятся силами отталкивания, быстро возрастающими с уменьшением расстояния.
Это приводит к тому, что при возрастании амплитуды колебаний атомов вследствие
нагревания тела рост сил отталкивания между атомами преобладает над ростом сил
притяжения. Другими словами, атому «легче» удалиться от соседа, чем
приблизиться другому. Это, конечно, должно привести к увеличению среднего
расстояния между атомами, т.е. к увеличению объема тела при его нагревании.
Отсюда следует, что причиной теплового расширения твердых тел является
ангармоничность колебаний атомов.
Количественно тепловое расширение характеризуется коэффициентами
линейного и объемного расширения, которые определяются следующим образом. Пусть
тело длиной l0 при изменении температуры на Δt градусов изменяют свою длину на Δl. Коэффициент линейного расширения
определяется из соотношения
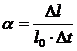 , (1)
, (1)
т.е.
коэффициент линейного расширения равен относительному изменению длины при
изменении температуры на один градус. Точно так же коэффициент объемного
расширения β
определяется формулой
 , (2)
, (2)
т.е.
коэффициент объемного расширения равен относительному изменению объема при
изменении температуры на один градус.
Из
этих формул следует, что длина lt и объем Vt при некоторой температуре,
отличающейся от начальной на Δt градусов, выражаются формулами (при малом Δt):
 (3)
(3)
и
 , (4)
, (4)
где
l0 и V0 - начальные длина и объем тела.
Вследствие
анизотропии кристаллов коэффициент линейного расширения α может быть различным в разных направлениях. Это
означает, что если из данного кристалла выточить шар, то после его нагревания
он потеряет свою сферическую форму. Можно показать, что в самом общем случае
такой шар при нагревании превращается в трехосный эллипсоид, оси которого
связаны с кристаллографическими осями кристалла.
Коэффициенты
теплового расширения по трем осям этого эллипсоида называются главными
коэффициентами расширения кристалла.
Если
их обозначит соответственно через α1, α2 и α3, то
коэффициент объемного расширения кристалла
β=α1+α2+α3.
Для
кристаллов с кубической симметрией, так же как и для изотропных тел,
α1=α2=α3=α и β=3α.
Шар,
выточенный из таких тел, остается шаром и после нагревания (разумеется,
большего диаметра).
Коэффициенты
линейного и объемного расширения практически остаются постоянными, если
интервалы температур, в которых они измеряются, малы, а сами температуры
высокие. Вообще же коэффициенты теплового расширения зависят от температуры и
притом так же, как теплоемкость, т.е. при низких температурах коэффициенты α и β уменьшаются
с понижением температуры пропорционально кубу температуры, стремясь, как и
теплоемкость, к нулю при абсолютном нуле.
Коэффициенты
теплового расширения твердых тел обычно очень малы (см. справочные данные; так
как между α
и β существует определенная связь, в таблицах для твердых тел приводится
только коэффициенты линейного расширения). Некоторые вещества имеют особенно
малый коэффициент теплового расширения. Таким свойством отличается, например,
кварц (α=0,5∙10-6 град-1). Такие вещества получили широкое
применение в точном приборостроении.
Экспериментальное
определение коэффициентов теплового расширения осуществляется методами и
приборами дилатометрии (от лат. dilato - расширяю и греч. metreo -
измеряю). В данной работе α определяется
двумя механическими дилатометрами А и Б.
Описание
механического дилатометра А. Прибор А (рис. 3), состоит из станины 1, имеющей с
одной стороны индикатор 2, а с другой стороны крепление, которым закреплен
исследуемый стержень - металлическая трубка 4 определенной длины. Эта трубка с
закрепленной стороны соединена резиновой трубкой 5 с колбой 6, в которой
находится вода. Индикатор имеет цену деления 0,01 мм и он своим штоком
упирается в стенку 3, спаянную с трубкой 4.
Порядок выполнения работы
1. Определяют начальную (комнатную) температуру t0 в 0С.
2. Измеряют начальную длину l0 стержня линейкой в миллиметрах.
. Фиксируют положение стрелки на шкале индикатора (стрелку
индикатора лучше установить на нулевую отметку).
. Ставят колбу с водой, соединенную с исследуемой трубкой, на
электрическую плитку, и включают ее в сеть.
. Нагревают воду в колбе до кипения, пропуская через трубку пары
кипящей воды 10-20 минут.
6. По
лабораторному барометру определяется атмосферное давление Н0 и по таблице
зависимости температуры кипения воды от давления находят температуру кипения
воды t1 при Н0 (Эту температуру можно найти и по формуле 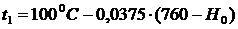 ).
).
. При
пропускании пара через трубку, трубка принимает температуру пара, а увеличение
ее длины Δl при
этом определяется по отклонению стрелки индикатора от первоначального
положения. Отсчет ведется с точностью до половины деления шкалы индикатора,
учитывая, что индикатор имеет цену деления 0,01 мм.
. По
формуле  определяется коэффициент линейного расширения.
определяется коэффициент линейного расширения.
. Опыт
повторяют не менее трех раз. Определяют среднее значение α, абсолютные и относительные погрешности опытов.
Окончательный результат написать в виде α= αср± Δαср.
|
№
|
t0, 0C
|
l0, мм
|
t1, 0C
|
Δl, мм
|
α,
град-1
|
Δα,
град-1
|
(Δαср/ αср)∙100, %
|
|
1
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
Описание механического дилатометра Б. Прибор Б (рис.4) состоит из корпуса
1, к которому крепится защитный кожух 2. Внутри кожуха установлен электрический
нагреватель.
При проведении опытов в нагреватель (через отверстие в крышке
нагревателя) устанавливается стеклянная пробирка 3, наполненной водой на
половину объема. В пробирку 3 помещается испытываемый стержень 4. На корпусе
прибора установлена стойка 5 с кронштейном 6 для крепления индикатора малых
перемещений 7. Кронштейн 6 может поворачиваться вокруг оси стойки на 900. На
панели корпуса расположена индикаторная лампа 8 и кнопочный выключатель 9, а на
задней стенке - винт заземления. Штепсельная вилка 10 служит для включения
прибора в электрическую цепь напряжением 220 В.
Порядок выполнения работы
1. Определить начальную (комнатную) температуру t0 в 0С.
2. Измерить начальную длину l0 стержня линейкой в миллиметрах.
3. Пробирку наполнить на 1/2 объема водой комнатной температуры,
ввести ее в нагреватель через отверстие в крышке и опустить в пробирку
испытуемый стержень сферическим концом вниз.
. Оттянуть шток индикатора вверх, установить индикатор над
пробиркой и опустить шток индикатора в углубление на торце стержня. Кронштейн
закрепить винтом.
. Заметить положение стрелки на шкале индикатора (стрелку лучше
установить на нулевую отметку).
6. Проверить заземление. Штепсельную вилку прибора вставить в
электрическую розетку и включить питание прибора кнопочным включателем. При
этом должна загореться индикаторная лампа.
7. Испытуемый образец твердого тела нагревается в кипящей воде,
находящейся в пробирке, и он принимает температуру кипения воды.
8. По
лабораторному барометру определяется атмосферное давление Н0 и по таблице
зависимости температуры кипения воды от давления находят температуру кипения
воды t1 при Н0 (Эту температуру можно найти и по формуле 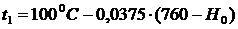 ).
).
. Увеличение
длины Δl
образца определяется по отклонению стрелки индикатора от первоначального
положения. Отсчет ведется с точностью до половины деления шкалы индикатора,
учитывая, что индикатор имеет цену деления 0,01 мм.
. По
формуле  определяется коэффициент линейного расширения.
определяется коэффициент линейного расширения.
. Опыт
повторяют не менее трех раз. Определяют среднее значение α, абсолютные и относительные погрешности опытов.
Окончательный результат написать в виде α= αср± Δαср.
|
№
|
t0, 0C
|
l0, мм
|
t1, 0C
|
Δl, мм
|
α,
град-1
|
Δα,
град-1
|
(Δαср/ αср)∙100, %
|
|
1
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
Контрольные вопросы
1. Порядок выполнения работы.
2. Почему твердые тела при нагревании расширяются?
. Коэффициенты линейного и объемного расширения. Их физический
смысл и единицы измерения. Связь между ними.
. Как можно объяснить, что коэффициенты теплового расширения
различных тел различны?
. Какое практическое значение имеет изучение теплового расширения
тел?
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
2. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
Лабораторная работа № 15
ОПРЕДЕЛЕНИЕ
УДЕЛЬНОЙ ТЕПЛОЕМКОСТИ ТВЕРДЫХ ТЕЛ
Принадлежности: специальная установка для нагревания водяным паром
исследуемого тела, калориметр, термометр, технические весы c разновесами, барометр, сосуд с
водой, электроплитка, исследуемые твердые тела.
Цель работы: ознакомление с процессами теплообмена, составлением
уравнения теплового баланса, законом Дюлонга и Пти, теориями Эйнштейна и Дебая,
определение удельной теплоемкости твердых тел калориметром.
Введение. Важное практическое значение для характеристики тепловых
свойств веществ, конструирования отопительных и охладительных систем, изучения
процессов теплопроводности в технических и природных масштабах, при подборе
материалов для тепловых машин, строительных материалов, для теоретического и
практического изучения акустических параметров веществ имеет определение
удельной теплоемкости твердых, жидких и газообразных тел.
Теория. Внутренняя энергия вещества - это полная энергия частиц,
составляющих данное вещество. Она слагается из кинетической и потенциальной
энергий. Кинетическая энергия - это энергия поступательного, колебательного и
вращательного движения частиц; потенциальная энергия обусловлена силами
притяжения и отталкивания, действующими между частицами. Величина внутренней
энергии меняется при теплообмене. Теплообменом называется переход внутренней
энергии от одного тела к другому вследствие неодинаковости температур этих тел.
При соприкосновении двух тел с различной температурой, молекулы более нагретого
тела, сталкиваясь с молекулами менее нагретого тела, передают им часть своей
кинетической энергии. Такой процесс продолжается до тех пор, пока температура
не станет одинаковой.
Для нагревания различных веществ одинаковой массы потребляется различное
количество теплоты. Например, железный цилиндр нагревается быстрее, чем такая
масса воды. Причина в том, что разные тела имеют разную теплоемкость.
Количество теплоты, необходимое для нагревания вещества на 1 градус (10С
или 1К), называют теплоемкостью. Теплоемкость единицы массы вещества называют
удельной теплоемкостью, 1 моля вещества - молярной теплоемкостью. Если
обозначить удельную теплоемкость через с, массу через m, начальную и конечную температуру тела соответственно через t1 и t2, количество теплоты, необходимое для нагревания тела массой
m от t1 до t2
градусов, через Q, то
 . (1)
. (1)
Твердое
тело представляет собой совокупность колеблющихся частиц, осцилляторов. При
подводе тепла к телу оно расходуется на увеличение энергии колебаний
осцилляторов, которая складывается из кинетической и потенциальной энергий.
Полная энергия одного атома твердого тела равна 3kТ. Если тело
содержит N атомов, то внутренняя энергия тела равна 3NkТ.
Внутренняя энергия одного моля равна 3RT.
При
подводе тепла в условиях постоянного объема все тепло уходит на увеличение
внутренней энергии. Поэтому атомная теплоемкость при постоянном объеме
определяется равенством
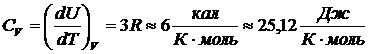 . (2)
. (2)
Из
формулы (2) следует, что атомная теплоемкость (т.е. теплоемкость грамм-атома)
твердых тел есть величина постоянная, одинаковая для всех веществ и не
зависящая от температуры. Это утверждение называется законом Дюлонга и Пти.
Однако опыты показывают, что в действительности эта величина с понижением
температуры уменьшается пропорционально кубу температуры и стремится к нулю при
абсолютном нуле. Наблюдаемая на опыте зависимость теплоемкости от температуры
объясняется теориями Эйнштейна и Дебая.
Описание
прибора и теория метода. Схема прибора для определения удельной теплоемкости
твердых тел калориметром приведена на рис. 1. Сосуд 2 с водой установлен на
электроплитке 1 и при помощи резинового шланга соединен с сосудом 3, в котором
находится исследуемое тело 4. При нагревании воды в сосуде 2 до кипения,
образовавшиеся пары через резиновый шланг идут в сосуд 3 и выходя из него
конденсируются в сосуде с водой 6. При прохождении пара через сосуд 3
исследуемое тело 4 нагревается. Опуская его в воду калориметра 7 и определяя
максимальное отклонение температуры воды при помощи термометра 8, можно
определить удельную теплоемкость исследуемого тела. (Калориметр (от лат. calor
- тепло и греч. metreo - измеряю) в настоящей работе, это - металлический
стакан, снабженный термометром и мешалкой, с внешним пластмассовым кожухом; для
уменьшения потерь за счет теплопроводности между стаканом и внешним кожухом
оставлен воздушный промежуток.)
Если
исследуемое тело, находящееся в парах кипящей воды температурой t2,
опустить в воду калориметра с начальной температурой t1, то через
некоторое время в нем установится общая температура тел t3.
1. Количество теплоты, отданное исследуемым телом при остывании от t2 до t3:
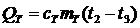 , (3)
, (3)
где
сТ - удельная теплоемкость тела, mT - масса тела.
2. Количество теплоты, получаемое водой при нагревании от t1 до t3:
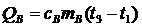 , (4)
, (4)
где
сВ - удельная теплоемкость воды, mВ - масса воды в калориметре.
3. Количество теплоты, получаемое калориметром при нагревании от t1 до t3:
 , (5)
, (5)
где
сК - удельная теплоемкость калориметра, mК - масса
калориметра.
Можно
предположить, что вода калориметра, сам калориметр и тело, теплоемкость
которого измеряется, за время опыта не успевают отдать заметное количество
теплоты окружающим телам. Тогда на основании закона сохранения энергии можно
составить уравнение теплового баланса:
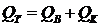 (6)
(6)
или
 .
(7)
.
(7)
Откуда
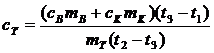 .
(8)
.
(8)
По
формуле (9) можно определить удельную теплоемкость твердого тела.
Порядок выполнения работы
1. Определяется масса калориметра mK путем взвешивания в весах.
2. Наливается вода в калориметр и определяется ее масса mВ (из разности масс
калориметра с водой и без воды).
. Определяется масса mT исследуемого тела.
4. Измеряется начальная температура t1 калориметра с водой.
. Устанавливается исследуемое тело в сосуд 3.
. Включается электроплитка 1 и нагревается вода в сосуде 2 до
кипения.
7. Определяется
температура кипения воды t2 по формуле 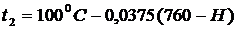 , где Н -
атмосферное давление во время опыта; значение Н берется из лабораторного
барометра (Эту температуру можно определить и по таблице зависимости
температуры кипения воды от давления).
, где Н -
атмосферное давление во время опыта; значение Н берется из лабораторного
барометра (Эту температуру можно определить и по таблице зависимости
температуры кипения воды от давления).
. Спустя
15-20 минут после кипения воды при помощи ручки 5 снимается нагретое до
температуры кипения воды t2 исследуемое тело 4 из сосуда 3 и быстро опускается в
воду калориметра 7. Определяется максимальная температура t3
воды (общая температура воды, калориметра и тела).
. Из
справочных таблиц находятся удельные теплоемкости материала калориметра сК и
воды сВ.
. По
формуле (8) определяется удельная теплоемкость тела сТ.
. Опыт
повторяется не менее трех раз, и определяются среднее значение сТ, абсолютные и
относительные погрешности измерений. Окончательный результат написать в виде
сТ=сТср±ΔсТср.
№ mK,
кг mВ, кг mT, кг t1, 0С t2, 0С t, 0С сК,
 сВ,
сВ,
 сТ,
сТ,
 ΔсТ,
ΔсТ,

Контрольные вопросы
1. Ход выполнения работы.
2. Уравнение теплового баланса для системы «калориметр-вода-твердое
тело».
. Теплоемкость и удельная теплоемкость.
. Классическая теория теплоемкости (Закон Дюлонга и Пти).
. Понятие о квантовой теории теплоемкости (теории Эйнштейна и
Дебая).
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
2. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
. Физический
практикум. Механика и молекулярная физика. / Под ред. проф. В.И.Ивероновой. М.:
Наука, 1967. 352 c.
Лабораторная работа № 16
ОПРЕДЕЛЕНИЕ
ИЗМЕНЕНИЕ ЭНТРОПИИ ЗАМКНУТОЙ СИСТЕМЫ
Принадлежности: специальная установка, электроплитка, калориметр с
мешалкой, набор исследуемых тел, технические весы с разновесами, термометр,
барометр.
Цель работы: ознакомление со вторым законом термодинамики, понятием
энтропии и определение изменения энтропии изолированной системы.
Введение. Энтропия имеет фундаментальное значение в физике. Изучение
энтропии имеет особое значение для конструкции тепловых машин и определения их
КПД, для изучения процессов теплообмена в больших масштабах, для изучения
обратимых, необратимых и адиабатических процессов, для вычисления
термодинамических потенциалов химических реакций и тепловых эффектов фазовых
переходов и др.
Краткая теория. Функция состояния, дифференциалом которой является
отношение количества теплоты δQ к той абсолютной температуре Т, при которой это тепло было
получено (или отдано), называется энтропией (от греч. «entropia» - поворот, возвращение) и
обозначается S:
 . (1)
. (1)
Для
двух состояний термодинамической системы изменение энтропии определяется по
формуле:
 (2)
(2)
В
качестве примера по формуле (2) можно подсчитать изменение энтропии при
плавлении 1 кмоля (18 кг) льда. Известно, что удельная теплота плавления льда
равна 3,35×105 Дж/кг, а плавление льда происходит при постоянной
температуре 273 К. Тогда  будет равен количеству теплоты, необходимой для
плавления одного кмоля льда:
будет равен количеству теплоты, необходимой для
плавления одного кмоля льда:
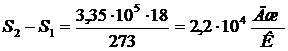 .
.
Согласно
Больцману, энтропия S однозначно связана с термодинамической вероятностью
состояния W (число способов, которыми может быть реализовано
данное состояние макроскопической системы, или число микросостояний,
осуществляющих данное макросостояние), а именно энтропия пропорциональна
логарифму термодинамической вероятности W состояния
системы:
 . (3)
. (3)
Возрастание
энтропии означает возрастание вероятности состояния системы. Таким образом,
энтропия может рассматриваться как мера вероятности состояния термодинамической
системы. Формула Больцмана (3) позволяет дать энтропии следующее статистическое
толкование: энтропия является мерой неупорядоченности системы.
Согласно
второму закону термодинамики, в процессах, происходящих в замкнутой
(изолированной) системе, энтропия не убывает: DS≥0 (Неравенство Клаузиуса): если процесс
обратим, то DS=0,
если необратим, то DS>0.
Энтропия
обладает свойством аддитивности: энтропия системы равна сумме энтропий тел,
входящих в систему:
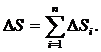 (4)
(4)
Описание
экспериментальной установки и теория метода. Схема экспериментальной установки
приведена на рис. 1.
Бачок
1 с водой установлен на электроплитке 2. Исследуемое тело 3 помещается в объем
4. Теплообмен происходит при опускании исследуемое тело 3, нагретого до
температуры Т2 (температура кипения воды), в воду, находящуюся в калориметре 5
при температуре Т1. В калориметре в теплообмене участвуют четыре тела:
исследуемое тело массой mТ, удельной теплоемкостью сТ и начальной температурой
Т2; внутренний стакан калориметра 5 массой mК, удельной
теплоемкостью сК и начальной температурой Т1; мешалка 6 массой mМ,
удельной теплоемкостью сМ и начальной температурой Т1; находящаяся в
калориметре вода массой mВ, удельной теплоемкостью сВ и начальной температурой
Т1.
После
теплообмена установится температура Т3. При этом энтропия каждого из тел
(соответственно исследуемого тела, калориметра, мешалки и воды) изменится
следующим образом (учтено, что  ):
):
 ,
,
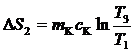 ,
,


Изменение
энтропии всей системы по (4) равно:
 (5)
(5)
Так
как процесс происходит в калориметре, т.е. без теплообмена с окружающей средой,
то систему можно считать замкнутой (те. адиабатно изолированной) и по 2-закону
термодинамики для необратимых процессов в этой системе DS>0. (Все
реальные процессы - необратимые.)
Порядок выполнения работы
1. Определяются массы калориметра mК, мешалки mМ и
исследуемого тела mТ.
2. Наливается вода в калориметр и определяется масса этой воды mВ (из разности масс калориметра с
водой и без воды).
. При помощи термометра определяется начальная температура Т1
исследуемого тела, калориметра, мешалки и воды.
. Исследуемое тело устанавливается в объеме 4 (см. рис.1).
. Включается электроплитка 2 и нагревается вода в бачке 1 до
кипения. По лабораторному барометру определяется атмосферное давление Н0 и по
формуле Т2=373К - 0,0375(760 - Н0) вычисляется температура кипения воды Т2 (Эту
температуру можно определить и по таблице зависимости температуры кипения воды
от давления).
. Через 15-20 минут после того, как закипит вода в бачке 1,
нагретое до температуры Т2 тело 3 выталкивается в калориметр 5 и, перемешивая
мешалкой 6 воду в калориметре, следят за изменением температуры воды в
калориметре. Определяется наибольшее значение конечной температуры Т3.
7. Из справочных таблиц находятся удельные теплоемкости исследуемого
тела сТ, калориметра сК, мешалки сМ и воды сВ.
8. По формуле (5) находится изменение энтропии системы.
9. Опыт повторяется не менее трех раз. Определяются среднее значение
DS, абсолютные δ
и относительные N погрешности измерений. Результаты
всех измерений и вычислений заносятся в таблицу. Окончательный результат
приводится в виде DS=DSср±δср.
|
№
|
mК, кг
|
mМ, кг
|
mТ, кг
|
mВ, кг
|
Т1, К
|
Т2, К
|
Т3, К
|
сТ
|
сК
|
сМ
|
сВ
|
DS,
Дж/К
|
δ,
Дж/К
|
N, %
|
|
|
|
|
|
|
|
|
Дж/(кг∙К)
|
|
|
|
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Среднее значение
|
|
|
|
Контрольные вопросы
1. Порядок выполнения работы.
2. Какие можно сделать выводы на основе изменений энтропии тел,
входящих в систему?
. Второй закон термодинамики.
. Физический смысл энтропии.
Литература
1. Кикоин
А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 480 с.
2. Сивухин
Д.В. Общий курс физики. Т.II.
Термодинамика и молекулярная физика. М.: Наука, 1990. 592 с.
. Физический
практикум. Механика и молекулярная физика. / Под ред. проф. В.И.Ивероновой. М.:
Наука, 1967. 352 c.
ПРИЛОЖЕНИЕ
ЗНАЧЕНИЯ НЕКОТОРЫХ ФИЗИЧЕСКИХ ВЕЛИЧИН
Таблица 1. Некоторые фундаментальные физические постоянные
|
Физическая постоянная
|
Приближенное числовое
значение
|
|
Атомная единица массы
|
а.е.м.=1,6606∙10-27
кг
|
|
Гравитационная постоянная
|
G=6,67∙10-11
Н∙м2/кг2
|
|
Нормальное ускорение
свободного падения
|
g=9,81 м/с2
|
|
Молярный объем идеального
газа при нормальных условиях
|
Vμ0=22,4∙10-3 м3/моль
|
|
Постоянная Авогадро
|
NА=6,022∙1023 моль-1
|
|
Постоянная Больцмана
|
kБ=R/NA=1,38∙10-23 Дж/К
|
|
Постоянная Планка
|
h=6,626∙10-34 Дж∙с
|
|
Скорость звука в воздухе в
нормальных условиях
|
υз=331,46 м/с
|
|
Скорость света в вакууме
|
с=3,00∙108 м/с
|
|
Универсальная газовая
постоянная
|
R=NA∙kБ=8,31 Дж/(моль∙К)
|
Таблица 2. Плотность (ρ) газов и паров при нормальном давлении
и температуре 0 0С
|
Вещество
|
ρ,
кг/м3
|
|
Вещество
|
ρ,
кг/м3
|
|
Азот
|
1,2505
|
|
Озон
|
2,144
|
|
Аммиак
|
0,77146
|
|
Окись углерода (СО)
|
1,2504
|
|
Аргон
|
1,7830
|
|
Пропан
|
2,02
|
|
Ацетилен
|
1,1716
|
|
Сероводород (пар)
|
1,5362
|
|
Водород
|
0,08988
|
|
Спирт метиловый (пар)
|
1,426
|
|
Водяной пар насыщенный (при
100 0С)
|
0,589
|
|
Спирт этиловый (пар)
|
2,043
|
|
Воздух сухой
|
1,2928
|
|
Фтор
|
1,696
|
|
Гелий
|
0,17846
|
|
Хлор
|
3,214
|
|
Двуокись углерода (СО2)
|
1,9769
|
|
Хлороформ
|
5,639
|
|
Кислород
|
1,42895
|
|
Этан
|
1,357
|
|
Метан
|
0,7168
|
|
Этилен
|
1,2604
|
Таблица 3. Плотность (ρ) некоторых жидкостей при нормальном
давлении и температуре 20 0С
|
Жидкость
|
ρ, 103 кг/м3
|
|
Жидкость
|
ρ, 103 кг/м3
|
|
Ацетон
|
0,792
|
|
Масло креозот
|
1,04 - 1,10
|
|
Бензин
|
0,68 - 0,72
|
|
Масло машинное
|
0,90 - 0,92
|
|
Бензол
|
0,879
|
|
Масло оливковое
|
0,92
|
|
Вода
|
0,99823
|
|
Масло смазочное
|
0,90 - 0,92
|
|
Вода (дистиллированная при
4 0С)
|
1,000
|
|
Масло парафиновое
|
0,87 - 0,88
|
|
Глицерин
|
1,26
|
|
Масло скипидарное
|
0,87
|
|
Керосин
|
0,82
|
|
Нефть
|
0,81 - 0,85
|
|
Масло вазелиновое
|
0,8
|
|
Ртуть
|
13,55
|
|
Масло касторовое
|
0,96
|
|
Спирт этиловый
|
0,7893
|
Таблица 4. Плотность (ρ) некоторых элементов и сплавов при
нормальном давлении и температуре 20 0С
|
Элемент или сплав
|
ρ, 103 кг/м3
|
|
Элемент или сплав
|
ρ, 103 кг/м3
|
|
Алюминий
|
2,70
|
|
Олово
|
7,29
|
|
Бронза
|
8,7 - 8,9
|
|
Платина
|
21,37
|
|
Вольфрам
|
19,3
|
|
Свинец
|
11,34
|
|
Железо (чистое)
|
7,87
|
|
Серебро
|
10,5
|
|
Золото
|
19,3
|
|
Сталь
|
7,7 - 7,9
|
|
Кремний аморфный
|
2,35
|
|
Углерод (алмаз)
|
3,52
|
|
Кремний кристаллический
|
2,42
|
|
Углерод (графит)
|
2,25
|
|
Латунь
|
8,4
|
|
Хром
|
7,1
|
|
Медь
|
8,93
|
|
Чугун
|
6,6 - 7,3
|
Таблица 5. Плотность (ρ) некоторых твердых веществ при
нормальном давлении и температуре 20 0С
|
Вещество
|
ρ, 103 кг/м3
|
|
Вещество
|
ρ, 103 кг/м3
|
|
Асбест
|
2,0 - 2,8
|
|
Лед (при 0 0С)
|
0,917
|
|
Бетон
|
2,3
|
|
Мел
|
1,9 - 2,8
|
|
Бумага
|
0,7 - 1,2
|
|
Парафин
|
0,82 - 0,91
|
|
Глина
|
1,8 - 2,6
|
|
Пластмасса
|
1,1 - 2,4
|
|
Графит
|
0,9 - 2,3
|
|
Пробка
|
0,22 - 0,26
|
|
Деготь, смола
|
1,02
|
|
Резина
|
0,91 - 0,93
|
|
Дерево
|
0,3 - 0,9
|
|
Слюда обычная
|
2,6 - 3,2
|
|
Картон
|
0,69
|
|
Стекло обыкновенное
|
2,4 - 2,8
|
|
Каучук
|
0,92 - 0,96
|
|
Стекло флинтглас
|
3,9 - 5,9
|
|
Кварц плавленый
|
2,66
|
|
Целлулоид
|
1,4
|
Таблица 6. Некоторые постоянные газов (при 1 атм): вязкость η
(при 150С), удельная
теплоемкость ср (при 200С),  (при 20 0С)
(при 20 0С)
|
Вещество
|
Формула
|
η,
10-6 Па∙с
|
ср, 103 Дж/(кг∙К)
|

|
|
Азот
|
N2
|
17,4
|
1,051
|
1,40
|
|
Аммиак
|
NH3
|
9,70
|
2,244
|
1,31
|
|
Водород
|
Н2
|
8,71
|
14,269
|
1,41
|
|
Водяной пар
|
Н2О
|
9,26
|
2,011§§
|
1,324§§§
|
|
Воздух
|
-
|
17,90
|
1,40
|
|
Гелий
|
Не
|
19,43
|
5,296
|
1,66
|
|
Закись азота
|
N2O
|
14,6§
|
0,913
|
1,27
|
|
Кислород
|
О2
|
20,03
|
0,913
|
1,40
|
|
Метан
|
СН4
|
10,77
|
2,483
|
1,31
|
|
Неон
|
Ne
|
31,2§
|
1,038
|
1,68
|
|
Окись азота
|
NO
|
18,8§
|
0,976
|
1,40
|
|
Окись углерода
|
CO
|
17,5§
|
1,047
|
1,40
|
|
Углекислый газ
|
CO2
|
14,48
|
0,837
|
1,30
|
§ η при 200С; §§  при 100-5000С; §§§
γ при 1000С.
при 100-5000С; §§§
γ при 1000С.
Таблица 7. Термический коэффициент давления (γ)
некоторых веществ
|
Вещество
|
γ,
10-6 град-1
|
|
Вещество
|
γ,
10-6 град-1
|
|
Бензин
|
950
|
|
Керосин
|
900
|
|
Вода
|
210
|
|
Ртуть
|
180
|
|
Воздух (и др. газы)
|
3400
|
|
Этиловый спирт
|
1100
|
|
Глицерин
|
500
|
|
|
|
Таблица 8. Средняя длина свободного пробега молекул ( ) некоторых газов при 250С и 101325
Па
) некоторых газов при 250С и 101325
Па
|
Газ
|
 , 10-7 м , 10-7 м
|
|
Газ
|
 , 10-7 м , 10-7 м
|
|
Азот
|
0,67
|
|
Кислород
|
0,71
|
|
Аргон
|
0,67
|
|
Криптон
|
0,53
|
|
Водород
|
1,23
|
|
Ксенон
|
0,39
|
|
Воздух
|
0,67
|
|
Неон
|
1,38
|
|
Гелий
|
1,94
|
|
Двуокись углерода (СО2)
|
0,44
|
Таблица 9. Коэффициент объемного расширения (β)
газов и некоторых
жидкостей при t = 20 0С
|
Жидкость
|
β,
10-4 град-1
|
|
Жидкость
|
β,
10-4 град-1
|
|
Вода при 50С
|
0,17
|
|
Глицерин
|
5,0
|
|
Вода при 100С
|
0,95
|
|
Керосин (0-100 0С)
|
9,0
|
|
Вода при 200С
|
2,10
|
|
Нефть (0-100 0С)
|
7 - 10
|
|
Вода при 400С
|
3,90
|
|
Ртуть (0-100 0С)
|
1,82
|
|
Вода при 600С
|
5,30
|
|
Спирт этиловый
|
11,0
|
|
Газы (β=1/Т)
|
34
|
|
Трансформаторное масло
|
6
|
Таблица 10. Вязкость (η) некоторых жидкостей при нормальном
давлении и температуре 20 0С
|
Жидкость
|
η,
10-3 Па·с
|
|
Жидкость
|
η,
10-3 Па·с
|
|
Вода
|
1,005
|
|
Масло машинное тяжелое
|
660
|
|
Глицерин
|
1480
|
|
Масло трансформаторное
|
19,8
|
|
Керосин
|
1,8
|
|
Ртуть
|
1,554
|
|
Масло касторовое
|
987
|
|
Спирт этиловый
|
1,20
|
|
Масло машинное легкое
|
113
|
|
|
|
Таблица 11. Коэффициент поверхностного натяжения (σ) некоторых жидкостей при 200С
|
Жидкость
|
σ, 10-3 Н/м
|
|
Жидкость
|
σ, 10-3 Н/м
|
|
Анилин
|
42,7
|
|
Масло касторовое
|
33,1
|
|
Ацетон
|
23,7
|
|
Масло оливковое
|
33,06
|
|
Бензол
|
29,0
|
|
Мыльная вода
|
40
|
|
Вода
|
72,58
|
|
Нефть
|
30
|
|
Глицерин
|
63,4
|
|
Ртуть
|
510
|
|
Керосин
|
24,0
|
|
Спирт этиловый
|
22,3
|
Таблица 12. Удельная теплоемкость при постоянном давлении (ср) некоторых
жидкостей при 200С и 1 атм.
|
Жидкость
|
ср, Дж/(кг∙К)
|
|
Жидкость
|
ср, Дж/(кг∙К)
|
|
Вода
|
4182
|
|
Масло трансформаторное
|
1880
|
|
Глицерин
|
2430
|
|
Масло хлопковое
|
1737
|
|
Керосин
|
2085
|
|
Ртуть
|
139
|
|
Масло касторовое
|
2219
|
|
Спирт этиловый
|
2470
|
Таблица 13. Температура кипения воды (в 0С) при разных давлениях
|
Барометрическое давление Н,
мм рт. ст.
|
|
680
|
690
|
700
|
710
|
720
|
730
|
740
|
750
|
760
|
770
|
780
|
790
|
|
0
|
96,92
|
7,32
|
7,71
|
8,11
|
8,49
|
8,88
|
9,26
|
9,63
|
100,00
|
0,37
|
0,73
|
1,09
|
|
1
|
6,96
|
7,36
|
7,75
|
8,14
|
8,53
|
8,91
|
9,29
|
9,67
|
0,04
|
0,40
|
0,76
|
1,12
|
|
2
|
7,00
|
7,40
|
7,79
|
8,18
|
8,57
|
8,95
|
9,33
|
9,70
|
0,07
|
0,44
|
0,80
|
1,16
|
|
3
|
7,04
|
7,44
|
7,83
|
8,22
|
8,61
|
8,99
|
9,37
|
9,74
|
0,11
|
0,48
|
0,84
|
1,19
|
|
4
|
7,08
|
7,48
|
7,87
|
8,26
|
8,65
|
9,03
|
9,41
|
9,78
|
0,15
|
0,51
|
0,87
|
1,23
|
|
5
|
7,12
|
7,52
|
7,91
|
8,30
|
8,69
|
9,07
|
9,44
|
9,82
|
0,18
|
0,55
|
0,91
|
1,26
|
|
6
|
7,16
|
7,56
|
7,95
|
8,34
|
8,72
|
9,10
|
9,48
|
9,85
|
0,22
|
0,58
|
0,94
|
1,30
|
|
7
|
7,20
|
7,60
|
7,99
|
8,38
|
8,76
|
9,14
|
9,52
|
9,89
|
0,26
|
0,62
|
0,98
|
1,33
|
|
8
|
7,24
|
7,63
|
8,03
|
8,42
|
8,80
|
9,18
|
9,56
|
9,93
|
0,29
|
0,66
|
1,02
|
1,37
|
|
9
|
7,28
|
7,67
|
8,07
|
8,45
|
8,84
|
9,22
|
9,59
|
9,96
|
0,33
|
0,69
|
1,05
|
1,41
|
|
10
|
7,32
|
7,71
|
8,11
|
8,49
|
8,88
|
9,26
|
9,63
|
0,00
|
0,37
|
0,73
|
1,09
|
1,44
|
Таблица 14. Давление и плотность насыщающего водяного пара при разных
температурах
|
t, 0C
|
p, мм рт. ст.
|
ρ,
г/м3
|
t, 0C
|
ρ,
г/м3
|
t, 0C
|
p, мм рт. ст.
|
ρ,
г/м3
|
|
-30
|
0,28
|
0,33
|
0
|
4,58
|
4,84
|
27
|
26,74
|
25,8
|
|
-29
|
0,31
|
0,37
|
1
|
4,93
|
5,22
|
28
|
28,35
|
27,2
|
|
-28
|
0,35
|
0,41
|
2
|
5,29
|
5,60
|
29
|
30,04
|
28,7
|
|
-27
|
0,38
|
0,46
|
3
|
5,60
|
5,98
|
30
|
31,82
|
30,3
|
|
-26
|
0,43
|
0,51
|
4
|
6,10
|
6,40
|
31
|
33,70
|
32,1
|
|
-25
|
0,47
|
0,55
|
5
|
6,54
|
6,84
|
32
|
35,66
|
33,9
|
|
-24
|
0,52
|
0,60
|
6
|
7,01
|
7,3
|
33
|
37,73
|
35,7
|
|
-23
|
0,58
|
0,66
|
7
|
7,51
|
7,8
|
34
|
39,90
|
37,6
|
|
-22
|
0,64
|
0,73
|
8
|
8,05
|
8,3
|
35
|
42,18
|
39,6
|
|
-21
|
0,70
|
0,80
|
9
|
8,61
|
8,8
|
36
|
44,56
|
41,8
|
|
-20
|
0,77
|
0,88
|
10
|
9,21
|
9,4
|
37
|
47,07
|
44,0
|
|
-19
|
0,85
|
0,96
|
11
|
9,84
|
10,0
|
38
|
49,69
|
46,3
|
|
-18
|
0,94
|
1,05
|
12
|
10,52
|
10,7
|
39
|
52,44
|
48,7
|
|
-17
|
1,03
|
1,15
|
13
|
11,23
|
11,4
|
40
|
55,32
|
51,2
|
|
-16
|
1,13
|
1,27
|
14
|
11,99
|
12,1
|
45
|
71,88
|
65,4
|
|
-15
|
1,24
|
1,38
|
15
|
12,79
|
12,8
|
50
|
92,5
|
83,0
|
|
-14
|
1,36
|
1,51
|
16
|
13,63
|
13,6
|
55
|
118,0
|
104,3
|
|
-13
|
1,49
|
1,65
|
17
|
14,53
|
14,5
|
60
|
149,4
|
130
|
|
-12
|
1,63
|
1,80
|
18
|
15,48
|
15,4
|
65
|
187,5
|
161
|
|
-11
|
1,78
|
1,96
|
19
|
16,48
|
16,3
|
70
|
233,7
|
198
|
|
-10
|
1,95
|
2,14
|
20
|
17,54
|
17,3
|
75
|
289,1
|
242
|
|
-9
|
2,13
|
2,33
|
21
|
18,65
|
18,3
|
80
|
355,1
|
293
|
|
-8
|
2,32
|
2,54
|
22
|
19,83
|
19,4
|
85
|
433,6
|
354
|
|
-7
|
2,53
|
2,76
|
23
|
21,07
|
20,6
|
90
|
525,8
|
424
|
|
-6
|
2,76
|
2,99
|
24
|
22,38
|
21,8
|
95
|
633,9
|
505
|
|
-5
|
3,01
|
3,24
|
25
|
23,76
|
23,0
|
100
|
760,0
|
598
|
|
-4
|
3,28
|
3,51
|
26
|
25,21
|
24,4
|
|
|
|
|
-3
|
3,57
|
3,81
|
|
|
|
|
|
|
|
-2
|
3,88
|
4,13
|
|
|
|
|
|
|
|
-1
|
4,22
|
4,47
|
|
|
|
|
|
|
Таблица 15. Психрометрическая таблица относительной влажности воздуха (в
%)
|
Показания сухого
термометра, 0С
|
Разность показаний сухого и
влажного термометров, 0С
|
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
0
|
100
|
81
|
63
|
45
|
28
|
11
|
|
|
|
|
|
|
1
|
100
|
83
|
65
|
48
|
32
|
16
|
|
|
|
|
|
|
2
|
100
|
84
|
68
|
51
|
35
|
20
|
|
|
|
|
|
|
3
|
100
|
84
|
69
|
54
|
39
|
24
|
10
|
|
|
|
|
|
4
|
100
|
85
|
70
|
56
|
42
|
28
|
14
|
|
|
|
|
|
5
|
100
|
86
|
72
|
58
|
45
|
32
|
19
|
6
|
|
|
|
|
6
|
100
|
86
|
73
|
60
|
47
|
35
|
23
|
10
|
|
|
|
|
7
|
100
|
87
|
74
|
61
|
49
|
37
|
26
|
14
|
|
|
|
|
8
|
100
|
87
|
75
|
63
|
51
|
40
|
28
|
18
|
7
|
|
|
|
9
|
100
|
88
|
76
|
64
|
53
|
42
|
31
|
24
|
|
|
|
10
|
100
|
88
|
76
|
65
|
54
|
44
|
34
|
24
|
14
|
4
|
|
|
11
|
100
|
88
|
77
|
66
|
56
|
46
|
36
|
26
|
17
|
8
|
|
|
12
|
100
|
89
|
78
|
68
|
57
|
48
|
38
|
29
|
20
|
11
|
|
|
13
|
100
|
89
|
79
|
69
|
59
|
49
|
40
|
31
|
23
|
14
|
6
|
|
14
|
100
|
90
|
79
|
70
|
60
|
51
|
42
|
33
|
25
|
17
|
9
|
|
15
|
100
|
90
|
80
|
71
|
61
|
52
|
44
|
36
|
27
|
20
|
12
|
|
16
|
100
|
90
|
81
|
71
|
62
|
54
|
45
|
37
|
30
|
22
|
15
|
|
17
|
100
|
90
|
81
|
72
|
64
|
55
|
47
|
39
|
32
|
24
|
17
|
|
18
|
100
|
91
|
82
|
73
|
64
|
56
|
48
|
41
|
34
|
26
|
20
|
|
19
|
100
|
91
|
82
|
74
|
65
|
58
|
50
|
43
|
35
|
29
|
22
|
|
20
|
100
|
91
|
83
|
74
|
66
|
59
|
51
|
44
|
37
|
30
|
24
|
|
21
|
100
|
91
|
83
|
75
|
67
|
60
|
52
|
46
|
39
|
32
|
26
|
|
22
|
100
|
92
|
83
|
76
|
68
|
61
|
54
|
47
|
40
|
34
|
28
|
|
23
|
100
|
92
|
84
|
76
|
69
|
61
|
55
|
48
|
42
|
36
|
30
|
|
24
|
100
|
92
|
84
|
77
|
69
|
62
|
56
|
49
|
43
|
37
|
31
|
|
25
|
100
|
92
|
84
|
77
|
70
|
63
|
57
|
50
|
44
|
38
|
33
|
|
26
|
100
|
92
|
85
|
78
|
71
|
64
|
58
|
50
|
45
|
40
|
34
|
|
27
|
100
|
92
|
85
|
78
|
71
|
65
|
59
|
52
|
47
|
41
|
36
|
|
28
|
100
|
93
|
85
|
78
|
72
|
65
|
59
|
53
|
48
|
42
|
37
|
|
29
|
100
|
93
|
86
|
79
|
72
|
66
|
60
|
54
|
49
|
43
|
38
|
|
30
|
100
|
93
|
86
|
79
|
73
|
67
|
61
|
55
|
50
|
44
|
39
|
Таблица 16. Удельная теплота парообразования некоторых жидкостей (при
нормальном давлении и температуре кипения)
|
Жидкость
|
L, 103 Дж/кг
|
|
Жидкость
|
L, 103 Дж/кг
|
|
Бензол
|
394
|
|
Керосин
|
210-230
|
|
Вода
|
2260
|
|
Кислород жидкий
|
214
|
|
Водород жидкий
|
452
|
|
Спирт этиловый
|
855
|
Таблица 17. Коэффициент линейного расширения
(α) некоторых
твердых веществ при 20 0С
|
Вещество
|
α,
10-6 град-1
|
|
Вещество
|
α,
10-6 град-1
|
|
Алмаз
|
1,2
|
|
Медь
|
16,2
|
|
Бетон
|
10 - 14
|
|
Никель
|
12,6
|
|
Алюминий
|
22,4
|
|
Нихром
|
13,0
|
|
Бронзы
|
17,0 - 19,6
|
|
Олово
|
21,4
|
|
Бумага
|
10
|
|
Парафин
|
130
|
|
Вольфрам
|
4,5
|
|
Платина
|
8,9
|
|
Гранит
|
6 - 9
|
|
Полистирол
|
60 - 80
|
|
Графит
|
3,5 - 8
|
|
Полиэтилен
|
100 - 200
|
|
Железо
|
11,7
|
|
Свинец
|
27,6
|
|
Золото
|
14,2
|
|
Серебро
|
19,5
|
|
Инвар
|
1,5
|
|
Сталь (0,05% С)
|
11
|
|
Кварц
|
0,5
|
|
Стекло кварцевое
|
0,56
|
|
Кремний
|
7
|
|
Стекло оконное
|
9,5
|
|
Латуни
|
17,0 - 21,2
|
|
Фарфор
|
3,4 - 4,1
|
|
Лед (от -20 до 00С)
|
51
|
|
Чугун
|
10,0
|
Таблица 18. Удельная теплоемкость при постоянном давлении (ср) некоторых
твердых веществ при 200С и 1 атм.
|
Вещество
|
ср, Дж/(кг∙К)
|
|
Вещество
|
ср, Дж/(кг∙К)
|
|
Алюминий
|
896
|
|
Олово (при 00С)
|
225
|
|
Бронза
|
420
|
|
Парафин
|
2890
|
|
Железо
|
452
|
|
Свинец (при 00С)
|
128
|
|
Латунь
|
390
|
460
|
|
Лед (при 00С)
|
2122
|
|
Стекло оконное
|
670
|
|
Медь
|
383
|
|
Чугун
|
540
|
ЛАБОРАТОРНЫЙ
ПРАКТИКУМ
ПО
МОЛЕКУЛЯРНОЙ ФИЗИКЕ
Редактор К.Мелиев
Корректор М.Рузибоев
Тех.редактор О.Арнст
____.____.2009 йилда босишга рухсат этилди.
№ ___ буюртма ____ босма табоš,
ќажми 60х84 1,16. Адади 100 нусха
_________________________________________________
СамДУ босмахонасида чоп этилди.
, Самарšанд ш., Университет хиёбони, 15.