Хирургическое вмешательство в области брюшной стенки
Содержание
1. Показания и противопоказания к операции
2. Общая подготовка животного к операции
3. Частная подготовка животного к операции
4. Подготовка рук хирурга, инструментов, шовного, перевязочного
материала и хирургического белья
5. Фиксация животного
6. Анатомо-топографические данные оперируемой области
7. Обезболивание
8. Оперативный доступ
9. Оперативный прием
10. Заключительный этап операции
11. Послеоперационное лечение
12. Содержание, уход и кормление оперированного животного
Список использованной литературы
Регистрационные
данные о животном
1. Вид животного - лошадь
. Пол - кобыла
. Возраст - 15 лет
. Масть - рыжая
. Кличка (номер) - …….
. Порода - белорусская упряжная
. Упитанность - средняя
. Температура 37,6 ͦС, пульс 30 уд. \мин.,
дыхание 12 р. \мин.
. Кому принадлежит - ……………Гродненская область
. Дата операции - 4.09.2013г.
. Осложнения - без осложнений
. Исход - благоприятный
1. Показания
и противопоказания к операции
Показания: операции в области брюшной стенки у лошади [11],
операции в области подвздоха и на прилегающих участках (лапаротомия,
руменотомия, кесарево сечение, операции на соответствующих отделах кишечника,
при брюшных грыжах). [4]
Противопоказания к операции: общие для любого хирургического
вмешательства (старый возраст, истощение, поздний срок жеребости, либо
состояние половой охоты, наличие гнойных процессов в области предполагаемой
операции, повышенная температура тела и т. д). Также проведение операций
запрещено в хозяйствах при наличии инфекционной болезни, к которой восприимчив
данный вид животных, до снятия карантина.
Нельзя проводить операцию, если нет соответствующих условий
для послеоперационного содержания животных. В период массовой вакцинации, а
также за две недели, до и после окончания обработки животных, проведение
операции запрещено.
Оперативные случаи, требующие экстренного вмешательства
(угроза жизни животного) являются исключениями. [5]
Показанием для проведения обезболивания нервов брюшной стенки
у данного животного явилась необходимость проведения кесарева сечения у лошади.
Противопоказаний в данном случае для проведения хирургических
манипуляций нет.
2.
Общая подготовка животного к операции
Общая подготовка животного к операции заключается в
следующем:
перед операцией у животного проводят клинические исследования,
в частности, измеряют температуру тела, дыхание, частоту пульса. Нельзя
проводить операцию у животных с повышенной температурой, не рекомендуется также
ее проводить при наличии инфекционных заболеваний, у истощенных животных;
если операцию проводят не в срочном порядке, то перед ней
животному уменьшают дачу корма и, если это возможно, то назначают голодную
диету не более чем на 12 ч;
перед операцией животных выгуливают с целью освобождения
толстого отдела кишечника и мочевого пузыря, проводят чистку или частичное
обезболивание;
при необходимости повышают свертываемость крови и
резистентность организма путем введения животному соответствующих препаратов.
[5,8]
В данном случае общую подготовку животного к операции провели
следующим образом:
) провели общее клиническое исследование и установили, что
все показатели находятся в пределах физиологической нормы, общее состояние
животного удовлетворительное; местность благополучна по инфекционным
заболеваниям лошадей;
) операцию (кесарево сечение) необходимо было провести как
можно быстрее, для предотвращения гибели животного и плода, поэтому к
обезболиванию брюшной стенки приступили без голодной выдержки животного, моцион
не предоставляли.
3. Частная
подготовка животного к операции
Частная подготовка к обезболиванию нервов брюшной полости у
лошади сводится к подготовке операционного поля.
Обработка операционного поля включает
четыре основных момента: удаление волосяного покрова, механическую очистку с
обезжириванием, дезинфекцию (асептизация) поверхности с дублением и изоляцию от
окружающих участков тела.
операция брюшная стенка лошадь
Волосяной покров выстригают или сбривают.
Последнее имеет большое преимущество, так как дезинфекция кожи может быть
сделана с большей тщательностью. Удобнее всего пользоваться обычной безопасной
бритвой, причем у пластинки, которой закрепляют лезвие, спиливают зубцы,
оставляя только по одному на краях каждой стороны станочка. Такую обработку
легче осуществить уже на фиксированном животном после наркоза или
транквилизации.
Дезинфекцию операционного поля проводят
следующим образом. Сначала кожу обезжиривают и очищают механическим путем,
протирая ее в течение 1-2 мин стерильным марлевым тампоном, пропитанным 0,5%
раствором нашатырного спирта или бензином, а затем кожу обрабатывают дважды
(дубят и дезинфицируют) 5% -ным спиртовым раствором йода сначала после
технической очистки, а затем непосредственно перед разрезом или после
инфильтрационной анестезии (способ Н.М. Филончикова). Раствор йода можно
заменить 5% -ным водным раствором танина, 5% -ным водным раствором пикриновой
кислоты, 10% водным раствором калия перманганата, 1% -ным спиртовым раствором
бриллиантовой зелени. В крайнем случае обрабатывают только 96% -ным этиловым
спиртом. [4]
Также существуют следующие способы
подготовки операционного поля.
Способ Мыша заключается в том, что
после бритья, механической очистки и обезжиривания поле операции обрабатывают
10% -ным водным раствором перманганата калия.
Способ Борхерса основан на применении 5%
-ного раствора формалина в 96°-ном спирте после механической очистки, бритья и
обезжиривания кожи. Способ позволяет добиться (в отличие от большинства других
способов) стерильности в белковой среде (при загрязнении гноем), поскольку
формалин сохраняет при этом свои антисептические свойства.
При обработке операционного поля
поверхность кожи протирают и смазывают в определенном порядке - от центральной
части к периферии. Исключение составляет наличие вскрытого гнойного очага. В
этом случае обрабатывают от периферии к центру.
При большинстве операций операционное поле
изолируют стерильными простынями или полотенцами, которые прикрепляют один к
другому специальными клеммами, а к коже цапками. В отдельных случаях применяют
прорезиненный материал. Как правило, в центре изолирующей простыни делают
отверстие, которое должно совпадать и укрепляться в соответствии с местом
предполагаемого разреза тканей. Остальной частью простыни по возможности шире
прикрывают тело животного, защищая место операции от случайного загрязнения
шерстью, пылью и др.
Слизистые оболочки обрабатывают несколько
иначе. Конъюнктиву глаз промывают раствором этакридина (риванола) 1: 1000;
слизистые оболочки ротовой и носовой полостей промывают тем же раствором и
затем смазывают 5% -ным спиртовым раствором йода кожу в окружности входа в эти
полости. Слизистые десен смазывают тем же раствором йода. Полость влагалища
обрабатывают 1% -ным раствором молочной кислоты, этакридина 1: 1000 или 2% -ным
лизолом: при этом кожу половых губ смазывают 3% -ным раствором йода. В полость
прямой кишки вводят из кружки Эсмарха 1% -ный раствор калия перманганата или 2%
-ный лизол; окружность ануса обрабатывают раствором йода. [6,11]
В настоящее время используется широкий
спектр современных антисептических средств для обработки операционного поля:
"Аятин" (йодсодержащий препарат), "Йодонат" (1% -й
раствор), "Йодинол", "Роккал" (1-1,5% -й раствор).
В данном случае обезболивание нервов
брюшной стенки у лошади проводили методом паралюмбальной проводниковой
анестезии, при этом операционное поле обозначалось (с учетом небольшого запаса
пространства) от заднего края последнего ребра до переднего края
поперечнореберного отростка 4-го поясничного позвонка.
Данную область обработали в следующем
порядке (по способу Филончикова):
) выстригли шерсть с помощью
ножниц, оставшийся короткий волос сбрили с использованием бритвы, удалили
загрязнения кожи и остатки шерсти с помощью тампона, смоченного в водно-мыльном
растворе;
2) для обезжиривания операционного
поля использовали тампон, смоченный в 0,5% растворе нашатырного спирта;
) асептизацию и дубление
поверхности операционного поля провели с использованием 5% спиртового раствора
йода; обработку проводили дважды - первый раз сразу после обезжиривания
операционного поля, повторно - непосредственно перед каждой инъекцией новокаина.
Rp.: Sol. Ammonii caustici 0.5% -100ml. S. Наружное, для обработки
операционного поля.
----------------------
Rp.: Sol. Jodi spirituosae 5% - 20 ml
D. S. Наружное. Для обработки
операционного поля.
4. Подготовка
рук хирурга, инструментов, шовного, перевязочного материала и хирургического
белья
Подготовка рук хирурга
Существует три основных этапа подготовки рук к операции:
) механическая очистка;
) химическая асептизация;
) дубление кожи.
Механическая очистка заключается в
обстригании ногтей, обработке заусениц. С рук снимаются все лишние предметы
(кольца, часы, браслеты), рукава подворачиваются до локтя. Руки моются в воде с
мылом, в щелочных растворах или в 0,5% -ном растворе нашатырного спирта. Руки
моются при помощи щётки или в нескольких ванночках последовательно.
Химическая асептизация - руки обрабатываются от
кончиков пальцев до локтей ватно-марлевым тампоном, смоченным антисептиком.
Дубление достигается путём обработки рук спиртами или
квасцами. Происходит уплотнение верхних слоёв кожи и закрываются выводные
протоки кожных желез.
Известны следующие способы подготовки рук хирурга к операции.
Способ Альфельда. После тщательной механической
очистки в теплой воде с мылом и щеткой руки моют в течение 3 мин. Если руки не
вытирают полотенцем, то обрабатывают 90°-ным спиртом, если вытирают - 70°-ным.
Когда кожа высохнет, подногтевые пространства смазывают 5% -ным спиртовым
раствором йода.
Способ Оливкова заключается в том, что
руки сначала моют в течение 5 мин горячей водой с мылом и щеткой, после чего
вытирают полотенцем и обрабатывают в течение 3 мин ватой, пропитанной раствором
йода 1: 3000 в спирте.
При гнойных операциях повторную обработку
рекомендуется проводить йодированным спиртом в разведении 1: 1000.
Способ
Спасокукоцкого-Кочергина, По данному способу руки моют 0,5% -ным раствором аммиака в
двух тазиках по 2,5 мин или под текучей струей этого раствора. После вторичного
мытья жидкость в тазу должна остаться прозрачной. В противном случае мытье
повторяют и руки вытирают полотенцем. Во время операции или при загрязнении рук
обработку повторяют.
Способ Напалкова предполагает механическую
очистку рук водным раствором едкого калия 1: 2000 щетками в течение 5 мин или в
тазиках салфетками. Затем руки вытирают полотенцем и обрабатывают
денатурированным спиртом в течение 3-5 мин. Подногтевые пространства и складки
кожи обрабатывают 5% -ной настойкой йода.
Все вышеперечисленные способы обеспечивают стерильность кожи
рук на протяжении 20-30 мин.
Способ обработки рук хирурга раствором фурацилина: обрабатывать руки 0,5%
раствором нашатырного спирта. Вытереть руки грубым полотенцем, обработать
тампоном с водным раствором фурацилина 1: 5000, затем тампоном с спиртовым
раствором. Обработать кончики пальцев 5% спиртовым раствором йода. [6]
В настоящее время применяются новые
бактериостатические препараты, которые не вызывают раздражения и воспалительных
явлений кожи:
Церигель. На чистые, сухие руки
наносят 3-4 г препарата и в течение 8-10 с тщательно растирают. Затем
высушивают руки в течение 2-3 мин. При соскальзывании пленки повторная
обработка не требуется. Стерильность обеспечивается на протяжении 2ч.
препараты, содержащие
хлоргексидина биглюконат: "Гибитан" (20% -й раствор, перед применением
разводят 70ͦ спиртом до концентрации 0,5-1%), готовые
растворы - "Хибисепт", "Хибискраб", "Пливасепт".
% -й раствор дегмина, 3% -й раствор
дегмицида, 1-3% -й раствор новосепта, "Первомур" (на основе перекиси
водорода и муравьиной кислоты), " Септоцид Р+", "Септоцид
Синерджи". [10]
Хирургические перчатки.
Ни один из способов обработки рук не
доводит их до состояния абсолютной стерильности, поэтому перчатки являются
единственным средством, с помощью которого обеспечивается стерильность в
бактериологическом смысле этого слова. Это особенно необходимо при проведении
операций по поводу гнойно-гнилостных процессов, а также при проведении
полостных операций у мелких животных.
Так как целость перчаток нельзя
гарантировать, то необходимо производить предварительную обработку рук одним из
вышеперечисленных способов, чтобы не допустить переноса на рану
"перчаточного сока", состоящего из пота, слущивающегося эпителия и
бактерий. Стерилизуют перчатки кипячением в дистиллированной воде в течение 30
мин, а также автоклавированием и в растворах: бактерицида 0,1% -ного - 15 мин,
хлороцида 2% -ного - 30 мин или в парах формалина - 24 ч. После гнойных
операций перчатки моют, не снимая с рук, в 2% -ном растворе лизола. [9]
В данном случае обработку рук хирурга провели с помощью
растворов фурацилина.
Rp.: Sol. Ammonii caustici 0.5% -5000ml
D. S. Наружное, для мытья рук.
Rp.: Sol. Furacilini 1: 5000-200ml
D. S. Наружное. Для обработки рук.
Rp.: Sol. Furacilini spirituosae 1: 5000-50 ml
D. S. Наружное, для обработки рук.
Rp.: Sol. Iodi spirituosae 5% - 30ml
D. S. Наружное. Для обработки ногтей и ногтевого ложа.
Подготовка
инструмента
При проведении обезболивания нервов брюшной стенки у лошади
использовали следующие инструменты: шприц инъекционный, игла инъекционная. В
основном существуют два способа стерилизации инструментов: действием высоких
температур (кипячение, фломбирование и др.) и "холодный" - в
дезинфицирующих растворах.
Для стерилизации
инструментов кипячением применяют простые или электрические стерилизаторы
(рис.1), имеющие съемную решетку с ручками. Стерилизацию проводят в обычной
воде с добавлением щелочей: 1 % натрия карбоната; 3% натрия тетрабората (бура),
0,1% едкого натра. Продолжительность кипячения зависит от растворенной в воде
щелочи: с натрия карбонатом - 15 мин, с бурой - 20, с едким натром - 10 мин.
Щелочи предупреждают коррозию металла, усиливают эффективность стерилизации и
сокращают время кипячения.
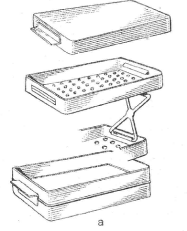
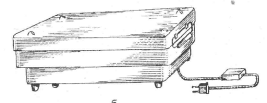
Рис. 1. Стерилизаторы: а - простой в
разобранном виде; б - электрический.
Стеклянные предметы (шприцы и др.)
помещают в стерилизатор в разобранном виде перед его нагреванием. Шприцы и
стеклянную посуду для анестезирующих растворов кипятят в дистиллированной воде,
так как щелочные растворы способствуют разложению некоторых
местно-анестезирующих средств. [7]
Стерилизация шприцев.
Поршень вынимают из цилиндра, при помощи лигатуры или бинта
его привязывают к цилиндру заворачивают в марлю, укладывают на решётку,
помещают в стерилизатор и заливают дистиллированной водой, чтобы не выступали
из воды, доводят до кипения.
Затем опускают иглы без мандренов, наколотые на марлю, и
кипятят 20-30 мин с момента закипания.
По окончании стерилизации инструменты
извлекают с решеткой стерилизатора и раскладывают на инструментальном столике,
покрытом в три ряда стерильной простыней или полотенцем. При этом соблюдают
определенный порядок - однотипные инструменты кладут на одном месте и в
определенной, характерной для каждой операции последовательности. Марлю, в
которой были завернуты скальпели, следует развернуть. Разложенные инструменты
покрывают стерильной простыней или полотенцем.
Инструменты, бывшие в употреблении (после
вскрытия гнойников, работы с трупным материалом), кипятят (не менее 30 мин) в
щелочной жидкости с добавлением 2 % лизола или карболовой кислоты. [9]
Стерилизация инструментов
фломбированием (обжиганием).
Разобранный инструмент раскладывают в
чистый эмалированный тазик или ванну, наливают необходимое количество спирта и
зажигают его. В период горения спирта инструмент желательно перевернуть,
поскольку в местах соприкосновения с дном он не может хорошо
простерилизоваться. Этот способ применяется при оказании экстренной
хирургической помощи, а также для стерилизации эмалированной посуды и
инструментов, которые по габаритам не помещаются в стерилизатор. Инструменты
также стерилизуют в специальных шкафах, при температуре 150 - 160° С в течение
20-30 мин.
Иногда в производственных условиях
инструменты стерилизуют антисептическими растворами. Для этого инструменты на
30-40 мин погружают, в один из следующих растворов: 1% -ный спиртовой раствор
бриллиантовой зелени; раствор этакридина 1: 500; 3-5% -ный раствор карболовой
кислоты; 1-2% -ный раствор лизола или жидкость Каретникова (формалина 20,0,
карболовой кислоты 3,0, углекислой соды 14,0, дистиллированной воды 1 л).
Хранение инструментов. Все инструменты после
операции тщательно моют, стерилизуют и высушивают. Затем их раскладывают в
сухом шкафу. Во избежание появления ржавчины на инструментах в шкаф помещают
сосуд, наполненный наполовину хлористым кальцием, Инъекционные иглы можно
хранить в жидкости Никифорова (спирт с эфиром поровну), при этом в каждую иглу
следует ввести мандрен. Темные пятна или ржавчину, образовавшуюся на
инструментах, можно удалить с помощью мела с нашатырным спиртом в соотношении
2:
. Нельзя хранить инструменты вместе с
препаратами йода, кислотами и т.п. [7]
В последнее время хирурги в своей работе
широко пользуются стерильными одноразовыми шприцами и иглами, которые не
требуют стерилизации и особого хранения.
В данном случае все инструменты заранее простерилизованы в
растворе карбоната натрия и хранятся в металлическом ящике (стерилизаторе),
шприцы и иглы хранятся в биксе, в ветеринарной аптеке.
Rp.: Sol. Natrii carbonati 1% -1000 ml
D. S. Для стерилизации
инструментов в стерилизаторе в течении 15 минут после закипания раствора.
Подготовка
шовного материала
Требования к шовному материалу: шовный материал должен иметь
гладкую, ровную поверхность, быть эластичным, достаточно растяжимым и
биологически совместимым с живыми тканями, обладая при этом минимальной
реактогенностью и не оказывать аллергизирующее воздействие на организм.
Стерилизация шелка. Нити шелка выпускают в
бобинах (нестерильных) или в ампулах (стерильных). Намотанный на стеклянные
катушки или на стекла с отшлифованными краями шелк кипятят в дистиллированной
воде 30-40 мин. Хранят в 96°-ном спирте либо в жидкости Никифорова.
Стерилизуют шелк и в растворах.
Способ Садовского. Мотки шелка помещают на
15 мин в 0,5% -ный раствор нашатырного спирта, а после этого на 15 мин в 2%
-ный раствор формалина на 70% -ном спирте.
Способ Тура. Шелк помещают на 24-48 ч
в 1 % -ный спиртовой раствор йода. Хранят в этом же растворе.
Стерилизация хлопчатобумажных
и льняных ниток. Эти нитки менее прочные, чем шелковые. Они обычно используются для
закрытия дефектов кожи у мелких животных, на стенку кишечника (первый этаж),
брюшину. Используют нитки № 10-20. Стерилизуют их по способу Садовского или
погружают на 24 ч в 4% -ный раствор формалина.
Стерилизация кетгута. Кетгут изготавливается из
подслизистого и частично мышечного слоев кишечника мелкого рогатого скота,
поэтому требует особой тщательной обработки. В зависимости от калибра он
рассасывается в тканях животного организма от 7 до 30 дней.
Стерилизация его с применением высокой
температуры исключается. Применяется он в основном для погружных швов.
Выпускают его в мотках, требующих стерилизации, или стерильным - в запаянных
ампулах.
Способ Губарева. Намотанный рыхло кетгут
на катушках обезжиривают в течение 12-24 ч в эфире или бензине и стерилизуют в
спиртовом растворе йода (1 г йода, 2 г калия йодида, 100 г 95°-ного этилового
спирта) в течение 14 дней, который заменяют свежим через 7 дней.
Способ Покатило. Без предварительного
обезжиривания кетгут на 3 сут. погружают в 4% -ный водный раствор формалина.
Способ
Садовского-Котылева. Кетгут помещают на 30 мин в 0,5% -ный раствор нашатырного спирта,
затем переносят на 30 мин в 2% -ный раствор формалина на 65°-ном спирте, в
котором хранят до употребления.
Стерилизация
синтетических ниток. Этот материал стерилизуют кипячением в дистиллированной воде в
течение 20 мин.
Металлическая проволока и скобки, а также
штифты для соединения костей стерилизуют кипячением, обычно вместе с
инструментами. [4,7]
В данном случае при проведении обезболивания нервов брюшной
стенки у лошади шовный материал не использовали.
Стерилизация перевязочного материала и
хирургического белья
Стерилизация
автоклавированием. Перевязочный материал (бинты, салфетки, лонгеты, компрессы,
тампоны и др.) и хирургическое белье (халаты, простыни, полотенца, колпачки)
стерилизуют в автоклавах под давлением. Иногда туда помещают фарфоровую и
стеклянную посуду, эмалированные тазики, растворы и др. Перед автоклавированием
материал и белье неплотно укладывают в биксы (рис.23). Перед помещением биксов
в автоклав открывают боковые отверстия, плотно закрывают крышкой. Если биксов
нет, то предметы хирургического обихода помещают в холщовые мешки или пакеты.
Давление 0,5 атм соответствует температуре 115° С; 1 атм - 120; 2 атм - 134° С.
Перед пользованием автоклавом закрывают
спусковой кран водопаровой камеры, открывают крышку автоклава, наливают через
воронку воду до 2/3 уровня водомерного стекла, плотно закрывают крышку и
тщательно завинчивают болты, после проверки герметичности включают источник
нагрева и в течение 15-20 мин выпускают пар; закрывают кран и поднимают
давление до необходимого для стерилизации уровня. Контроль стерилизации
проводят путем помещения в бикс веществ, температура плавления которых выше
100° С.
После окончания стерилизации автоклав
отключают, медленно открывают спусковой кран, постепенно выпускают пар, снижая
давление, открывают крышку автоклава, извлекают биксы и сразу закрывают в них
отверстия, закрывают крышку автоклава.
Стерилизацию текущим паром производят в
специальном стерилизаторе Коха, а при его отсутствии - в ведре или кастрюле с
крышкой. В них наливают воду на 1/3 высоты. Начало стерилизации считается с
момента выхода пара, температура поднимается до 100° С, продолжительность - не
менее 30 мин.
При стерилизации утюжением температуру
доводят до 150° С. Перед стерилизацией простыни, марли, салфетки увлажняют
водой и проглаживают со скоростью не более 50 см в минуту, проводя по одному и тому
же месту 2-3 раза с обеих сторон. Проутюженный материал сворачивают при помощи
стерильных пинцетов и укладывают в стерильный бикс или оставляют завернутым в
простыню. [7,9]
Во время проведения обезболивания нервов
брюшной стенки у лошади использовали следующие материалы: стерильные
ватно-марлевые тампоны, выпускаемые медицинской промышленностью, не требующие
предварительной стерилизации.
5. Фиксация
животного
Для осуществления обезболивания нервов брюшной стенки (для
последующего проведения кесарева сечения) животное зафиксировали в стоячем
положении, в фиксационном станке (Рис.2). Голову лошади удерживали рукой за
уздечку и недоуздок. Дополнительно животному ввели нейролептик - аминазин, т.к.
процесс обезболивания (паралюмбальная анестезия) выполняется путем трех
инъекций, что является болезненным для животного.
Аминазин (мегафен, хлоразин, феноктил и др.) - Aminazinum.
Белый или белый со слабым кремовым оттенком мелкокристаллический
порошок. Слегка гигроскопичен, светочувствителен. Легко растворяется в воде.
Применение. Применяют
как противострессовое средство перед транспортировкой животных, при
технологической перегруппировке и других стрессовых ситуациях при оказании
помощи животным, для премедикации и потенциирования наркотиков, анальгетиков,
снотворных, противосудорожных, при самопогрызании и гипоагалактии у пушных
зверей. Противопоказан при болезнях печени. Назначают энтерально и
внутримышечно в дозах (мг/кг массы): лошадям и КРС - 2-2,5; свиньям и мелкому
рогатому скоту - 1,5; собакам и кошкам - 2-3 мг/кг. Внутримышечно (мг/кг):
лошадям и КРС - 0,5-1,5; свиньям и мелкому рогатому скоту - 1-1,5; собакам и
кошкам - 1-2 мг/кг. [9,10]
Лошади массой 400 кг
Rp.; Sol. Aminazini 2,5% -10 ml
D. S. Внутримышечное. На 1 введение.
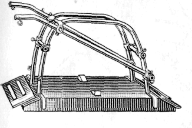
Рис. 2. Фиксационный станок Виноградова.
6.
Анатомо-топографические данные оперируемой области
Обезболивание нервов брюшной стенки у лошади принято
проводить одним из способов: паравертебральная анестезия или паралюмбальная
анестезия. В данном случае был использован метод паралюмбальной анестезии.
Точки инъекции анестезирующего раствора находятся в области брюшной стенки,
которая анатомически определяется как часть такой области как живот.
Общие анатомо-топографические данные. Понятием
"живот" определяют самую большую область тела животного,
расположенную вентрально от поясницы, между диафрагмой и входом в таз. К этой
области принадлежит брюшная стенка и брюшная полость с содержащимися в ней
органами.
Границы. Передняя граница-торакальный отдел тела по линии
прикрепления и куполу диафрагмы; задняя - вход в таз, соответствующий уровню
паховой связки, проецируемой по желобу между напрягателем широкой фасции бедра
и ягодичными мышцами; верхняя-поясничные позвонки с прилегающими мышцами; снизу
- вентральная часть мягкой брюшной стенки и мечевидный хрящ; с боков - боковая
часть мягкой брюшной стенки, участки последних ребер с примыкающей к ним
диафрагмой.
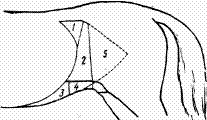
Рис. 3. Области живота: 1,2 - правого и левого подреберий; 3 -
мечевидного хряща; 4,5 - правая и левая подвздошные; 6 - пупочная; 7,8 - правая
и левая паховые; 9 - лонная
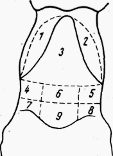
Рис.4. Деление мягкой брюшной стенки на области у лошади: 1 -
голодная ямка; 2 - подвздох; 3 - предпупочная часть вентральной брюшной стенки;
4 - позадипупочная часть вентральной брюшной стенки; 5 - паховая область (по
Н.В. Садовскому).
Живот принято делить условно на три отдела двумя сегментальными
плоскостями, проведенными: первая - по задним краям последней пары ребер,
вторая - по передневерхним углам маклока (рис.3). Передний отдел, или
надчревная область (regio epigastrica), лежит между диафрагмой и первой
плоскостью; средний отдел (regio rnesogastrica), расположен между обеими
плоскостями; задний отдел, или подчревная область (regio hypogastrica),
находится между второй плоскостью и входом в таз. [4]
Если поставить косую плоскость, соединяющую реберные дуги обеих
сторон, то вентрально от нее будет лежать область мечевидного хряща (г.
xiphoidea), а дорсально - область правого и левого подреберий (г. г.
hypochondriacae dextra et sini-stra).
Вертикальной продольной плоскостью, поставленной на концах
поперечнореберных отростков поясничных позвонков, на каждой стороне чревного
отдела с боков отделяются правая и левая подвздошные области (г. г. iliacae
dextra et sinistra). В прилегающем к позвоночнику участке в каждой из них
имеется треугольное углубление - голодная ямка (fossa paralum-balis), ниже
которой располагается собственно подвздох.
Продолжение продольных вертикальных плоскостей кзади отделяет с
каждой стороны брюшной стенки правую и левую паховые области (г. г. inguinalis
dextra et sinistra), между которыми располагается лонная область (г. pubis).
Горизонтальной плоскостью, проведенной от подвздошноко-ленной
складки до реберной дуги, по клиническим соображениям в животе разделяют еще
боковую и нижнюю брюшные стенки. На последней у самцов (кроме котов и кроликов)
выделяют область препуция, а у самок крупных животных - область молочной
железы. Сегментальной плоскостью, проведенной через пупок, вентральная брюшная
стенка делится на предпупочную и позадипупочную области (рис.4). Та часть
брюшной стенки, в состав которой не входят ребра и реберные хрящи, называется
мягкой брюшной стенкой. [2]
Строение мягкой брюшной стенки (рис.5) Подкожная клетчатка и
следующая за ней поверхностная фасция тесно сращены. Между листками
поверхностной фасции находится подкожная мышца туловища, которая лежит в
задненижнем отделе мягкой брюшной стенки, заходя в подвздошно-коленную складку.
Идущая в следующем слое подфасциальная клетчатка хорошо развита и заключает в
себя у самок молочные железы, а у самцов препуций; впереди напрягателя широкой
фасции бедра в клетчатке выше коленной чашки расположен надколенный
лимфатический узел; в области паха - поверхностные паховые лимфатические узлы.
В этом же слое имеются подкожные артерии и вены животa (a. et v.
subcutanea abdominis).
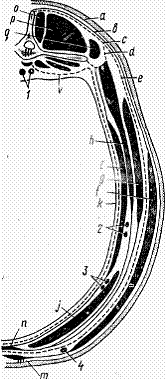
Рис. 5. Послойное строение области живота на уровне 3-го
поясничного позвонка: а - кожа; Ь, f - поверхностная фасция с кожной мышцей; с,
d - поясничноспинная фасция; е - желтая брюшная фасция; g, h, i,j - наружная и внутренняя косые, поперечная и прямая мышцы
живота; m - поперечная брюшная фасция; k - брюшина;
n - белая линия живота; о, р, q - многораздельная, длиннейшая и подвздошнореберная м.; 1 -
аорта и задняя полая вена; 2 - краниальные ветви глубокой окружной подвздошной
а. и в.; 3 - надчревные краниальные а. и в.; 4 - подкожная в. живота
Желтая брюшная фасция (fascia flava abdominis) является
продолжением поясничноспинной фасции; она сращена с апоневрозом наружной косой
мышцы живота и отделяет у самцов глубокую фасцию для полового члена, а у самок
поддерживающую связку для вымени.
Наружная косая мышца живота (m. obliquus abdominis. externus)
прикрывает верхнюю часть подвздоха и незначительный участок грудной стенки
примерно до линии прикрепления диафрагмы, имея направление мышечных волокон
спереди назад и несколько вниз. В апоневрозе различают брюшную, тазовую и
бедренную части. Брюшная часть принимает участие в формировании белой линии и
наружной пластинки влагалища прямой мышцы живота; сзади она прикрепляется к бугорку
лонной кости. Внутренняя косая мышца живота (m. obliquus abdominis internus)
имеет выраженную пучковатую структуру. Апоневроз мышцы принимает участие в
образовании фасциального влагалища прямой мышцы живота.
Прямая мышца живота (m. rectus abdominis), с каждой стороны
покрыта фасциальным влагалищем, образованным апоневрозами косых и поперечных
мышц живота.
Поперечная мышца живота (m. transversus abdominis). Место перехода
мышцы в сухожилие совпадает с таким же переходом в свои сухожилия косых мышц
живота. Данный участок является слабым местом нижнебоковой брюшной стенки, где
вследствие травмы нередко возникают разрывы.
Вблизи маклока на наружной поверхности мышцы идет делящаяся на две
ветви окружная глубокая подвздошная артерия.
Поперечная фасция (fascia transversa), предбрюшинная клетчатка
(panniculus preperitonealis) и пристеночная брюшина тесно соединены одна с
другой.
Белая линия живота (linea alba) - узкий вытянутый фиброзный
треугольник, образованный от слияния апоневрозов мышц живота, желтой и поперечной
фасций и тянущийся от мечевидного хряща до лонного сращения. Примерно на
середине белой линии имеется уплотненный рубцовый участок - пупок.
Кровоснабжение брюшной стенки обеспечивается: а) ветвями подкожной
артерии живота (от наружной срамной артерии): б) отчасти ветвями наружной
грудной артерии; в) межреберными артериями; г) поясничными артериями, главные
стволы которых проходят между поперечной и внутренней косыми брюшными мышцами;
д) опоясывающей глубокой подвздошной артерией, от последней отходят две ветви к
голодной ямке и области собственно подвздоха; е) краниальной и каудальной
надчревными артериями, идущими одна навстречу другой внутри влагалища прямой
мышцы вдоль его дорсолатерального края. Первая из них является продолжением
внутренней грудной артерии, а вторая отходит от надчревносрамного ствола
(truncus pudendo-epigastricus).
Лимфоотток происходит по поверхностным и глубоким лимфатическим
сосудам, заложенным в подкожной клетчатке и в мышцах; они впадают в надколенный
лимфатический узел,. в латеральные подвздошные узлы, расположенные в
околобрюшинной клетчатке у основания маклока, и в паховые поверхностные и
глубокие лимфатические узлы. [4]
Иннервация. Характерной особенностью иннервации брюшной стенки
является сегментальный тип ветвления стволов 7-18-го межреберных и поясничных
нервов. Нередко, однако, между ними имеются множественные соединительные ветви.
Главные стволы 7-17-го межреберных нервов проникают в толщу
прямого брюшного мускула и оканчиваются в нем вблизи белой линии; главные стволы
посылают более мелкие ветви в остальные мышцы брюшной стенки области
мечевидного хряща и кожи. Последний межреберный нерв разветвляется в
подвздошной области; его веточки достигают коленной складки и даже половых
органов.
Из вентральных ветвей поясничных нервов формируются
подвздошно-подчревный и подвздошно-паховый нервы, обслуживающие средний и
задний отделы брюшной стенки (рис.6). Они делятся на глубокие и поверхностные
сегментальные ветви. Первые лежат на внутренней поверхности поперечного
брюшного мускула, вторые-на наружной. Поверхностные ветви ин-нервируют кожу и
подлежащие поверхностные мышцы боковой части стенки; глубокие-проникают в толщу
прямого мускула и оканчиваются в нем и в коже вблизи белой линии; от них
отходят стволики для глубоких слоев брюшной стенки, в том числе и для
пристеночной брюшины. [3,11]
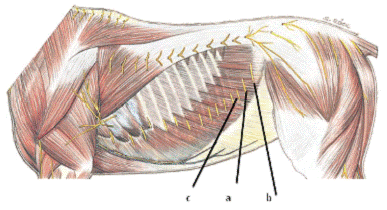
Рис. 6. Расположение нервов, блокируемых при люмбальной
анестезии у лошади.
a-п. iliohipo - gastricus (подвздошно-подчревный нерв).
b-n ilioin- guinalis (подвздошно-паховый нерв)
с - n. intercostales (последний межреберный нерв)
7.
Обезболивание
Проведение паралюмбальной анестезии (обезболивание нервов
брюшной стенки) само по себе является обезболивающей процедурой. Наркоз в
данном случае не применяли.
Для анестезии применяли 3% раствор новокаина, с введением его
в трех точках по 20 мл. [1]
Новокаин (аминокаин, аллокаин, цитокаин и др.) -
Novocainum.
Действие. Новокаин
плохо проникает через слизистые оболочки, поэтому для поверхностной анестезии
не применяется. Сильно действует на нервные стволы, слабее на нервные
окончания. Из всех местноанестезирующих средств новокаин наименее токсичен для
животных. При внутривенном введении или при всасывании новокаин оказывает общее
действие на организм: понижает чувствительность периферических
холинорецепторов, блокирует вегетативные ганглии, понижает возбудимость
миокарда и моторных зон коры головного мозга. [10]
Противопоказания: противопоказаний к применению Новокаина 0,5%,1%,2% раствора для
инъекций не установлено, за исключением индивидуальной повышенной
чувствительности к новокаину. Имеются противопоказания для проведения
новокаиновых блокад, в т. ч. паралюмбальной, использованной в данном случае:
а) при хронических воспалительных процессах пролиферативного характера,
клинически проявляющихся образованием рубцов, экзостозов, деформирующих
артритах, артрозах, веррукозном дерматите, циррозе печени, склеродермии и др.;
б) при запущенных гнойных воспалительных
процессах: артритах, тендовагинитах, ожогах, и др. осложненных тяжелыми формами
сепсиса и протекающих на фоне ареактивного состояния организма или явлений
общей интоксикации;
в) при некротических процессах, в глубоко
расположенных и жизненно важных органах (гангрена легких, септический
эндокардит и др.), так как вследствие возможного ускорения блокадой гнойного
расплавления некротизированной ткани, могут возникнуть опасные вторичные
кровотечения;
г) при хронических стадиях пневмонии и
других патологических процессах, проявляющихся глубокими патологическими
изменениями в тканях;
д) при злокачественных новообразованиях и
заболеваниях печени, при которых вследствие низкой активности холинэсткразы,
происходит замедление гидролиза новокаина, что вызывает интоксикацию организма;
е) при болезнях недостаточности и избыточности
макро - и микроэлементов,, остеодистрофии и других болезнях обмена веществ.
Также противопоказано применение новокаина
в сочетании с сульфаниламидными препаратами из-за значительных снижений
анестезирующего эффекта и антибактериального действия, возникающего под
влиянием парааминобензойной кислоты (продукт гидролиза новокаина). [1]
Rp.: Sol. Novocaini 3% - 60 ml
D. S. Для проведения паралюмбальной анестезии у лошади: вводить в три
точки, по 20 мл.
8.
Оперативный доступ
Оперативный доступ - та часть операции, при которой обнажают
пораженный орган и патологический очаг путем нарушения целости покровов, стенок
полостей,. Доступ должен быть рациональным, чтобы при минимальном повреждении
тканей: про - изводимый разрез обеспечивал наилучшее условие, для обозрения и
необходимых действий на органе. Большинство операций предусматривает
определенное положение и характер оперативного доступа. [7]
Паралюмбальная анестезия у лошади с целью блокады последнего
межреберного, подвздошно-подчревного и подвздошно-пахового нервов, производится
на уровне свободных концов поперечно-реберных отростков первых трех поясничных
позвонков (рис.7). Иглу продвигают в каждой точке до кости, а затем смещают ее
с конца отростка и погружают дополнительно на глубину 0,7-0,8 см. [11]
При этом иглой прокалывают послойно: кожу, подкожную
клетчатку, фасцию, подвздошнореберную мышцу.
Рис. 7. Точки введения раствора анестетика
при обезболивании брюшной стенки (вид сверху).
9.
Оперативный прием
Оперативный прием - собственно
вмешательство на пораженном органе. [7] Убедившись, что игла не попала в кровеносный
сосуд, подсоединили шприц с раствором новокаина к игле. После этого впрыскивали
10 мл 3% раствора новокаина, перемещая иглу взад и вперед, чтобы получить более
широкое поле инфильтрации. Затем ввели еще 10 мл раствора во время извлечения
иглы, оставляя наибольшее его количество под кожей. [11] Так поступали для
каждой точки инъекции.
10.
Заключительный этап операции
После извлечения инъекционной иглы
обрабатывали место инъекции спиртом-ректификатом, незначительное капиллярное
кровотечение в месте укола останавливали методом тампонирования (прижимая к
коже стерильный ватно-марлевый тампон до прекращения кровотечения).
Rp.: Spiriti rectificati - 15 ml
D. S. Наружное. Для обработки
места инъекции после извлечения иглы.
.
Послеоперационное лечение
Послеоперационного лечения по поводу
обезболивания нервов брюшной стенки не требовалось. После наступления анестезии
животному была проведена операция - кесарево сечение.
12.
Содержание, уход и кормление оперированного животного
Особых условий содержания и ухода за
животным, изменения рациона по поводу проведенного обезболивания нервов брюшной
стенки не требуется.
Однако по поводу проведенного кесарева
сечения были предприняты следующие меры: животное изолировано в отдельный
денник, на глубокую соломенную подстилку, в первый день - голодная диета,
вода-вволю, на второй день после операции - немного измельченного сена; переход
к обычному рациону произведен в течение 7 дней.
Список
использованной литературы
1. Веремей,
Э.И. Новокаиновые блокады в клинической ветеринарной медицине: пособие / Э.И.
Веремей, В.М. Лакисов, В.А. Ходас; Ред.Э.И. Веремей, - Минск: Технопринт, 2003.
- 99 с.
2. Веремей,
Э.И. Практикум по оперативной хирургии с основами топографической анатомии
животных: учебн. пособие / Веремей Э.И., Масюкова, В.Н., Ковалев М.И. - Минск:
Ураджай, 2000. - 153 с.
. Глаголев,
П.А., Ипполитова, В.И. Анатомия сельскохозяйственных животных с основами
гистологии и эмбриологии. \Под ред. И.А. Спирюхова и В.Ф. Вракина. - изд.4-е,
перераб. и доп. - М.: "Колос", 1977. - 450 с. с ил.
. Магда,
И.И. Оперативная хирургия с основами топографической анатомии домашних
животных: учебник по спец. "Ветеринария" / Магда И.И., Иткин Б.З.,
Воронин И.И. - 3-е изд., испр. и доп. - М.: Колос, 1979. - 360 с.
. Оперативная
хирургия с основами топографической анатомии: методичекие указания к выполнению
курсовой работы по оперативной хирургии с основами топографической анатомии для
студентов очного и заочного факультета ветеринарной медицины по специальности I-74.03.02 "Ветеринарная
медицина"/ С.В. Грищук, Д.Н. Харитоник, О.А. Зайченко и др. - Гродно:
ГГАУ, 2009. - 17 с.
. Оперативная
хирургия: учебник по спец. "Ветеринария" / И.И. Магда, Б.З. Иткин,
И.И. Воронин; Ред.И. И. Магда. - М.: Агропромиздат, 1990. - 333 с.
. Петраков,
К.А. Оперативная хирургия с топографической анатомией животных: учебник / К.А.
Петраков. - М.: КолосС, 2004. - 424 с.
. Семенов,
Б.С. Практикум по оперативной хирургии с основами топографической анатомии
домашних животных: учеб. пособие / Б.С. Семенов, В.А. Ермолаев, С.В. Тимофеев.
- М.: КолосС, 2003. - 263 с.
. Справочник
врача ветеринарной медицины / С.С. Абрамов [и др.]; под ред. А.И. Ятусевича. -
Минск: Техноперспектива, 2007. - 971 с.
. Чубарь
В.К. Оперативная хирургия домашних животных. - М.: Государственное издательство
сельскохозяйственной литературы, 1951. - 423 с.
12. Budras
K.D., Sack W.O., Rock S. Anatomy of the Horse
. 5th
revised edition. - Schlutersche Verlagsgesellschaft mbH and Co., 2009. - 208 с.