Ответы физико-химические процессы в техносфере
Ответы на вопросы «Ф.Х.процессы в
техносфере»
1. Тепловой баланс системы «поверхность Земли –
атмосфера». Отражение, поглощение, собственное излучение земной поверхности и
атмосферы.
Тепловой баланс Земли, соотношение прихода и расхода
энергии (лучистой и тепловой) на земной поверхности, в атмосфере и в системе
Земля - атмосфера. Основным источником энергии для подавляющего большинства
физических, химических и биологических процессов в атмосфере, гидросфере и в
верхних слоях литосферы является солнечная радиация, поэтому
распределение и соотношение составляющих Т. б. характеризуют её преобразования
в этих оболочках.
Т. б. представляют собой частные формулировки закона
сохранения энергии и составляются для участка поверхности Земли (Т. б. земной
поверхности); для вертикального столба, проходящего через атмосферу (Т. б.
атмосферы); для такого же столба, проходящего через атмосферу и верхние слои
литосферы или гидросферу (Т. б. системы Земля - атмосфера).
Уравнение Т. б. земной поверхности: R + P +
F0 + LE =0 представляет собой алгебраическую сумму
потоков энергии между элементом земной поверхности и окружающим пространством.
В число этих потоков входит радиационный баланс (или остаточная радиация) R
- разность между поглощённой коротковолновой солнечной радиацией и
длинноволновым эффективным излучением с земной поверхности. Положительная или
отрицательная величина радиационного баланса компенсируется несколькими
потоками тепла. Так как температура земной поверхности обычно не равна
температуре воздуха, то между подстилающей поверхностью и атмосферой
возникает поток тепла Р. Аналогичный поток тепла F0
наблюдается между земной поверхностью и более глубокими слоями литосферы или
гидросферы. При этом поток тепла в почве определяется молекулярной теплопроводностью,
тогда как в водоёмах теплообмен, как правило, имеет в большей или меньшей
степени турбулентный характер. Поток тепла F0 между
поверхностью водоёма и его более глубокими слоями численно равен изменению
теплосодержания водоёма за данный интервал времени и переносу тепла течениями в
водоёме. Существенное значение в Т. б. земной поверхности обычно имеет расход
тепла на испарение LE, который определяется как произведение массы
испарившейся воды Е на теплоту испарения L. Величина LE зависит
от увлажнения земной поверхности, её температуры, влажности воздуха и
интенсивности турбулентного теплообмена в приземном слое воздуха, которая
определяет скорость переноса водяного пара от земной поверхности в атмосферу.
Уравнение Т. б. атмосферы имеет вид: Ra +
Lr + P + Fa = DW.
Т. б. атмосферы слагается из её радиационного баланса Ra;
прихода или расхода тепла Lr при фазовых преобразованиях воды
в атмосфере (г - сумма осадков); прихода или расхода тепла Р, обусловленного
турбулентным теплообменом атмосферы с земной поверхностью; прихода или расхода
тепла Fa, вызванного теплообменом через вертикальные стенки
столба, который связан с упорядоченными движениями атмосферы и
макротурбулентностью. Кроме того, в уравнение T. б. атмосферы входит член DW,
равный величине изменения теплосодержания внутри столба.
Уравнение Т. б. системы Земля - атмосфера
соответствует алгебраической сумме членов уравнений Т. б. земной поверхности и
атмосферы. Составляющие Т. б. земной поверхности и атмосферы для различных
районов земного шара определяются путём метеорологических наблюдений (на
актинометрических станциях, на специальных станциях Т. б., на метеорологических
спутниках Земли) или путём климатологических расчётов.
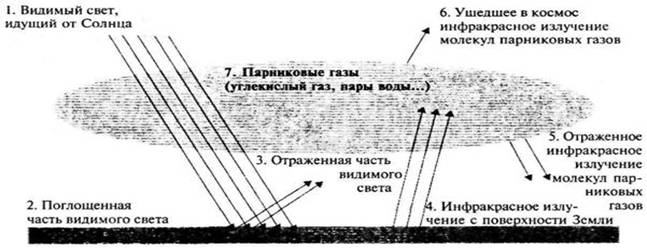
2. Критические элементы Баланса, определяющие среднюю
температуру поверхности Земли. Роль альбедо атмосферы и земной поверхности.
Изменение альбедо вследствие аэрозольных загрязнений.
Практически единственным источником энергии для всех
физических процессов, развивающихся в А., является солнечная радиация. Главная
особенность радиационного режима А. — т. н. парниковый эффект: А. слабо
поглощает коротковолновую солнечную радиацию (большая её часть достигает земной
поверхности ),
но задерживает длинноволновое (целиком инфракрасное) тепловое излучение земной
поверхности ,
что значительно уменьшает теплоотдачу Земли
в космическое пространство и повышает
её температуру .
Приходящая в А. солнечная радиация частично поглощается в А.
главным образом водяным паром, углекислым газом, озоном и
аэрозолями и
рассеивается на частицах аэрозоля и
на флуктуациях плотности А. Вследствие
рассеяния лучистой энергии Солнца в А. наблюдается не только прямая солнечная,
но и рассеянная радиация, в
совокупности они составляют суммарную радиацию. Достигая земной
поверхности ,
суммарная радиация частично отражается от неё. Величина отражённой радиации
определяется отражательной способностью подстилающей поверхности ,
т. н. альбедо (Альбе́до
(лат. albus —
белый) — характеристика отражательной (рассеивающей) способности
поверхности. Например: Нормальное альбедо чистого снега составляет ~0,9,
древесного угля ~0,04.).За счёт поглощённой радиации земная
поверхность
нагревается и
становится источником собственного длинноволнового излучения, направленного к
А.(см.рис.)
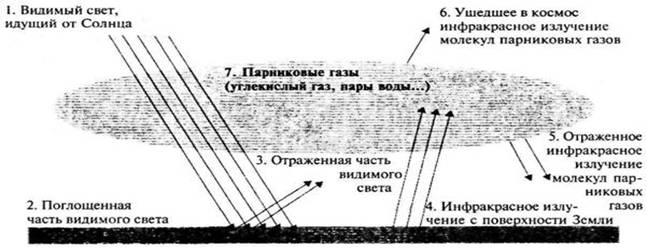
Непоглощающий аэрозоль увеличивает альбедо атмосферы
и, следовательно уменьшает количество
солнечной радиации, достигающей поверхности Земли. Если аэрозоль поглощает
в коротковолновой области спектра, то поглощенная энергия солнечного
излучения передается атмосфере. Это приводит к нагреванию атмосферы и
охлаждению подстилающей поверхности.
Если аэрозоль поглощает и соответственно испускает энергию
в инфракрасной области спектра, то это приводит к противоположному
результату, т. е. энергия выводится из тропосферы ,
что приводит к охлаждению воздуха и усилению парникового эффекта у
поверхности Земли. Общий эффект зависит от соотношения коэффициентов
поглощения в видимой и инфракрасной области, а также от альбедо
поверхности. Изменение радиационных потоков в аэрозольной атмосфере
приводит к изменению ее температурной стратификации, а также к
изменению температуры земной поверхности.
Влияние аэрозоля на климат наиболее ощутимо в
промышленных районах вследствие
того, что воздействие его на радиационные потоки приводит к
нагреванию атмосферы и стабилизации
конвективных процессов, что приводит к усилению температурных инверсий и
тем самым к накоплению промышленного выброса.
3. Общие сведения о фотохимии загрязнителей. Окисление
оксидов азота озоном в присутствии углеводородов. Фотохимический или «летний»
смог.
Для фотохимических реакций требуется световая энергия.
Некоторые загрязнители атмосферы - окислы азота и углеводороды - вступают в
фотохимические реакции. В результате образуются новые загрязнители воздуха, в
том числе озон, альдегиды, а также необычные органические соединения. Эти новые
загрязнители в сумме определяют фотохимическое загрязнение воздуха, поскольку
они появляются в результате фотохимических реакций. Сжигание ископаемых видов
топлива в двигателях и топках создает такое интенсивное нагревание, что из
обычных природных компонентов воздуха - азота и кислорода - образуются
загрязнители атмосферы - окислы азота. Они возникают при высоких температурах.
развивающихся в цилиндрах двигателей внутреннего сгорания, используемых,
например, в автомобилях. Оксиды азота в отработавших газах образуются в
результате обратимой реакции окисления азота кислородом воздуха под
воздействием высоких температур и давления в цилиндрах двигателя. По мере
охлаждения отработавших газов и разбавления их воздухом оксид азота
превращается в диоксид и т.д. Эта же реакция происходит в топках, установленных
на тепловых электростанциях. Большая часть данных о влиянии окислов азота на
здоровье относится к двуокиси азота. Оксид азота NO - бесцветный газ, диоксид
азота NO2 - газ красно-бурого цвета с характерным запахом. Оксиды азота при
попадании в организм человека соединяются с водой. При этом они образуют в
дыхательных путях соединения азотной и азотистой кислоты. 4NO2+2H2O+O2 = 4HNO3.
Оксиды азота раздражающе действуют на слизистые оболочки глаз, носа, рта.
Воздействие NO2 cпособствует развитию заболеваний легких Исходно двуокись азота
составляет лишь 10% выбросов всех окислов азота в атмосферу; однако в ходе
сложной последовательности химических реакций в воздухе значительная часть
окиси азота превращается в двуокись азота - гораздо более опасное соединение.
Оксиды азота принимают участие в образовании фотохимического смога.
К фотохимическим процессам относятся процессы образования
пероксиацетилниратов (ПАН).
Так как бензин представляет собой смесь жидких углеводородов
(пентана, гексана, гептана, октана, нонана, декана) с температурами кипения
20—180°С, а дизельное топливо — углеводородов с длиной цепи от С13 до С25,
температуры кипения которых лежат в интервале 220—370°С,то теоретически при
сгорании и того и другого топлива в присутствии кислорода должны образовываться
лишь диоксид углерода и вода: CnH2n+2 + O2 =
CO2 + H2O, где n составляет 5—10 для бензинов и 13—25 для
дизельного топлива. В действительности же продуктов сгорания в выхлопных газах
гораздо больше. Причина этого — неравновесные условия горения топлива,
присутствие в нем разных примесей (в том числе органических производных азота и
серы), остающихся при перегонке нефти, а также добавление в качестве
антидетонатора тетраметил- и тетраэтилсвинца.
При окислении углеводородов и дальнейшем взаимодействии с
диоксидом азота образуется пероксиацетилнитрат , вызывающий, как и озон, слезотечение и раздражение
дыхательных путей:
RH + OH + O2 = RO2 +
H2O
RO2 + NO2 = RO2NO2,
где R = CH3CO. Это известный в
литературе фотохимический (или лос-анджелесский) смог. Кислый (лондонский) смог
обусловлен взаимодействием оксидов азота и серы с влагой воздуха: NO2 + OH = HNO3 и SO2
+ H2O + 1/2 O2 = H2SO4.
Оксиды азота и серы — это источник кислотных дождей. Попадая
в почву, они вымывают соединения магния, калия и кальция, в результате растения
не получают эти вещества в достаточном для фотосинтеза количестве и листья
желтеют. Раньше других от такого голода страдают хвойные. Ослабленные деревья
становятся чувствительнее к резким колебаниям температуры, подвергаются
болезням, на них нападают насекомые-вредители.
4. Воздействие загрязняющих веществ на объекты
техносферы. Воздействие оксидов серы, оксидов азота, озона, кислот, аэрозолей и
других загрязняющих веществ на строительные и конструкционные материалы,
памятники культуры.
Атмосферный воздух является основной средой деятельности
биосферы, в том числе человека. Ежегодно в атмосферу поступают сотни миллионов
тонн оксидов серы, азота, галогенопроизводных и других соединений. Основными
источниками атмосферных загрязнений являются энергетические установки, в
которых используется минеральное топливо, предприятия черной и цветной
металлургии, химической и нефтехимической промышленности, авиационный и
автомобильный транспорт.
Попадая в атмосферу, многие загрязнения подвергаются
химическим или фотохимическим превращениям с участием компонентов воздуха.
Конечные продукты химических превращений удаляются из атмосферы с осадками или
выпадают на поверхность Земли с аэрозолями. Попадая на поверхность
биологических объектов, строительных конструкций и других предметов,
загрязнения и продукты их превращения интенсифицируют физико-химические
процессы разрушения органических веществ, металлов и неорганических материалов.
Кислотный дождь может также причинять вред металлам,
различным зданиям и памятникам. В первую очередь подвержены опасности памятники,
построенные из песчаника и известняка, а также расположенные под открытым небом
скульптуры. В Италии, Греции и других странах сохранявшиеся на протяжении сотен
и тысяч лет памятники старины и различные предметы за последние десятилетия
сильно разрушились в результате действия выброшенных в атмосферу загрязняющих
веществ.
5. Влияние кислотных дождей на объекты гидросферы.
Буферная емкость естественных водоемов. Диаграммы динамики pH водоемов с
ложами, образованными вулканическими и осадочными горными породами.
Закисление прёсных вод - это потеря ими способности к
нейтрализации. Закисление вызывают сильные кислоты, главным образом серная и
азотная. На протяжении длительного периода более важную роль играют сульфаты,
но во время эпизодических явлений (например, таяние снега) сульфаты и нитраты
действуют совместно. На значительных территориях при повышении определенных
значений кислотности осадков поверхностные воды оказываются кислыми. Если почва
теряет способность нейтрализовать кислоты, то значение рН может снизиться на 1,
5, а в крайних случаях — даже на 2 или на 3. Частично закисление происходит
непосредственно под действием осадков, но в большей мере - за счет веществ,
смываемых с территории водного бассейна.
Особенно интенсивно происходит закисление озер в
Скандинавских странах и в Канаде. Большинство скандинавских озер имеют
гранитное или бедное известняками ложе. Такие озера обладают гораздо меньшей
способностью к нейтрализации кислот, чем озера, расположенные на территориях,
богатых известняком. Это связано с тем, что из известняковых почв выделяется
ион гидрокарбоната, который обеспечивает щелочную среду и, следовательно,
способность к нейтрализации кислот. Например, рН воды в оз. Балатон (Венгрия)
больше 8. Поскольку в химии атмосферы для нейтральной среды принято значение рН
= 5,6, то воду этого озера следует отнести к щелочной.
Процесс закисления поверхностных вод состоит из трех фаз.
1. Убыль ионов гидрокарбоната, т.е. уменьшение способности к
нейтрализации при неизменяющемся значении рН.
2. Уменьшение рН при уменьшении количества ионов
гидрокарбоната.Значение рН тогда падает ниже 5,5. Наиболее чувствительные виды
живых организмов начинают погибать уже при рН = 6, 5
3. При рН = 4, 5 кислотность раствора стабилизируется. В
этих условиях кислотность раствора регулируется реакцией гидролиза соединений
алюминия. В такой среде способны жить только немногие виды насекомых,
растительный и животный планктон, а также белые водоросли.
Многие виды животных и растений начинают гибнуть уже при
зачениях рН <6. При рН < 5 не обеспечиваются условия для нормальной
жизни.
Буферная емкость естественных водоемов. 1) способность
природной воды (водоёма ) сохранять активную реакцию среды (pH) при действии
кислот и щелочей; 2) способность воды к самоочищению от загрязнителей. Буферная
ёмкость
природных вод зависит, в основном, от видового разнообразия и нормального
функционирования (гомеостаза) водной экосистемы.
31.Химический
состав природных вод.Пресная и соленая вода.Главные ионы, раствореные
газы,газовая фаза, твердые частицы,биогенные вещества,микроэлементы в
воде.Кислотность вод в объектах гидросферы.
Классификация
по химическому составу
В
подавляющем большинстве случаев солевой состав природных вод определяется
катионами Са2+, Мg2+, Nа+, К+ и анионами НСO3-, Сl- , SO42-. Эти ионы называются
главными ионами воды или макрокомпонентами; они определяют
химический тип воды. Остальные ионы присутствуют в значительно меньших
количествах и называются микрокомпонентами; они не определяют химический
тип воды.
Классификация природных вод по химическому составу, предложенная О. А. Алекиным
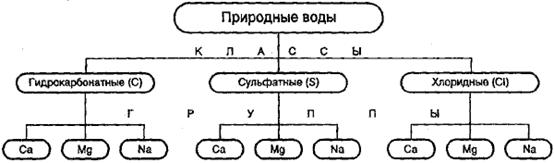
По
преобладающему аниону воды делятся на три класса: гидрокарбонатные, сульфатные
и хлоридные. Воды каждого класса делятся, в свою очередь, по преобладающему
катиону на три группы: кальциевую, магниевую и натриевую. Каждая группа
подразделяется на 4 типа по соотношению содержащихся в воде ионов (в
эквивалентах). При этом класс природных вод обозначается символом
соответствующего аниона: С — НСО3-, S — SO42-, Сl — Сl-; группа: символом
катиона: К+, Na+, Са2+, Мg2+; тип - римской цифрой.
Формула воды записывается следующим образом. К символу класса добавляется
нижний индекс - значение минерализации (с точностью до 0,1 г/л ), к символу
группы - верхний индекс - значение общего катионного состава (с точностью до
целых единиц вещества в ммоль/л),
например: С1,2 Nа0,5 - гидрокарбонатно-натриевая вода с общей
минерализацией 1,2 г/л и преобладающей концентрацией гидрокарбонатных ионов и
ионов натрия.
В природных водах присутствуют также растворенные газы. В основном это газы,
которые диффундируют в воды из атмосферы воздуха, такие как кислород,
углекислый газ, азот. Но в то же время в подземных водах или водах
нецентрализованных источников водоснабжения, в минеральных и термальных водах
могут присутствовать сер водород, радиоактивный газ радон, а также инертные и
другие газы.
В табл. 1.13 представлены ионы, наиболее часто встречающиеся в природных
водах.\
|
Катион
|
|
Анион
|
|
|
Наименование
|
Обозначение
|
Наименование
|
Обозначение
|
|
Водород
|
H+
|
Гидроксильный
|
OH-
|
|
Натрий
|
Na+
|
Бикарбонатный
|
HCO3-
|
|
Аммоний
|
NH4+
|
Хлоридный
|
Cl-
|
|
Кальций
|
Ca2+
|
Сульфатный
|
SO42-
|
|
Магний
|
Mg2+
|
Нитритный
|
NO2-
|
|
Железо (двух- и трехвалентное)
|
Нитратный
|
NO3-
|
|
Барий
|
Ba2+
|
Силикатный
|
SiO32-
|
|
Алюминий
|
Al3+
|
Ортофосфорный
|
PO43-
|
|
Калий
|
K+
|
Фторидный
|
F-
|
ВОДА ПРЕСНАЯ — все природные воды с
минерализацией до 1 г/л (г/кг); преобладают гидрокарбонатные, реже сульфатные и
очень редко хлоридные.
Соленые воды океанов
и морей составляют 97,5% , а пресная 2.5%. Но учитывая также, что 75% всей
пресной воды «заморожено» в полярных шапках и горных ледниках, еще 24%
составляют грунтовые воды под землей, а еще 0.5% «рассредоточено» в почве в
виде влаги, то получается, что самые доступные и дешевые источники воды – реки,
озера и другие водоемы приходится чуть больше 0.01% мировых запасов воды.
1. Главные ионы (макрокомпоненты),
к которым относятся К+, Na+,Mg2+, Са2+, Cl-, SO42-, HCO3- (CO32-).
Содержание их в пресных поверхностных водах изменяется в широких пределах.
Главные ионы поступают в природные воды из горных пород, минералов, почвы, а
также в результате производственной деятельности человека.
2. Растворенные газы (О2, N2, H2S, CH4 и др.).
Концентрация газов в воде определяется температурой воды.
3. Биогенные вещества, главным образом соединения азота и фосфора.
Их концентрация в пресных поверхностных водах изменяется в очень широких
пределах: от следов до 10 мг/л. Наиболее важными источниками биогенных
элементов являются внутриводоемные процессы и поступление с поверхностным
стоком, атмосферными осадками, промышленными, хозяйственно-бытовыми и сельскохозяйственными
сточными водами.
4. Микроэлементы.
В эту группу входят все металлы, кроме главных ионов и железа (Сu2+, Мn2+,
другие ионы переходных металлов), а также анионы (Br-, F- и др.), встречающиеся
в природных водоемах в очень малых концентрациях.
5. Растворенные органические вещества (РОВ), по существу, органические
формы биогенных элементов.
Эта группа веществ включает различные органические соединения: органические
кислоты, спирты, альдегиды, сложные эфиры, фенолы, гуминовые вещества,
ароматические соединения, углеводы, азотсодержащие соединения (белки,
аминокислоты, амины) и т.д. Для количественной характеристики РОВ используют
косвенные показатели: общее содержание Сорг, Nopr, перманганатную или
бихроматную окисляемость воды (ХПК), биохимическое потребление кисло¬рода
(БПК).
6. Токсичные загрязняющие вещества - тяжелые металлы, нефтепродукты,
хлорорганические соединения, синтетические поверхностно-активные вещества
(СПАВ), фенолы и т.д.
Природная вода - принципиально негомогенная среда из-за присутствия в ней
большого числа взвешенных частиц и пузырьков газа. Взвешенные твердые частицы в
природных водах могут разли¬чаться по размерам:
·
Коллоиды
0,01-1 мкм
·
Седиментарные
(оседающие) частицы состоят из минерального ядра и органического слоя, т.е.
представляют собой органоминеральный комплекс 1-3 мкм
·
Вирусы
0,01-0,03 мкм
·
Бактерии 0,5
мкм
·
Микроводоросли
1-30 мкм
·
Молекулы
0,001 мкм
·
Макромолекулы
0,01 мкм
Помимо твердых частиц и пузырьков газа толща природных вод пронизана множеством
микроорганизмов, образующих отдельную фазу биоты, находяющуюся в динамическом
равновесии с внешней средой.
32.Процессы окисления и восстановления в природных
водоемах.Синглетный водород,озон,гидроксил радикал,пероксид водорода в
природных водах.Окисление минеральных солей.Образование оксидов тяжелых
металлов.
Окислительно-восстановительные реакции в природных водах
определяются наличием в них окислителей, например кислорода, и восстановителей,
например водорода. Окислением называется процесс отдачи электронов, а
восстановлением - процесс их приобретения. Поскольку процесс окисления
химического элемента сопровождается восстановлением окислителя, эта реакция и
носит название окислительно-восстановительной.
Многие элементы (железо, марганец, хром, сера, кобальт и др.) способны изменять
свою валентность, поэтому реакции окисления и восстановления играют
значительную роль, переводя растворимые "соединения в нерастворимые и
наоборот.
В процессах растворения почвенных минералов значительная роль принадлежит
микроорганизмам. В процессе своей жизнедеятельности они используют энергию
окислительно-восстановительных реакций, поэтому процесс называется
биологическим выщелачиванием минералов. Пероксид водорода— это вещество, H 2O2,
открыто в 1818 г. Тенаром, который получил его при действии разведенной соляной
кислоты на П. бария: ВаО 2 + 2HCl = BaCl2 + H2O2;простейший
представитель пероксидов.
Бесцветная жидкость с «металлическим»
вкусом, неограниченно растворимая в воде, спирте
и эфире.
Концентрированные водные растворы взрывоопасны. Пероксид водорода является
хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата
H2O2•2H2O. Пероксид водорода обладает окислительными,
а также восстановительными
свойствами. Он окисляет нитриты
в нитраты,
выделяет иод из иодидов
металлов, расщепляет ненасыщенные
соединения по месту двойных связей. Пероксид водорода
восстанавливает соли золота
и серебра,
а также кислород
при реакции с водным раствором перманганата
калия в кислой среде. При восстановлении Н2O2
образуется Н2O или ОН-, например: Н2О2 + 2KI
+ H2SO4
= I2 + K2SO4
+ 2H2O . При
действии сильных окислителей H2O2 проявляет
восстановительные свойства, выделяя свободный кислород:
O22− — 2e−
→ O2
33.Реакции
окисления алканов,алкснов,кислотосодержащих углеводородов. Окисление
ароматических углеводородов.Образование токсичных соединений.
Алканы - соединения с низкими степенями окисления
углерода, и в зависимости от условий реакции они могут окисляться с
образованием различных соединений.
При обычной температуре алканы не вступают в реакции
даже с сильными окислителями (Н2Cr2O7, KMnO4 и т.п.). При внесении в открытое
пламя алканы горят. При этом в избытке кислорода происходит их полное окисление
до СО2, где углерод имеет высшую степень окисления +4, и воды.
Горение углеводородов приводит к разрыву всех связей С-С и С-Н и сопровождается
выделением большого количества тепла (экзотермическая реакция).
Примеры:
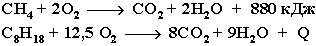
Ароматические углеводороды — это органические вещества,
характеризующиеся присутствием в их молекуле бензольного кольца — циклической
группировки из шести атомов углерода с тремя двойными связями. К
числу ароматических углеводородов принадлежат бензол и его производные (толуол, ксилол и др.), нафталин и его
производные и др.
Наибольшей
стабильностью обладают ароматические углеводороды с короткими боковыми цепями;
они окисляются с образованием продуктов уплотнения. При увеличении длины цепей,
как правило, снижается стабильность.
34.Влияние
микроорганизмов на процессы окисления - восстановления.Аэробные и анаэробные
микроорганизмы.Ферменты - каталезаторы окислительных процессов:оксидаза, оксигеназа,
пероксидаза, каталаза и дисмутаза.
Аэробный процесс
С6Н12О6
+6О2 --> 6СО2 +6Н2О + микробная
биомасса + тепло
Анаэробный процесс
С6Н12О6 -->
3СН4 + 3СО2 + микробная биомасса + тепло
35.Аэробный
биолиз алканов, алкенов, кислородсодержащих и галогенсодержащих углеводородов,ароматических
углеводородов.
Алка́ны (также насыщенные углеводороды, парафины,
алифатические соединения) — ациклические углеводороды
линейного или разветвлённого строения, содержащие только простые связи и
образующие гомологический
ряд с общей формулой CnH2n+2.
36.Анаэробная
среда.Условия образования в водных объектах активного ила с восстанавливающими
свойствами.Сульфатредуцирующие микроорганизмы.Восстановление нитратов в иловых
водах.Образование метана и мочевины.
Активный ил
- совокупность микроорганизмов, обеспечивающих очистку сточной воды от
находящихся в ней органических загрязнений.
Анаэробный
процесс -
процесс биохимического окисления, происходящий в отсутствии кислорода, при
анаэробном процессе кислород, необходимый для окисления, бактерии получают из
окисленных соединений азота.
Условия проведения
процесса(активного ила
наличие в сточной
жидкости и оптимальное соотношение органического углерода,
биогенных элементов (азота и фосфора) и микроэлементов (серы, марганец,
железо,
кобальт
и др.); соблюдение предельно допустимых концентраций загрязняющих
веществ; отсутствие в сточной жидкости токсичных для микроорганизмов веществ; достаточное
количество кислорода и интенсивность аэрации;
оптимальный температурный режим;нагрузка на ил по количеству загрязняющих
веществ; время контакта ила и сточной жидкости; конструктивные особенности
сооружений и биологической схемы очистки; и т. д.
БАКТЕРИИ СУЛЬФАТВОССТАНАВЛИВАЮЩИЕ
(СУЛЬФАТРЕДУЦИРУЮЩИЕ) — гр. строго анаэробных микроорганизмов,
восстанавливающих сульфаты до сероводорода (см. Десульфатизация вод). Б.
с. используют в качестве источника энергии окисление орг. веществ или
молекулярного водорода. В последнем случае они частично пользуются автотрофной
системой питания. Широко распространены в природе (в солоноватоводных водоемах,
в подземных водах, в м-ниях нефти, серы, сульфидных руд и пр.), участвуя прямо
или косвенно в образовании сероводорода, самородной серы, пирита, сернистых
соединений нефти и др. Процесс восстановления сульфатов в биосфере в
подавляющем большинстве случаев связан с деятельностью Б. с. Являются активным
агентом фракционирования изотопов серы в природе. Син.: бактерии
десульфатизирующие, бактерии десульфирующие (десульфурирующие). Последние два
синонима неточны, так как специфика процесса, осуществляемого Б. с., состоит не
в удалении серы (десульфуризации), а в восстановлении сульфатов
(десульфатизации).
38.Гидролиз
солей и органических соединений.Гидолиз пестицидов.Каталический гидролиз в
присутствии кислот и щелочей.
Гидро́лиз (от др.-греч. ὕдщс — вода и лэуйт — разложение)
— один из видов химических реакций сольволиза, где при взаимодействии веществ
с водой
происходит разложение исходной молекулы с образованием новых соединений.
Гидролизу подвергаются соединения различных классов: соли,
углеводы, белки,
сложные эфиры, жиры
и др.
Гидролиз солей Взаимодействие ионов
соли с водой, приводящее к образованию молекул слабого электролита, называют гидролизом солей.
Различают несколько
вариантов гидролиза солей:
·
1. Гидролиз
соли слабой кислоты и сильного основания:
Na2CO3
+ Н2О = NaHCO3 + NaOH
CO32−
+ H2O = HCO3− + OH−
(раствор имеет
щелочную среду, реакция протекает обратимо)
·
2. Гидролиз
соли сильной кислоты и слабого основания:
CuCl2 + Н2О = CuOHCl + HCl
Cu2+ + Н2О = CuOH+ + Н+
(раствор имеет кислую
среду, реакция протекает обратимо)
·
3. Гидролиз
соли слабой кислоты и слабого основания:
Al2S3
+ 6H2O = 2Al(OH)3 + 3H2S
2Al3+
+ 3S2− + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ)
(Гидролиз в этом случае
протекает практически полностью, так как оба продукта гидролиза уходят
из сферы реакции в виде осадка или газа).
Соль сильной кислоты
и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая
диссоциация.
Гидролиз органических соединений — расщепление органического
соединения водой с образованием двух или более веществ. Обычно Г.
осуществляется в присутствии кислот (кислотный Г.) или щелочей (щелочной Г.).
Гидролитическому расщеплению чаще всего подвергаются связи атома углерода с
другими атомами (галогенами, кислородом, азотом и др.). Так, щелочной Г.
галогенидов служит методом получения (в том числе и промышленного) спиртов и
фенолов, например:
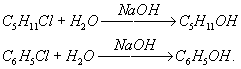
Пестициды (ядохимикаты) - химические
препараты для защиты сельскохозяйственной продукции, растений, для уничтожения
паразитов у животных, для борьбы с переносчиками опасных заболеваний и т.п.
Гидролиз пестицидов Одним из путей очистки воды от
пестицидов - эфиров фосфорных кислот являтся гидролитическое расщепление.
Возможность использования химического гидролиза в качестве метода очистки от
ФОП определяется главным образом характером образующихся продуктов превращения,
степенью устойчивости и токсичности, их влиянием на органолептику воды.
Максимальная устойчивость ФОП наблюдается в кислой среде. С повышением рН
скорость гидролиза возростает. Исключение состовляют диазинон, диазоксон,
актеллик, для которых характерна высокая стабильность в нейиральной среде.
Изучение кинетиеи и продуктов
гидролиза позволило установить, что щелочной гидролиз ФОП обычно протекает с
разрывом связи фосфор-кислород (P-O(S)), в то время, как при кислотном
гидролизе происходит преймущественное расщепление углерод-кислородного
фрагмента (O(S)-R)).
Для производных карбаминовых
кислот - карбаматов наличие эфирной связи обуславливает их гидролиз, продуктом
которого является неустойчивая карбаминовая кислота и оксисоединение. Схема
гидролиза фенилкарбаматов на примере хлорпроизводного изопропил-N-фенилкарбамата
(ИФК) приведена ниже:(стр37)
В случае гидролиза сложных эфиров
динитрофенола кинетика реакций была подробно изучена на примере наиболее часто
используемых представителях этого ряда - акрекса и каратана. Их ПДК, определяемый
по санитарному признаку 0,5-0,2 мг/дм3. Показано, что в щелочной
среде гидролиз протекает с заметной скоростью (время полураспада 9-17 суток),
и поэтому он может быть применен в качест-
ве метода, сокращающего и время и
дозы реагентов на следующих этапах очистки воды.
Гидроли мочевины заметно
протекает в кислой или щелочной среде при нагревании, в результате которого
мочевина разлагается с образованием аммиака и диоксида углерода. Процесс этот
рекомендовандля очистки от мочевины сточных вод.
39. Фотодиссоциация (или фотолиз) — химическая реакция,
при которой химические соединения разлагаются под действием фотонов
электромагнитного излучения. Фотолиз является частью фотосинтеза, которая
протекает в гранах хлоропластов. При фотолизе свет, поглощенный хлорофиллом
превращается в химическую энергию, которая затем используется для разложения
воды на водород и кислород. Фотолиз воды основан на прямом распаде молекулы
воды под воздействием кванта fiv поглощенного света. При фотолизе воды
выделяются кислород и протоны. Выделяющийся в результате фотолиза воды кислород
- - основной, если не единственный фактор формообразования, земной атмосферы и
поддержания в ней кислородного баланса.
Фотосенсибилизация — явление повышения
чувствительности организма (чаще кожи и слизистых оболочек) к действию
светового излучения. Фотосенсибилизаторы вызывают два типа реакций —
фототоксические реакции и фотоаллергии. Фотоаллергия возникает, когда
УФ-излучение химически изменяет вещество, оказавшееся на коже, так, что оно
начинает вызывать аллергию.
40. Пове́рхностно-акти́вные вещества́
(ПАВ) — химические соединения, которые, концентрируясь на поверхности раздела
фаз, вызывают снижение поверхностного натяжения. Основной количественной
характеристикой ПАВ является поверхностная активность — способность вещества
снижать поверхностное натяжение на границе раздела фаз — это производная
поверхностного натяжения по концентрации ПАВ при стремлении С к нулю. Например
в океане изменение поверхностного натяжения приводит к снижению показателя
удерживания CO2 и кислорода в массе воды.
ВСПЕНИВАНИЕ ВОДЫ- образование пены в паровом котле
на поверхности воды. Явление В. в. обусловливается наличием в воде крайне
мелких органических веществ при одновременном присутствии растворимых солей
(щелочей, сернокислого натрия).
Алкилбензолсульфонат - синтетическое анионное
поверхностно-активное вещество, представляющее собой смесь натриевых солей
алкилбензолсульфокислот с алкильными заместителями С10-С14, экологически
безвредное и биоразлагаемое. Основа синтетических моющих средств,
пенообразующих композиций, смачивателей.
41. В первую очередь отрицательному воздействию
подвергаются водные экосистемы, почва и растительность.Природные поверхностные
воды обладают буферными способностями по отношению к посторонним водородным и
гидроксильным ионам, т. е. способностью поддерживать постоянную величину рН
вблизи нейтральной точки; за пределами интервала значений
рН = 4–13 буферная способность полностью
утрачивается. Даже небольшая концентрация ионов алюминия (0,2 мг/л) смертельна
для рыб. В то же время фосфаты, обеспечивающие развитие фитопланктона и другой
водной растительности, соединяясь с алюминием, становятся малодоступными этим
организмам.
Повышение кислотности приводит к появлению в воде
высокотоксичных ионов тяжелых металлов – кадмия, свинца и других, которые
прежде входили в состав нерастворимых в воде соединений и не представляли
угрозы живым организмам.
Дефицит питательных веществ и интоксикация воды
приводят к своеобразной «стерилизации» водоемов. Закисленная и токсичная вода
разрушает скелеты рыб и раковины моллюсков, а главное – снижает репродуктивные
процессы. В свою очередь, это приводит к сокращению популяций наземных животных
и птиц, связанных с водной биотой трофическими цепями (цепи питания).
«Мертвая вода» усиливает дефицит пресной воды, обусловленный
возрастающими масштабами хозяйственного и бытового использования и ее
загрязнением.
42. Азот и фосфор как биогенные элементы постоянно
присутствуют в водоемах в виде различных соединений, образующихся при
разложении органического вещества. Избыточное накопление азота, фосфора и
других биогенных элементов в водоемах приводит к интенсивному развитию
фитопланктона (цветению воды), нарушению газового режима, отложению донных
осадков. При разложении органических веществ, кроме того, образуются токсические
продукты: трупные яды, аммиак, нитриты и нитраты, гидразин, гидроксиламин,
сероводород, перекисные соединения, альдегиды и кетоны. Поэтому гибель рыб в
таких водоемах, как правило, происходит от комплекса факторов: нарушения
газового режима водоемов и отравления названными ядовитыми веществами.
43. Гранулометрический состав (механический состав,
почвенная текстура) — относительное содержание в почве, горной породе или
искусственной смеси частиц различных размеров независимо от их химического или
минералогического состава. Гранулометрический состав является важным физическим
параметром, от которого зависят многие аспекты существования и функционирования
почвы, в том числе плодородие.
Под пористостью почвы следует понимать суммарный
объем пор в единице объема почвы, выраженный в процентах. Размер пор и
пористость почвы зависят от ее механического состава. Размер пор в однородной
почве тем больше, чем больший размер имеют отдельные механические элементы
почвы, т. е. ее зернистость. Величина естественных пор почвы, наличие в ней
естественных или искусственных трещин и каналов оказывают существенное влияние
на взаимодействие почвы с воздухом и водой, а также фильтрационную способность
почв. Именно этим обусловлено их гигиеническое значение.
Гигроскопи́чность (от др.-греч. ὑγρός
— влажный и σκοπέω — наблюдаю) — свойство
некоторых веществ поглощать водяные пары из воздуха. Газообразная вода,
задержанная почвой вследствие ее Г., называется гигроскопической. Она всегда
содержится в почве (около 10—12%), как бы ни была, по-видимому, суха последняя,
но не может служить для удовлетворения потребности растений в воде.
Кислотность почвы[1] — способность почвы проявлять
свойства кислот. Актуальная кислотность — это pH почвенного раствора (на
практике измеряется pH водной вытяжки при соотношении почва:вода = 1:2,5 для
минеральных почв и 1:25 для торфяных). Повышенная кислотность почвы негативно
сказывается на росте большинства культурных растений за счёт уменьшения
доступности ряда макро- и микроэлементов, и наоборот, увеличения растворимости
токсичных соединений марганца, алюминия, железа, бора и др., а также ухудшения
физических свойств. Для снижения кислотности прибегают к известкованию.
44. Тяжелые металлы встречаются как в сточных
водах, так и в отработавших газах и в связи со своей токсичностью и широким
распространением представляют особую опасность для окружающей среды. Обычно
тяжелые металлы осаждают и выделяют из сточных вод путем нейтрализации с
помощью натрового щелока или извести в виде труднорастворимых гидроокисей.
45. Пестициды- собирательное название химических и
биологических средств, используемых для борьбы с вредными организмами.
Пестициды объединяют следующие группы таких веществ: гербициды, уничтожающие
сорняки, инсектициды, уничтожающие насекомых-вредителей, фунгициды,
уничтожающие патогенные грибы, зооциды, уничтожающие вредных теплокровных
животных и т. д.
ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
(галогенсодержащие углеводороды) - углеводороды, в молекулах которых один или
несколько атомов водорода замещены на атомы галогена. Сырье в промышленном
органическом синтезе, растворители, хладоны.
В почве пероксид водорода из-за наличия в ней
катализатора бурно разлагается. При этом образующийся кислород большей частью
улетучивается, не вступая в реакцию с токсичными веществами, что усложняет
процесс обезвреживания. Целью изобретения является повышение полноты
обезвреживания и упрощение способа обезвреживания грунта и почвы от
трудноокисляемых токсичных веществ.
46. Радионуклиды из почвы поступают в воду, воздух,
а также включаются в биологические циклы миграции, создавая тем самым
множественность путей внешнего и внутреннего облучения населения. На величину
этих процессов оказывает влияние ряд факторов, прежде всего определяющих
скорость вертикальной миграции. Среди них следует указать: тип почвы, ее
минеральный и органический состав, ландшафтно-геохимические особенности
региона, физико-химическое состояние выпавших радионуклидов и ряд других.
Стронций накапливается в зеленых растениях, в
частности в злаковых (зерно), ис хлебопродуктами поступает в организм человека.
Через сено (корм) он попадает в ткани животных (коров).
Как и радиоактивный стронций, цезий-137 отличает
высокая подвижность во внешней среде, особенно в первое время после его
выпадения, а также по пищевым цепям, которые аналогичны миграции стронция-90.
Еще одна возможная пищевая цепь миграции радионуклидов: источник загрязнения —
лекарственные растения — лекарственное растительное сырье — лекарственный
препарат — человек.
Содержание йода в почвах является основополагающим
фактором обеспечения йодом человека и животных. Содержание йода в почвах
зависит от типа почвы, ее механического состава, рН почвенной среды,
температуры и влажности. Обогащение почвы йодом может производиться путем
внесения в почву йодсодержащих микроудобрений.
Содержание Радия в почве свыше 1·10-7-10-8кюри/кг
заметно угнетает рост и развитие растений.
Адсорбция - поглощение газов,
паров и жидкостей поверхностным слоем твёрдого тела (адсорбента) или жидкости.