Задача осуществления прививочной полимеризации тетрафторэтилена
Министерство
образования и науки Украины
Украинский
государственный химико-технологический университет
Факультет
ТВМС
Кафедра
ХТВМС
Реферат
по
дисциплине Химии мономеров
Подготовила ст.гр.
3-ТВМС-61: Руслана Асоцкая
Приняла работу:
ас., к.х.н. Бугрим М.В.
Содержание
Введение
Общие
сведения
Получение
тетрафторэтилена
Химические
свойства
Реакции
циклизации
Полимеризация
тетрафторэтилена
Применение
История
открытия тефлона
Вывод
Литература
Введение
полимеризация тетрафторэтилен
циклизация тефлон
Общие сведения
Тетрафторэтилен используют в
качестве мономера в производстве политетрафторэтилена (тефлона). Данный
мономер- химическое соединение
<https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B5_%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D0%B5%D0%BD%D0%B8%D0%B5>
углерода
<https://ru.wikipedia.org/wiki/%D0%A3%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4>
и фтора <https://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80> с
химической брутто-формулой C2F4, один из представителей фторолефинов
<https://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D0%BB%D0%B5%D1%84%D0%B8%D0%BD%D1%8B>
- непредельных фторорганических соединений
<https://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80%D0%BE%D1%80%D0%B3%D0%B0%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F>.
Представляет собой тяжёлый газ (почти в 3,5 раза тяжелее воздуха), без цвета и
запаха, растворим во многих органических растворителях и нерастворим в воде.

Молекула тетрафторэтилена плоская, межъядерное
расстояние
<https://ru.wikipedia.org/wiki/%D0%94%D0%BB%D0%B8%D0%BD%D0%B0_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9_%D1%81%D0%B2%D1%8F%D0%B7%D0%B8> C-C - 1,33 ±
0,06 Å, межъядерное
расстояние C-F - 1,30 ± 0,02 Å, угол между связями FCF - 114 ± 3°.
Тетрафторэтилен является мономером,
легко полимеризуется и сополимеризуется практически со всеми мономерами: этиленом
<https://ru.wikipedia.org/wiki/%D0%AD%D1%82%D0%B8%D0%BB%D0%B5%D0%BD>,
пропиленом, фтористым винилиденом, трифторхлорэтиленом и другими, образуя
фторопласты с уникальными свойствами.
Температура плавления -142,50 С
Температура кипения 76,30С
Плотность (при -76,30С) 1,519 г/см3
Стандартная энтальпия образования  - -659,5
кДж/моль
- -659,5
кДж/моль
Получение тетрафторэтилена
Исходным веществом для получения
тетрафторэтилена в промышленном масштабе является дифторхлорметан, который
получают фторированием хлороформа:
+ 2HF CHCLF2 + 2HCl
В лабораторных условиях
тетрафторэтилен получают дебромированием 1,2 - дибромтетрафторэтана цинком
<https://ru.wikipedia.org/wiki/%D0%A6%D0%B8%D0%BD%D0%BA>
 ,
,
или деполимеризацией политетрафторэтилена
<https://ru.wikipedia.org/wiki/%D0%9F%D0%BE%D0%BB%D0%B8%D1%82%D0%B5%D1%82%D1%80%D0%B0%D1%84%D1%82%D0%BE%D1%80%D1%8D%D1%82%D0%B8%D0%BB%D0%B5%D0%BD>
под вакуумом
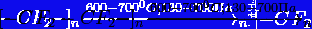 CF2 = CF2 + другие продукты[2]
<https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D1%82%D1%80%D0%B0%D1%84%D1%82%D0%BE%D1%80%D1%8D%D1%82%D0%B8%D0%BB%D0%B5%D0%BD>
CF2 = CF2 + другие продукты[2]
<https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D1%82%D1%80%D0%B0%D1%84%D1%82%D0%BE%D1%80%D1%8D%D1%82%D0%B8%D0%BB%D0%B5%D0%BD>
В промышленности тетрафторэтилен
получают пиролизом хлордифторметана
<https://ru.wikipedia.org/wiki/%D0%A5%D0%BB%D0%BE%D1%80%D0%B4%D0%B8%D1%84%D1%82%D0%BE%D1%80%D0%BC%D0%B5%D1%82%D0%B0%D0%BD>
при температуре 650…8000С:

Считается, что процесс пиролиза
протекает через образование промежуточного дифторкарбена:

Процесс пиролиза сопровождается
образованием большого числа побочных продуктов: гексафторпропилена,
октафторциклобутана и других продуктов.
Химические свойства
На палладиевом катализаторе
тетрафторэтилен присоединяет водород
<https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4>
с образованием 1,1,1,2 - тетрафторэтана
<https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D1%82%D1%80%D0%B0%D1%84%D1%82%D0%BE%D1%80%D1%8D%D1%82%D0%B0%D0%BD>.

При освещении актиничным светом
тетрафторэтилен подвергается галогенированию.

В жёстких условиях тетрафторэтилен
сгорает в кислороде, образуя тетрафторметан
<https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D1%82%D1%80%D0%B0%D1%84%D1%82%D0%BE%D1%80%D0%BC%D0%B5%D1%82%D0%B0%D0%BD>
и дикосид углерода.

При повышенной температуре
тетрафторэтилен подвергается циклодимеризации с образованием
октафторциклобутана.
CF2CF2 → цикло - C4F8
Пиролиз тетрафторэтилена
сопровождается образованием гексафторпропилена. Считается, что образование
гексафторпропилена основано на реакциях дифторкарбена

На реакции пиролиза тетрафторэтилена
основано промышленное производство важного фторсодержащего мономера -гексафторпропилена
<https://ru.wikipedia.org/wiki/%D0%93%D0%B5%D0%BA%D1%81%D0%B0%D1%84%D1%82%D0%BE%D1%80%D0%BF%D1%80%D0%BE%D0%BF%D0%B8%D0%BB%D0%B5%D0%BD>.
Тетрафторэтилен легко полимеризуется по радикальному механизму в присутствии
любых источников радикалов. Полимеризацию осуществляют как суспензионным, так и
эмульсионным сопособом. Они реагируют со спиртами, меркаптанами, аммиаком,
аминами и бисульфитом натрия. Примером таких реакций служит взаимодействие
тетрафторэтилена со спиртами и аминами с образованием эфиров и замещенных
аминов соответственно:

При взаимодействии тетрафторэтилена
с тетраокисыо азота с высоким выходом получается нитронерфторэтилнитрит.
Обычные нитриты при гидролизе превращаются а спирты - этот превращается в
иитродифторуксусную кислоту, которая при обработке щелочью дает
нитродифторметан, а при действии соляной кислотой - в нитрозодифторхлормеган:

Реакции циклизации с участием тетрафторэтилена

Особого упоминания заслуживает реакция с
бутадиеном, в которой могут принимать участие одна или две молекулы
тетрафторэтилена
Циклизация обоих мономеров с акрилонитрилом. Оба
получаемых в результате последней реакции нитрила при щелочном гидролизе
превращаются в α,α-дифторглутаровую
кислоту, например:

Полимеризация тетрафторэтилена
Тетрафторэтилен полимеризируется по радикальному
механизму при высоком давлении (1,5…2,5 МПа) в присутствии инициаторов
радикальных процессов(персульфата калия, пероксида водорода, пероксида
бензоила, персульфат аммония  )
)
Реакция полимеризации имеет вид:

Примесь в исходном мономере - триэтиламин.
Политетрафторэтилен (фторопласт-4), который
образуется в этом случае, имеет молекулярную массу 140000…500000 и плотность
2250…2270 кг/м3. Это негорючий, неплавкий и нерастворимый в воде и органических
растворителях полимер, который по химической стойкости занимает первое место
среди других полимеров.
Применение
Тетрафторэтилен используют в качестве мономера в
производстве политетрафторэтилена (тефлона). Часть тефлон называют
«пластмассовой платиной». Тефлон - линейный полимер. Поперечные химические
связи в нем отсутствуют. Однако между макромолекулами действуют значительные
когезионные силы. В связи с этим тефлон нерастворим ни в одном из обычных
растворителей. Степень полимеризации тетрафторэтилена, вероятно, очень высока.
Было найдено, что молекулярный вес тефлона весьма велик: среднечисловые
значения достигают многих миллионов. Отсюда вытекают также и указанная выше
нерастворимость, высокие механические свойства и чрезвычайно большая вязкость
расплавов. Изделия из тефлона обладают большой твердостью, стойки к истиранию.
Из него изготовляют ряд деталей. Тефлон оказался хорошим материалом для
подшипников. В связи с низким коэффициентом трения, характерным для тефлона,
такие подшипники не нуждаются в применении смазок. Замечательной особенностью
тефлона является его необыкновенная термостойкость: смола не теряет своих
свойств при температурах от -2690 до +2500, т.е. выдерживает температурный
интервал более чем в 5000. Тефлон - один из лучших электроизоляционных
материалов. Это обеспечивает ему широкое применение в электропромышленности. Он
служит в качестве надежной изоляции проводов, кабелей и т.д. В химической
промышленности используется для изготовления установок и аппаратуры,
предназначенной для работы в агрессивных средах (шланги, трубопроводы,
резервуары и т.д.). Область применения тефлона непрерывно расширяется.

История открытия тефлона
 <http://istoriz.ru/wp-content/uploads/2014/04/2-Struktura-teflona.jp>
<http://istoriz.ru/wp-content/uploads/2014/04/2-Struktura-teflona.jp>
Открытие тефлона произошло случайно,
как и многие научные открытия. Это случилось 6 апреля 1938 года. Слава
первооткрывателя принадлежит доктору Рою Дж. Планкетту. Он работал в одной из
лабораторий фирмы Дюпон (DuPont) в штате Нью-Джерси. В ту пору Планкетт изучал
свойства фреонов. Однажды, он под сильным давлением заморозил тетрафторэтилен,
вследствие чего был получен воскообразный белый порошок, который в дальнейшем
продемонстрировал удивительные свойства. Через два года уже был налажен выпуск
нового материала, и мир узнал его под именем «Тефлон». Сейчас самый крупный
производитель тефлона находится в штате Западная Вирджиния. Завод
началдействовать в 1950 году. Потом появились предприятия в Голландии и Японии,
причем голландский завод в Дордрехте обеспечивает тефлоном всю Европу. Едва
тефлон появился на свет в лаборатории, ученые стали с ним увлеченно
экспериментировать. Его «скрещивали» с фтором, что увеличивало термостойкость.
Его наполняли стекловолокном, графитом и бронзой
<http://istoriz.ru/bronza-istoriya-izobreteniya.html>. Все эти
«приправы» меняли свойства тефлона - в зависимости от того, что от него
требовалось в большей мере. Слово «Тефлон» является зарегистрированной торговой
маркой корпорации DuPont. Непатентованное название вещества -
«политетрафторэтилен» или «фторополимер». В СССР и России традиционное
техническое название этого материала - фторопласт. Как всегда, применение
тефлону первыми нашли военные, без фторопластовых уплотнений немыслима ракетная
техника с её ну очень агрессивным топливом, нашлось применение новому материалу
и у прочих мастеров вооружений.
Вывод
Мир органических молекул многообразен и
неисчерпаем, как многообразна и многогранна в своих проявлениях природа, живая
и неживая, познанная нами и еще не познанная. Это бесконечное разнообразие
создается благодаря тому, что атомы могут связываться в различной последовательности,
по разному располагаясь в пространстве, образуя цепи разнообразной формы,
кольца и т. п. Такие молекулы, взаимодействуя между собой, могут в свою очередь
образовывать так называемые макромолекулы. В зависимости от того, сколько и
каких малых молекул (молекул мономера) участвует в построение макромолекулы,
как она располагается в пространстве относительно других макромолекул и как
взаимно ориентированы в пространстве её части, какие молекулы «вспомогательных»
соединений её окружают, зависит колоссальное разнообразие свойств природных и
синтетических высокомолекулярных соединений - полимеров. Человек уже многое
понял в этом мире молекул, но ещё больше осталось непознанного и тем более
интересного.
Литература
1.Коваль
И.В. Химия Мономеров.- Днепропетровск: УГХТУ, 2003.- 180с.
2.
<http://istoriz.ru/teflon-istoriya-izobreteniya.html>
.Технология
пластических масс/ Под ред. В.В. Коршака.- М.: Химия,1985.-559с.
.
<http://www.zomber.ru/himiya-monomerov/107_him_svoystva_tetraftoretilen_triftorhlortilen.php>