Определение влияния воды с измененным изотопным составом на функциональные особенности иммунокомпетентных клеток человека
Реферат
Дипломная работа 64 с., 7 рис., 1 табл., 38
источников.
ДЕЙТЕРИЙ, ЛЕГКАЯ ВОДА, ИМУНОКОМПЕТЕНТНЫЕ КЛЕТКИ,
ЛИМФОЦИТЫ, АПОПТОЗ КЛЕТОК, РЕПАРАЦИЯ ДНК, ФЛУОРИМЕТРИЯ
Объектом исследования данной дипломной работы
являлись ДНК лимфоцитов, выделенные из цельной крови здоровых доноров и больных
с врожденными пороками развития челюстно-лицевой области.
Целью работы являлось определение влияния воды с
измененным изотопным составом на функциональные особенности иммунокомпетентных
клеток человека (определение процентного содержания однонитевых разрывов ДНК).
В результате выполнения дипломной работы были
получены данные о влиянии воды с пониженным содержанием дейтерия на
жизнеспособность иммунокомпетентных клеток in
vitro для здоровых лиц и
больных с врожденными пороками развития челюстно-лицевой области.
СОДЕРЖАНИЕ
Введение
. Литературный обзор
.1 Иммунитет и иммунокомпетентные
клетки человека
.2 Апоптоз клеток
.3 Молекула ДНК
.3.1 Химическая структура ДНК
.3.2 Характер и типы повреждений ДНК
.3.3 Репарация ДНК
.4 Свойства изотопов водорода
.5 Влияние воды с измененным
изотопным составом на биологические объекты
.5.1 Влияние тяжелой воды на
биологические объекты
.5.2 Влияние лёгкой воды на
биологические объекты
. Экспериментальная часть
.1 Определение содержания дейтерия в
питьевой воде
.2 Выявление и выделение лимфоцитов
из цельной крови человека
.3 Инкубирование лимфоцитов в воде с
измененным изотопным составом и определение однонитевых разрывов ДНК
.4 Изучение влияния воды с
измененным изотопным составом на состояние ДНК лимфоцитов
Заключение
Список использованных источников
введение
Вода является основой жизнедеятельности
организма. Живые организмы на 65-70% состоят из воды. Важным показателем
качества воды является ее изотопный состав. Природная вода на 99,7% состоит из
протия и кислорода-16. Оставшиеся 0,3% представлены изотопными разновидностями
молекул воды. Научно доказано, что природная вода с пониженным содержанием
тяжелых изотопов водорода и кислорода обладает стимулирующими и лечебными свойствами,
то есть живая клетка реагирует даже на небольшое изменение содержания тяжелых
изотопов в воде. Снижение концентрации тяжелой воды даже на 2-3% резко
увеличивает биостимулирующие свойства воды.
Одним из самых важных и наиболее интересующих
нас в этой работе изотопов водорода является дейтерий. Как оказалось,
содержание его в воде напрямую сказывается на жизненно важных свойствах воды и
влияет на обменные процессы в живых организмах. Поскольку последнее время остро
стоит проблема минимизации отрицательного влияния внешних факторов на
физическое благополучие человека, изучение дейтерия и уменьшение его содержания
в воде ежедневного использования является одной из перспективнейших и важнейших
экологических задач на сегодняшний момент.
Изучение возможных механизмов влияния изотопного
состава воды на работу биологических систем показало их сложность и
разнообразие. Высказаны предположения о воздействии дейтерия на системы
водородных связей, обеспечивающие структуру и функции макромолекул. При
инкубации клеток в воде с измененным относительно первоначального соотношением
D/H, изменяется не только соотношение дейтериевой и протиевой воды внутри
биологической системы как растворителя, но также осуществляется изотопный обмен
в гидроксильных, сульфгидрильных, карбоксильных и аминогруппах молекул всех
органических соединений.
Вода с пониженным содержанием дейтерия оказывает
стимулирующее действие на живые системы, существенно повышает их активность,
жизнестойкость к различным негативным факторам, репродуктивную деятельность,
улучшает и ускоряет обмен веществ.
В настоящее время значительное развитие получили
исследования биологических эффектов воды с пониженным содержанием дейтерия. Ее
положительные свойства и успешное использование в качестве вещества, влияющего
на скорость протекания химических реакций, сольватации и подвижности ионов,
позволяют предположить ее благоприятное действие на клеточные структуры
иммунокомпетентных клеток для предотвращения их неконтролируемого массового
апоптоза.
Многочисленные данные по изучению
функционального статуса системы лимфоцитов, основной в клеточном отношении
клеточной популяции периферической крови, оснащенной мощными микробицидными и
цитотоксическими механизмами, является основанием для изучения роли данных
клеток в патогенезе различных патологий, сопряженных с цитолитическим
процессом. Лимфоциты являются источником активных форм кислорода, осуществляют
первую линию защиты и от их хемотаксической, фагоцитарной и метаболической
активности во многом зависит состояние иммунной системы и организма в целом.
Целью работы являлось исследование влияния воды
с измененным изотопным составом на функциональные особенности
иммунокомпетентных клеток человека.
Для достижения цели были поставлены следующие
задачи:
изучение литературы, посвященной воздействию
воды с измененным изотопным составом на живые системы;
выделение лимфоцитов из цельной крови человека в
норме и патологии;
инкубирование лимфоцитов в физиологическом
растворе, приготовленном на воде с различным изотопным составом;
лизирование клеток, моделирование однонитевых
разрывов ДНК и определение их процентного содержания флуориметрическим методом;
изучение влияния воды с измененным изотопным
составом на состояние ДНК лимфоцитов.
1. Литературный обзор
.1 Иммунитет и
иммунокомпетентные клетки человека
Иммунитет - невосприимчивость, сопротивляемость
организма к инфекциям и инвазиям чужеродных организмов (в том числе -
болезнетворных микроорганизмов), а также воздействию чужеродных веществ,
обладающих антигенными свойствами. Иммунные реакции возникают и на собственные
клетки организма, измененные в антигенном отношении [1].
Биологический смысл иммунитета - обеспечение
генетической целостности организма на протяжении его индивидуальной жизни.
Развитие иммунной системы обусловило возможность существования сложно
организованных многоклеточных организмов[2].
Иммунитет делится на врождённый и приобретенный.
Врождённый (неспецифический, конституционный)
иммунитет обусловлен анатомическими, физиологическими, клеточными или
молекулярными особенностями, закрепленными наследственно. Как правило, не имеет
строгой специфичности к антигенам, и не обладает памятью о первичном контакте с
чужеродным агентом [2].
Приобретенный иммунитет делится на активный и
пассивный.
Приобретенный активный иммунитет возникает после
перенесенного заболевания или после введения вакцины.
Приобретенный пассивный иммунитет развивается
при введении в организм готовых антител в виде сыворотки или передаче их
новорожденному с молозивом матери или внутриутробным способом.
Также иммунитет делится на естественный и
искусственный.
Естественный иммунитет включает врожденный
иммунитет и приобретенный активный (после перенесенного заболевания), а также
пассивный при передаче антител ребёнку от матери.
Искусственный иммунитет включает приобретенный
активный после прививки (введение вакцины) и приобретенный пассивный (введение
сыворотки).
Выделяют центральные и периферические органы
иммунной системы. К центральным органам относят красный костный мозг и тимус, а
к перифрическим - селезенку, лимфатические узлы, а также местноассоциированную
лимфоидную ткань: бронхассоциированную, кожноассоциированную,
кишечноассоциированную [3].
Красный костный мозг - центральный орган
кроветворения и иммуногенеза. Содержит самоподдерживающуюся популяцию стволовых
клеток. Красный костный мозг находится в ячейках губчатого вещества плоских
костей и в эпифизах трубчатых костей. Здесь происходит дифференцировка
В-лимфоцитов из предшественников. Содержит также Т-лимфоциты.
Тимус - центральный орган иммунной системы. В
нем происходит дифференцировка Т-лимфоцитов из предшественников, поступающих из
красного костного мозга.
Лимфатические узлы - периферические органы
иммунной системы. Они располагаются по ходу лимфатических сосудов. В каждом
узле выделяют корковое и мозговое вещество. В корковом веществе есть
В-зависимые зоны и Т-зависимые зоны. В мозговом есть только Т-зависимые зоны.
Селезёнка - паренхиматозный зональный орган.
Является самым крупным органом иммунной системы, кроме того, выполняет
депонирующую функцию по отношению к крови. Селезёнка покрыта капсулой из
плотной соединительной ткани, которая содержит гладкомышечные клетки,
позволяющие ей при необходимости сокращаться. Паренхима представлена двумя
функционально различными зонами: белой и красной пульпой. Белая пульпа
составляет 20 %. Представлена лимфоидной тканью. Здесь имеются В-зависимые и
Т-зависимые зоны. И также здесь есть макрофаги. Красная пульпа составляет 80 %
[3]. Она выполняет следующие функции:
депонирование зрелых форменных элементов крови;
контроль состояния и разрушения старых и
повреждённых эритроцитов и тромбоцитов;
фагоцитоз инородных частиц;
обеспечение дозревания лимфоидных клеток и
превращение моноцитов в макрофаги;
Иммунокомпетентные клетки - это клетки, входящие
в состав иммунной системы. Все эти клетки происходят из единой родоначальной
стволовой клетки красного костного мозга. Все клетки делятся на 2 типа:
гранулоциты и агранулоциты. К гранулоцитам относят нейтрофилы, эозинофилы и
базофилы. К агранулоцитам: макрофаги и лимфоциты (B, T).
Нейтрофилы - это неделящиеся и короткоживущие
клетки. Они составляют 95 % от гранулоцитов. Нейтрофилы содержат огромное
количество антибиотических белков, которые содержатся в различных гранулах. К
этим белкам относятся лизоцим (мурамидаза), липопероксидаза и другие
антибиотические белки. Нейтрофилы способны самостоятельно мигрировать к месту
нахождения антигена, так как у них есть рецепторы хемотаксиса (двигательная
реакция на химическое вещество). Нейтрофилы способны «прилипать» к эндотелию
сосудов и далее мигрировать через стенку к месту нахождения антигенов. Далее
проходит фагический цикл, и нейтрофилы постепенно заполняются продуктами
обмена. Далее они погибают и превращаются в клетки гноя [4].
Эозинофилы составляют 2-5 % от гранулоцитов.
Способны фагоцитировать микробы и уничтожать их. Но это не является их главной
функцией. Главным объектом эозинофилов являются гельминты. Эозинофилы узнают
гельминтов и экзоцитируют в зону контакта вещества - перфорины. Эти белки
встраиваются в билипидный слой клеток гельминта. В них образуются поры, внутрь
клеток устремляется вода, и гельминт погибает от осмотического шока.
Базофилы составляют меньше, чем 0,2 % от
гранулоцитов. Существуют две формы базофилов: собственно базофилы - базофилы,
циркулирующие в крови и тучные клетки - базофилы, находящиеся в ткани. Тучные
клетки располагаются в различных тканях, лёгких, слизистых и вдоль сосудов. Они
способны вырабатывать вещества, стимулирующие анафилаксию (расширение сосудов,
сокращение гладких мышц, сужение бронхов). При этом происходит взаимодействие с
иммуноглобулином. Таким образом они участвуют в аллергических реакциях. В
частности, в реакциях немедленного типа.
Моноциты превращаются в макрофаги в селезёнке.
Макрофаги профессиональные и антогенпрезентирующие [4].
Главная функция профессиональных макрофагов -
обеспечить фагоцитарную защиту от микробной инфекции. Также они способны
фагоцитировать повреждённые клетки организма, в том числе клетки крови.
Макрофаги секретируют цитокины, привлекающие нейтрофилы и эозинофилы к месту
нахождения антигенов.
Роль антигенпрезентирующих макрофагов -
поглощение микробов и представление их Т-лимфоцитам. Макрофаги принимают
участие в иммунном ответе на всех его этапах.
Натуральные киллеры (NK-клетки) - незрелые
Т-лимфоциты, обладающие цитотоксичной активностью, то есть они способны:
прикрепляться к клеткам-мишеням, секретировать токсичные для них белки, убивать
их или отправлять в апоптоз. Натуральные киллеры распознают клетки, поражённые
вирусами и опухолевые клетки.
Макрофаги, нейтрофилы, эозинофилы, базофилы и
натуральные киллеры обеспечивают прохождение врождённого иммунного ответа,
который является неспецифичным.
Свою основную функцию иммунная система
осуществляет через развитие специфических (иммунных) реакций, в основе которых
лежит способность распознавания своего и чужого и последующая элиминация
чужеродного. Появляющиеся в результате иммунной реакции специфические антитела
составляют основу гуморального иммунитета, а сенсибилизированные лимфоциты
являются основными носителями клеточного иммунитета [2].
Работа иммунной системы характеризуется высокой
специфичностью реакций и существованием феномена «иммунологической памяти».
Специфичность иммунных реакций проявляется в
том, что на антиген А вырабатывается антитела или клетки анти-А, которые ни с
каким другим антигеном не взаимодействуют, а на антиген В вырабатываются только
антитела или клетки анти-В. Феномен «иммунологической памяти» характеризуется
тем, что повторный контакт с антигеном вызывает ускоренное и усиленное развитие
иммунного ответа, что обеспечивает более эффективную защиту организма по
сравнению с первичной иммунной реакцией [2]. Эта особенность вторичной иммунной
реакции лежит в основе смысла вакцинации, которая успешно защищает от
большинства инфекций. Следует отметить, что иммунные реакции не всегда
выполняют только защитную роль, они могут быть причиной иммунопатологических
процессов в организме и обусловливать целый ряд соматических заболеваний
человека.
1.2 Апоптоз клеток
иммунитет изотоп водород кровь
Апоптоз и некроз - два разных механизма
отмирания индивидуальных клеток тканей, органов человека и животных. Эти
варианты характеризуются различными морфологическими и молекулярными явлениями
и разным влиянием на окружающие ткани.
Апоптоз - форма гибели клеток в многоклеточном
организме вследствие реализации программы, приводящей к поэтапному прекращению
его жизнедеятельности. При апоптозе в клетке наблюдаются характерные
молекулярные проявления, приводящие к цитологическим изменениям, которые
характеризуются уменьшением ее размера, сморщиванием цитоплазматической
мембраны, переходом фосфатидилсерина из внутреннего монослоя цитоплазматической
мембраны в наружный монослой, конденсацией и фрагментацией ядра (кариопикноз и
кариорексис), фрагментацией ДНК хромосом. Затем вследствие распада ядра и
цитоплазмы формируются апоптические мембраносвязанные тельца с внутриклеточным
содержимым, которые в последующем подвергаются фагоцитозу [5].
Другая форма гибели клетки - некроз возникает
как патологический процесс в результате воздействия на нее внешнего
повреждающего фактора. Синоним термина некроз - «гибель клетки от повреждения».
Одним из основных механизмов гибели клетки вследствие некроза является
повреждение ее плазматической мембраны, лизис, что приводит к нарушению ее
ионного состава, набуханию мембранных органелл, разрыву лизосомальных мембран
и, как следствие, деструкции цитоплазматических структур. Во внеклеточном
пространстве продукты деструкции некротических клеток вызывают воспалительный
процесс. В дальнейшем клеточный детрит поглощается фагоцитами [5]. Обычно
некроз характерен для нескольких клеток, формирующих группы, в то время как
апоптоз может наблюдаться в одной клетке.
В отличие от некроза апоптоз - не обязательно
проявление патологического процесса. Этот важный внутриклеточный процесс часто
инициируется во время нормального жизненного цикла клетки с целью поддержания
гомеостаза в организме. Апоптоз является важным механизмом изменения
численности клеток в развитии организма. Существует множество физиологических
процессов (наблюдающихся в основном в ходе морфогенеза или поддержания
нормального состава обновляющихся клеточных популяций), когда клетки,
завершившие свой жизненный цикл, удаляются путем апоптоза. Этот процесс
характерен для формирования в эмбриональном онтогенезе суставных щелей,
разделения пальцев верхних и нижних конечностей и др. У детей в возрасте 8-14
лет путем апоптоза погибает до 20-30 миллиардов клеток каждый день, а в
организме взрослого человека - среднем от 50 миллиардов до 70 миллиардов
клеток.
Апоптоз контролируется различными клеточными
сигналами, которые носят экстраклеточный или интраклеточный характер [5, 6] и
приводят к повреждению ДНК [6]. В процесс апоптоза клетки вовлекаются с
увеличением возраста, под действием ультрафиолета, химических или физических факторов,
токсинов, гормонов, факторов роста, оксида азота и др., а также при таких
заболеваниях, как СПИД, болезнь Альцгеймера и Паркинсона, инфаркт миокарда,
остеопороз, остеоартроз и др.
Апоптоз может иметь место, если в клетке
произошла мутация, которая может привести к неконтролируемому опухолевому
росту, при этом низкий уровень апоптоза способствует прогрессированию
опухолевого процесса. Однако точка зрения на этот факт неоднозначна. В
последние годы получены данные, что у низкодифференцированных опухолей имеет
место высокая апоптозная активность, а у высокодифференцированных она
значительно ниже [7].
Путем апоптоза клетки погибают при
воспалительном процессе, в частности, гибель лимфоцитов отмечается на
заключительных этапах инфекционного процесса, когда организм уже не нуждается в
дальнейшей выработке антител. Однако высокий уровень апоптоза может приводить к
выраженному снижению численности клеток, например при нейродистрофических
процессах.
Таким образом, клеточные сигналы, контролирующие
апоптоз, могут носить позитивный или негативный характер.
К гибели клетки путем апоптоза приводит класс
протеаз, называемых каспазами, которые присутствуют в клетке в неактивной форме
(в качестве проэнзимов). Каспазы - семейство эволюционно консервативных
цистеиновых протеаз, которые специфически активируются в апоптозных клетках и
играют ключевую роль в механизмах программируемой смерти клетки. В своих
субстратах они катализируют гидролиз пептидных связей, образованных
карбоксильными группами аспарагиновой кислоты [8].
В целом процесс апоптоза можно представить в
виде трех этапов [9]:
активация каспаз специфическим сигналом;
активация эффекторных каспаз инициирующими
каспазами, первые выполняют функцию расщепления в специфических местах;
деградация важных клеточных белков каспазами.
Финальная стадия апоптоза характеризуется
разрушением ДНК и формированием апоптозных телец различной формы и размера.
Молекулярные процессы апоптоза запускаются в
цитозоле, на мембранах, но реализуются только в ядре за счет репрессии генов и
необратимого процесса межнуклеосомной фрагментации ДНК. В зависимости от
стимулов, инициирующих апоптоз, можно выделить два главных внутриклеточных
апоптозных сигнальных каскада: путь через рецепторы смерти и митохондриальный
путь.
Механизмы активации инициирующих каспаз могут
быть различными. Рецепторный путь запуска каспазного каскада начинается с
активации расположенных на клеточной мембране рецепторов, воспринимающих
внешний сигнал.
В последние годы получены данные, касающиеся
роли митохондрий в апоптозе. При митохондриальном пути запуска каспазного
каскада ключевым звеном является изменение состояния митохондрий.
Выделены три фазы, включающие:
премитохондриальную, на которой происходит
активация путей повреждения;
митохондриальную, свзанную со снижением функции
митохондрий;
постмитохондриальную, проявляющуюся выделением
из митохондрий активных проапоптозных компонентов, приводящих к гибели клетки
[9].
При нарушении целостности мембраны из
митохондрий выходит ряд белков. В митохондриях существует и некаспазный путь,
приводящий к апоптозу. На наружной мембране митохондрий локализована большая
часть белков семейства Bcl-2, в состав которого входят промоторы (Bax, Bid и
Bik) и ингибиторы (собственно Bcl-2 и Bcl-XL) апоптоза. От соотношения
активности этих белков зависит, состоится апоптоз или нет. Особую роль играет
белок Bcl-2 как фактор антиапоптического действия. В норме он закрывает
митохондриальные поры, препятствуя высвобождению цитохрома С.
Один из белков семейства Bcl-2, промотор
апоптоза Bid, может связывать рецепторный и митохондриальный пути.
Митохондрии являются ключевым звеном в передаче
сигнала во время апоптоза, связанного с повреждением ДНК при действии на клетку
разного рода факторов. Важную роль при этом играет также белок p53, который,
перемещаясь в митохондрию, стимулирует открытие пор.
Описаны дополнительные пути апоптоза, которые
могут происходить в комплексе Гольджи. В нем экспрессируется каспаза 2,
основной мишенью которой является расщепление белка гольджин-160, индуцирующего
апоптоз.
Многие молекулярные механизмы апоптоза на
сегодняшний день расшифрованы. Выделены ключевые белки, обеспечивающие процессы
апоптоза, однако механизмы их активации требуют дальнейших исследований.
Остается открытым вопрос о том, сможет ли клетка выйти из апоптоза, включенного
физиологическим апоптическим сигналом, особенно в случае, если каспазы уже были
активированы [10].
Методы исследования апоптоза подробно описаны
[11]. Метод световой микроскопии позволяет выявить клетки с пикнотичными
ядрами, а также вариант апоптического нарушения структуры ядра - кариорексис.
Используют гистохимические методы, позволяющие выявить белки - маркеры
апоптоза. Больше информации можно получить при использовании флюоресцентной
микроскопии, основанной на применении для окраски флюоресцентных красителей.
Клетки с апоптозом возможно верифицировать методом проточной цитофотометрии.
Олигонуклеосомную деградацию ДНК изучают методом in situ. Фазы формирования
нарушений в ядре и формирование апоптических телец возможно выявить методом электронной
микроскопии.
1.3 Молекула ДНК
Р. Альтман впервые получил нуклеиновую кислоту,
свободную от белков в 1889 г. и ввел этот термин в биохимию [12]. В результате
дальнейшего изучения химического состава нуклеиновых кислот удалось установить,
что в природе их существует два типа, причем долгое время существовала
уверенность в том, что ядра клеток животных содержат только ДНК, а ядра клеток
растений - только РНК. И лишь к середине 1930-х годов было доказано, что ДНК и
РНК содержатся в каждой живой клетке. Первостепенная роль в утверждении этого
фундаментального положения принадлежит А. Н. Белозерскому, впервые выделившему
ДНК из растений. С развитием методов цитохимии и гистохимии к концу 1940-х
годов было установлено, что ДНК локализуется преимущественно в ядре, а РНК - в
цитоплазме клеток [13].
К началу 1950-х годов работы по изучению
химического строения нуклеиновых кислот были завершены. Было выяснено строение
их мономеров - нуклеозидов и нуклеотидов, и доказано, что и в ДНК, и в РНК
нуклеотидные остатки связаны между собой в полимер только фосфодиэфирной
связью. Выдающейся вехой в изучении нуклеиновых кислот стало открытие О. Эйвери
с сотрудниками, которые показали, что с помощью чистой ДНК наследуемый признак
может быть перенесен из одной клетки в другую. Так было доказано, что ДНК
является носителем генетической информации. В 1953 г. Дж. Уотсон и Ф. Крик
сумели правильно интерпретировать данные рентгенеструктурного анализа ДНК,
накопленные в лабораториях Р. Франклин и М. Уилкинса, и на их основе построить
модель пространственной структуры ДНК. Они показали, что макромолекула ДНК -
это регулярная двойная спираль, в которой две полинуклеотидные цепи строго
комплементарны друг другу. Из анализа модели следовало, что после расплетания
двойной спирали на каждой из полинуклеотидных нитей может быть построена
комплементарная ей новая, в результате чего образуются две дочерние молекулы,
неотличимые от материнской ДНК. Через пять лет М. Мезельсон и Ф. Сталь
экспериментально подтвердили этот механизм, а несколько раньше в 1956 году А.
Корнберг открыл фермент ДНК-полимеразу, который на расплетенных нитях, как на
матрицах, синтезирует новые, комплементарные им цепи ДНК [14].
Открытие генетической роли ДНК потребовало
решения другой фундаментальной задачи - поддержания стабильности молекулы ДНК и
ее постоянства при передаче в ряду поколений.
Созданию современных представлений о метаболизме
ДНК и гармоничном взаимодействии процессов репликации, рекомбинации и репарации
во время клеточного цикла препятствовала утвердившаяся к середине 50-х годов
прошлого века парарадигма о безупречности и совершенстве - а, следовательно, и
неизменности - двунитевой молекулы ДНК. Вторая половина XX века прошла под
знаком изменения этой парадигмы и осознания динамического равновесия между
постоянно возникающими повреждениями ДНК и восстановлением этих повреждений.
1.3.1 Химическая
структура ДНК
Молекулы ДНК являются линейными макромолекулами,
представляющими собой длинные двойные цепи полимеров, составленных из
мономеров, получивших название нуклеотидов (малых органических молекул) и
являющихся строительными блоками ДНК. У всех живых существ макромолекулы ДНК
построены по одному и тому же плану. Они слагаются в основном из одних и тех же
нуклеотидов, каждый из которых содержит по одной молекуле фосфорной кислоты и
сахара, а также одно из четырех азотистых оснований - аденин, гуанин, цитозин
или тимин. Аденин и гуанин являются пуриновыми основаниями, тогда как тимин и
цитзин - пиримидиновыми. Пурины и пиримидины называют основаниями по той причине,
что в кислой среде они способны присоединять к себе ион водорода. Пиримидины
являются производными шестичленного пиримидинового кольца, тогда как пурины
представляют основания, у которых второе пятичленное кольцо слито с
шестичленным кольцом.
Сахаром в ДНК является дезоксирибоза,
отличающаяся от глюкозы тем, что в ее молекуле не 6, а 5 атомов углерода, т. е.
является пятиуглеродным сахаром (пентозой). Особенностью этого сахара является
также то, что он имеет атом водорода, присоединенный к одному из атомов
углерода, но не гидроксильную группу. Следовательно, этот сахар представляет
собой дезоксирибозу, т. к. он является рибозой, лишенной кислорода.
Сахарофосфат соединяется с азотистым основанием,
такая структура носит название нуклеозида. Таким образом, химическими группами,
которые образуют ДНК, являются пуриновые и пиримидиновые азотистые основания
(аденин, гуанин, тимин и цитозин), сахар (дезоксирибоза) и фосфорная кислота.
РНК характеризуется такой же структурой, как и
ДНК. Однако в отличие от ДНК в РНК сахаром является рибоза с кислородом,
представляющая собой сахар с 5 атомами углерода, к одному из которых
прикреплена гидроксильная группа. Кроме того, в РНК тимин не имеет метильной
группы и является урацилом, т. е. в РНК тимин заменен на урацил, также
являющийся пиримидиновым основанием [14].
Нуклеиновые кислоты называют кислотами по той
причине, что их фосфатные группы освобождают в растворах ионы водорода.
Для ДНК характерна структура трех видов -
первичная, вторичная и третичная. Первичная структура ДНК заключается в том,
что ДНК состоит из нуклеотидных цепей, у которых скелетную основу составляют
чередующиеся сахарные и фосфатные группы, объединенные ковалентными
фосфодиэфирными, скелетными связями, а боковые группы представлены тем или иным
основанием и присоединяются одна к другой молекулой сахара. Последовательно
располагающиеся нуклеотиды ковалентно связаны фосфодиэфирными связями между
сахарным остатком и фосфатом, и в результате этого объединены в
полинуклеотидную цепь. Таким образом, первичная структура ДНК (как и РНК)
определяется последовательностью нуклеотидов и характером их связей между
сахарным остатком и фосфатом.
Представления о вторичной структуре ДНК были
сформулированы Д. Уотсоном и Ф. Криком еще в 1953 г [14].
Молекула ДНК построена из двух скрученных
направо спиралевидных полинуклеотидных цепей, причем каждый виток спирали
соответствует 10 азотистым основаниям или расстоянию в 3,4 нм [15]. Молекулы
ДНК, цепи которых скручены направо, первоначально назвали В-формой.
Обе цепи объединены в результате закручивания
одной цепи вокруг другой по общей оси. Из-за противоположной последовательности
атомов в каждой цепи обе цепи инвертированы относительно одна другой.
Сахарофосфатные группы располагаются на внешней
стороне двойной спирали, тогда как основания находятся внутри спирали под
прямым углом и вдоль ее оси. Диаметр молекулы составляет 2 нм, расстояния между
отдельными азотистыми основаниями в молекуле равны 0,34 нм. Таким образом, ДНК
представляет собой скрученную в правостороннем направлении двойную спираль, в
которой пары азотистых оснований А - Т и Г - Ц в комплементарных
полинуклеотидных цепях подобны перекладинам в лестнице, а сахарофосфатные цепи
являются каркасом этой лестницы.
Цепи в молекуле не идентичны, но комплементарны и
удерживаются слабыми водородными связями между азотистыми основаниями, причем
спаривание азотистых оснований для связывания цепей имеет специфический
характер. Водородные связи устанавливаются не просто между азотистыми
основаниями цепей, а специфически между пуриновым азотистым основанием одной
цепи и пиримидиновым азотистым основанием другой. В результате этого аденин
одной из цепей связывается с тимином другой цепи двумя водородными связями,
тогда как гуанин одной из цепей связывается с цитозином, находящимся в другой
цепи, посредством трех водородных связей.
1.3.2 Характер и типы
повреждений ДНК
Повреждения молекул ДНК классифицируются
следующим образом:
разрывы углеводно-фосфатного остова молекул;
вставки отдельных нуклеотидов;
выпадения отдельных нуклеотидов;
химические изменения отдельных нуклеотидов;
замен отдельных нуклеотидов;
образование сшивок азотистых оснований в
пределах одной нити ДНК;
образование сшивок азотистых оснований между
разными нитями ДНК;
образование сшивок между ДНК и белками.
Разрывы углеводно-фосфатного остова молекул ДНК
приводят к различным перестройкам хромосом [16].
Вставки или выпадения отдельных нуклеотидов
выражаются в том, что транскрибируемая с такого участка мРНК оказывается
измененной. Однако если изменение произошло в промоторно-операторной области,
то транскрипция будет изменена: она может не происходить вовсе, быть
замедленной или ускоренной, может утратить способность к регуляции и т. д.
Такие изменения могут привести к появлению терминирующего кодона в необычном месте,
что отразится на размере и, конечно, качестве синтезированной мРНК. Если
изменение не затронуло область, способную влиять на транскрипцию, и
транскрипция прошла нормально, то результат изменения может проявиться в
качестве продукта трансляции. Все будет зависеть от того, в какой по значимости
области произошло изменение.
Однако может случиться так, что одновременно с
выпадением одного из нуклеотидов в близлежащей области произойдет вставка
другого нуклеотида. В этом случае второе изменение как бы исправляет результат
первого. Одна мутация исправляет другую. Такие мутации получили название
супрессорных [17]. Ввиду того, что генетический код триплетен, очевидно, что
выпадение или вставка трех нуклеотидов подряд, если такие изменения не
затрагивают существенно важную для функции область, не окажут большого влияния
на протекание транскрипции, трансляции и последующее функционирование белкового
продукта.
Химические изменения или замены отдельных
нуклеотидов в молекулах ДНК проявляются в виде генных мутаций либо сразу же,
либо после акта очередной репликации ДНК, вследствие включения во вновь
синтезированную цепь ДНК нуклеотида с измененным азотистым основанием. При этом
возможны два типа замен: пурин заменяется на пурин, а пиримидин - на пиримидин
или же пурин заменяется на пиримидин, а пиримидин на пурин. Первый тип замен
называют транзициями, второй - трансверсиями. Как правило, замены типа
транзиций или трансверсий приводят к появлению двух типов мутаций: нонсенс
(бессмысленных) или миссенс (с искаженным смыслом) мутаций. При миссенс-мутации
в процессе трансляции в определенную позицию помпептидной цепи включается
другая аминокислота. При нонсенс-мутации кодон заменяется таким, который не
определяет включение ни одной из аминокислот. Следовательно, значащий кодон
превращается в незначащий, терминирующий. Естественно, важность такого рода
мутаций тем больше, чем в более существенной области она произошла. Как
правило, нонсенс-мутации очень сильно отражаются на структуре и функциональной
активности соответствующих белков, вплоть, до полной утраты ими активности и
летального для клетки исхода [17]. Если же считываемый оперон состоит из
нескольких структурных генов, а нонсенсмутация произошла в первом из них, то
она существенно понижает синтетическую активность всех последующих генов
оперона. Такие мутации называют полярными. Например, у гистидинового оперона
сальмонеллы, состоящего из семи структурных генов, нонсенс-мутации в четырех из
них не только инактивировали сами гены, но и в 2-10 раз снижали синтетическую
активность генов, транскрибировавшихся после мутировавших.
Не все мутагенные факторы, вызывают однотипные
изменения в молекулах ДНК. Одни из них приводят к замене оснований, другие - к
сдвигу порядка считывания кодонов, третьи - более эффективно разрывают
углеводно-фосфатный остов в молекулах ДНК и т. д.
Наиболее полно молекулярные механизмы
мутагенного действия выяснены для аномальных нуклеотидов и азотистой кислоты
[18]. Мутагенное действие аномальных оснований появляется в замене одной пары
нуклёотидов на другую. Это возможно по следующим причинам. Каждое азотистое
основание может находиться в одной из двух возможных для него таутомерных форм:
в одном случае кетонной или энольной, в другом - аминной или иминной. Так,
аденин и гуанин чаще находятся в амино-форме, а цитозин с тимином - в
кето-форме. Довольно редко имеет место спонтанный переход одной формы основания
в другую. При этом переход аденина из амино- в имино-форму влечет за собой
изменения спаривания этого основания. В новой форме аденин спаривается не с
тимином, а с гуанином. В следующем акте репликации гуанин, как положено,
образует пару с цитозином. В итоге в определенном месте ДНК пара А - Т будет
заменена на пару Г - Ц. Такие замены возможны спонтанно и с другими
основаниями, что является одной из причин спонтанных мутаций. Аномальные
основания с большей частотой претерпевают таутомервые превращения и поэтому
частота мутаций при внесении их в клетки возрастает.
Азотистая кислота не является азотистым
основанием. Но она способна реагировать с азотистыми основаниями, вызывая
дезаминирование последних. При этом аденин превращается в аномальное основание
гипоксантин, а цитозин - в урацил. Гипоксантин спаривается с цитозином,
вследствие чего происходит замена пары А - Т на Г - Ц, а урацил, как известно,
спаривается с аденином, вследствие чего произойдет замена пары Г - Ц на А - Т.
Алкилирующие агенты, обладают способностью
передавать азотистым основаниям имеющуюся у них метильную или этильную группу.
В результате возникают модифицированные основания с измененной способностью к
образованию водородных связей, что обусловливает уже описанные эффекты. Но
алкилирующие агенты обладают и другим механизмом мутагенного действия. Они
способны разрывать связь гуанина и аденина с дезоксирибозой, что приводив к выпадению
основания. На место выпавшего основания может по ошибке включиться другое и
вызвать мутацию. Кроме того, алкилирующие агенты способны разрывать
углеводно-фосфатный остов ДНК» что вызывает различные перестройки хромосом.
1.3.3 Репарация ДНК
Повреждение ДНК может приводить к появлению
мутаций, провоцировать гибель клетки или служить толчком к ее злокачественному
перерождению [19]. Для предотвращения таких последствий в клетке существует
несколько взаимодополняющих ферментативных систем, которые поддерживают
процессы, носящие общее название репарация ДНК. Главная цель всех этих систем -
восстановление последовательности ДНК, существовавшей до ее повреждения, или,
если это невозможно, сведение изменений к минимуму. Системы репарации ДНК
обеспечивают точность воспроизведения и сохранения генетической информации.
Осуществляется специальными ферментными системами клетки.
Обычно рассматривают три основных механизма
репарации: фоторепарацию (фотореактивацию), эксцизионную репарацию и
пострепликативную репарацию.
Эксцизионная репарация заключается в узнавании
повреждения ДНК, вырезании (эксцизии) повреждённого участка, ресинтезе ДНК по
матрице интактной цепочки и восстановлении непрерывности цепи ДНК.
Пострепликативная репарация включается в тех
случаях, когда эксцизионная репарация не справляется с устранением всех повреждений,
возникших в ДНК до её репликации. В этом случае воспроизведение повреждённых
молекул приводит к появлению молекул с однонитевыми пробелами, а нативная
структура восстанавливается с использованием этапа рекомбинации. Ферменты
репарации принимают участие в редупликации и рекомбинации, а также в
мутационном процессе [20]. В последнем случае в клетке работает особый тип
индуцибельной репарации, склонной к ошибкам. В результате происходит
восстановление нативной структуры ДНК, однако, с искажением заключённой в ней
генетической информации.
Считается, что нарушение механизмов репарации
ДНК в целом приводит к различным патологическим процессам, в число которых
входят канцерогенез, дефекты развития и старение. На сегодняшний день известен
ряд наследственных заболеваний, причиной которых служат нарушение репарации
ДНК. Дефекты системы эксцизионной репарации нуклеотидов приводят к
возникновению пигментной ксеродермы, синдрома Кокейна и трихотиодистрофии [21].
Наследственный неполипозный рак толстой кишки может вызываться мутациями
некоторых генов системы репарации гетеродуплексов. Многие синдромы
предрасположенности к онкологическим заболеваниям - ретинобластома , семейный
аденоматозный полипоз и т.п. - связаны с нарушениями систем ответа на
повреждение ДНК.
1.4 Свойства изотопов
водорода
Водород представляет собой смесь трех изотопов:
легкий изотоп протий, затем тяжелые изотопы - дейтерий и тритий. Содержание
трития в природе ничтожно. Но дейтерий - небольшая, но постоянная примесь к
протию, обращает на себя внимание.
Распространенность дейтерия в природе настолько
мала, что он долгое время «прятался» от исследователей, маскируясь под ошибки
опытов, недостаточную точность измерений. Лишь в 1931 г. К. М. Бэрдж и Г. И.
Мендель, сопоставляя значения атомного веса водорода, определенные химически и
масс-спектрографически (1,00777 ±0,00002 и 1,00756±0,00015), нашли, что разницу
между этими значениями объяснить ошибкой опытов нельзя. Ученые пришли к выводу
о существовании тяжелого изотопа с атомным весом 2. Они вычислили и изотопное
отношение - приблизительно 1 : 4700 [22].
Следующим этапом была основополагающая работа П.
Юри, Г. Бриккуэдда. Они испаряли большие количества жидкого водорода и собирали
газ из фракции последнего кубического сантиметра. Спектральным анализом в этом
газе были обнаружены линии спутники ряда характерных водородных линий (Нβ,
Нγ,
Нδ);
спутники
соответствовали теоретически вычисленным длинам волн для тяжелого изотопа с
точностью до 0,02 А. Отношение изотопов по расчету равно 1 : 4000. Позднее были
исследованы пробы водорода самого различного происхождения: из кратера Килауэа,
из обсидиана, из девонских отложений, из природного газа, содержащего гелий -
везде результат был один и тот же [23].
В 1933 г. Дж. Льюис сообщил, что после
разделения воды электролизом ему удалось получить воду с удельным весом 1,035,
т. е. воду, в которой содержание тяжелой фракции составляло одну треть. Получив
тем же способом 0,12 см3 99,99 % тяжелой воды, он тщательно исследовал и
определил некоторые ее физические свойства. В том же 1933 г. О. Уошберн первым
высказал мысль, что любые аспекты изучения тяжелого изотопа могут быть весьма
интересными. Можно было ожидать, что изотопы водорода обнаружат значительное
различие в химическом поведении и это откроет новый большой кругозор в химии и
биологии [23].
Со времени открытия дейтерия прошло 42 года.
Дейтерий и его соединения за это время изучены, пожалуй, лучше многих других
элементов таблицы Менделеева, так как на тяжелую воду возник промышленный
спрос. Изучено влияние дейтерия на жизнедеятельность организмов: выяснено, что
в больших концентрациях для высших растений и животных - это яд [24].
Содержание дейтерия в воде Мирового океана
принято за норму. В морской воде на каждый атом дейтерия приходится 6800 атомов
протия, что составляет 0,015 атом.%, или 0,017 вес.%. Материковые воды содержат
дейтерия меньше: 0,0135 атом.%, или 0,015 вес.%. Много это или мало? Совсем
немного, если сравнивать кларк дейтерия с кларками таких распространенных в
природе элементов, как кислород, кремний, железо. Но это совсем не мало, если
рассматривать дейтерий в воде и организмах в качестве микроэлемента. Тогда ему
следует отвести одно из первых мест среди других микроэлементов.
На ничтожные концентрации дейтерия как на
активный фактор жизни никто сначала не обращал внимания. Приоритет принадлежит
советскому ученому Б. Н. Родимову [25]. Позже этим вопросом стали заниматься
другие ученые в нашей стране и за рубежом - в США, Бразилии, Мексике и других
странах.
Что же обнаружено при этих исследованиях?
Оказывается, даже частичное удаление дейтерия из обычной воды превращает ее в
активный стимулятор жизни. Отсюда вытекает очень важное следствие: дейтерий
вреден организмам при любой его концентрации, даже при такой, в какой он
находится в обычной воде, а следовательно, и в любом живом организме.
Вода - самое распространенное соединение
водорода в природе, среда для многих организмов, их главная составная часть. И
она тоже на 2/3, как и организмы, состоит из атомов водорода и только на 1/3 из
атомов кислорода. Изменение изотопного состава воды, поглощаемой организмом,
влечет за собой изменение соотношения тяжелого и легкого водорода в живых
тканях. Так, при удалении из обычной воды только части от входящей в ее состав
небольшой примеси дейтерия содержание его в организме тоже снижается, что
служит стимулом, активизатором жизнедеятельности организма.
К сожалению, для выяснения механизма такого
стимулирования, а значит, роли и поведения дейтерия в биохимических процессах
сделано очень мало, хотя современное состояние биохимии дает возможность
исследовать эти процессы на молекулярном и даже субмолекулярном уровне.
Толчком к развитию биохимии дейтерия должно
послужить еще одно важное обстоятельство. Дело в том, что обменные процессы
нашей планеты с космосом ведут к систематическому накоплению дейтерия в Мировом
океане. В прошедшие эпохи его было меньше, в будущем станет больше. Опыты по
воздействию на организмы пониженного и повышенного содержания дейтерия в
поглощаемой воде свидетельствуют о беззащитности организмов по отношению к
дейтерию.
Не следует ли из всего сказанного, что вода при
условии сдвига ее изотопного состава в сторону уменьшения дейтерия может стать
одной из основ развития и процветания жизни? Такая вода на нашей планете есть.
Изучение процессов кругооборота воды в природе показывает, что заметное
расхождение в свойствах тяжелого и легкого изотопов обусловливает разницу в
поведении тяжелой и легкой воды. В результате в природе все время происходит
сегрегация изотопов водорода. В зависимости от атмосферных и географических
условий выпадающие осадки отличаются большим или меньшим содержанием дейтерия.
Для некоторых зон и регионов Земли характерны осадки, в значительной мере
освобожденные от дейтерия. Это природные источники стимулирующей жизнь воды. Их
надо суметь найти и сберечь. Разумное использование этих живительных источников
в сельском хозяйстве, по-видимому, поможет расширить кормовые и пищевые ресурсы
человечества, в медицине же они могут оказаться весьма эффективным лечебным
средством.
В наши дни возрождена старая, одно время
забытая, теория абсорбции газовых молекул на поверхности твердых тел. Молекулы
удерживаются на ионных (электрически заряженных) поверхностях благодаря
несбалансированности электрических полей этих поверхностей. Мощные электростатические
поля притягивают и удерживают одни молекулы прочнее, чем другие, в результате
чего и происходит разделение двух разновидностей протия, идентичных во всем,
кроме величины вращательной энергии молекул [25]. Некоторые органические
соединения устойчивы только тогда, когда они построены из какой-либо одной
разновидности атомов протия. Именно этим обстоятельством можно объяснить
получение Ларком энзима полимеразы ДНК с десятикратно увеличенной длиной цепи
синтетических полинуклеотидов [26].
Таким образом, даже тонкие различия в степени
возбуждения электрона протия изменяют его химические свойства. А ведь атомы
протия и дейтерия отличаются друг от друга гораздо сильнее, чем атомы протия
разной степени возбуждения.
В процессах водородного обмена дейтерий замещает
в молекулах соединений лишь определенные атомы водорода. Так, в уксусной
кислоте он занимает место активного водорода карбоксильной группы, но не входит
в метильную группу. При растворении сахара в тяжелой воде подвижный водород
сахара немедленно замещается дейтерием. При адсорбции молекул тяжелой воды
поверхностью микропористого стекла происходит дейтерирование с образованием
групп Si - OD; этот процесс вполне аналогичен гидрированию. Характерно, что при
обменных реакциях дейтрон присоединяется не только к электронной паре атома
кислорода или азота, что типично для водорода, но и к атому углерода, т. е.
замещает даже менее активные в этом отношении атомы водорода [22].
Фенол и его эфиры при растворении в жидком
бромистом дейтерии при комнатной температуре сразу же обменивают три атома
водорода в каждом из колец, но дальше обмен не идет. Особенно активно протекает
изотопный обмен между группами ОН, NH и водой. Быстро идет обмен
α-водородных
атомов кетонов в основаниях и обмен орто- и пара-водородных атомов
ароматических аминов в кислотах. В ароматических аминах водородный обмен
зависит от силы этих щелочных соединений.
В общем случае можно сказать, что в изотопном
обмене преимущественно участвуют те атомы протия, для которых характерно более
сильное сверхтонкое расщепление спектральных линий. Иными словами, тяжелый
изотоп замещает в химических соединениях преимущественно тот водород, который
связан наиболее прочно.
Что же получается в результате такого изотопного
обмена? Электронная поляризуемость молекул и показатель преломления при замене
протия на дейтерий снижаются. Поскольку частота электронного перехода у
дейтерия выше, чем у протия, то и энергия такого перехода в первом случае
больше, чем во втором. Впрочем, это относится лишь к низким температурам. При
средних температурах эта разность менее заметна, а при повышенных - энергия
электронного перехода у дейтерия становится меньше, чем у протия.
При обычной температуре энергия водородной связи
в тяжелой воде на 340кал/моль больше, чем в протиевой (разность энергии
ассоциации). Замещение легкого изотопа водорода тяжелым увеличивает на
несколько процентов осмотический коэффициент. Энтальпия смешения (-∆Hсмеш)
протиевых систем больше, чем дейтериевых, тогда как изобарный потенциал
смешения (∆Zсмеш), наоборот, выше для дейтериевых. Кривые взаимной
растворимости химических соединений показывают, что для достижения той же
растворимости в тяжелой воде требуется поддерживать более высокую температуру,
чем в воде обычной. Вязкость дейтериевых соединений, как правило, выше на 10-15
%. Лишь при замещении протия дейтерием в хлороформе и тетрабромэтане вязкость
уменьшается на 1-1,5 %. Это - первый случай, когда замена Н на D понижает
вязкость. Объясняется он наложением двух факторов, влияющих на вязкость в противоположных
направлениях повышением молекулярного веса и ослаблением вандерваальсова
взаимодействия. Критическая температура кипения указанных соединений после
дейтерообмена снижается.
Различие в скорости реакций неожиданно
оказывается значительно больше того, какое можно было бы ожидать, исходя из
разницы в скорости теплового движения молекул, содержащих дейтерий или протий.
Анализ механизма реакций показал наличие существенного эффекта. При замещении Н
на D при комнатной температуре наблюдается 6-8-кратное замедление реакций. При
более высоких температурах этот эффект сглаживается. Поланьи утверждает, что
дейтерий, как правило, реагирует медленнее протия. Так, при 0 °С протий
взаимодействует с хлором в 13,4 раза быстрее, чем дейтерий. По сравнению с протиевыми
соединениями химическая реакционная способность дейтериевых соединений тоже
обычно ниже. K. Поланьи считает,
что, хотя потенциальная яма у атома дейтерия глубже, чем у атома протия, и
энергия активации первого атома соответственно выше, бывают случаи, когда в
новом положении (в новой молекуле) дейтерий приобретает дополнительную энергию,
и тогда он реагирует быстрее протия [23].
Особенно заметная разница в скорости
взаимодействия наблюдается в случае химических реакций, идущих с участием
катализаторов. Известно, что скорость реакции синтеза аммиака в присутствии
электролитического водорода на 10 - 40 % выше скорости реакции с использованием
водорода, полученного железопаровым способом. Это объясняется не наличием тех
или иных примесей, так как в обоих случаях водород тщательно очищается, а в
том, что в железопаровом водороде по самому способу его получения содержится
весь дейтерий, внесенный с водяным паром, а в электролитическом, наоборот,
дейтерия совсем немного [24]. Последнее объясняется тем, что водородные ионы,
представленные дейтерием, движутся в электролитах гораздо медленнее, чем ионы
протия. Поэтому при получении электролитического водорода дейтерий
концентрируется в электролитических ваннах. На этом основан один из
промышленных способов получения тяжелой воды.
Таким образом, удаление ничтожных количеств
дейтерия из реакционной смеси значительно повышает скорость каталитической
реакции, так как дейтерий способен вытеснять протий из каких-то активных зон
катализатора. Это особенно важно для биохимических процессов, идущих, как
известно, почти всегда с участием катализаторов (ферментов). Взаимосвязь между
концентрацией дейтерия и скоростью биохимических реакций заслуживает самого
тщательного исследования, однако до сих пор, судя по литературе, эта взаимосвязь
никем не изучалась.
Наиболее важное соединение дейтерия - тяжелая
вода D2О, аналог обычной воды Н2О. Физические свойства той и другой воды весьма
различны. Плотность тяжелой воды на 10 % больше плотности легкой. Максимальную
плотность тяжелая вода имеет при 11,23 ± 0,02 °С. Ее удельный вес при 25 °С
равен 1,10775 ± 0,00016. Вязкость тяжелой воды на 20 % превышает вязкость
обычной воды. С повышением температуры это различие сглаживается: так,
отношение вязкости тяжелой воды к вязкости обычной при 15 °С равно 1,258, при
20 °С - 1,247, 30 °С - 1,228, 40 °С - 1,212 и 50 °С - 1,199. Поверхностное
натяжение тяжелой воды равно 71,93 дин·см и лишь немного меньше поверхностного
натяжения обычной воды, равного 71,97 дин·см.
В спектрах тяжелой воды имеется широкая полоса,
подобная полосе ОН, наблюдаемой в обычной воде. Однако в случае D2О полоса
смещена в область более низких частот из-за большей массы дейтерия. Для
максимума полосы OН, частота v=2535 см-1. Для 3%-ного раствора D2O в воде
характерна более узкая полоса с максимумом при v= 2560 см-1; 3 %-ный раствор
D2О в ацетоне имеет максимум при v=2600 см-1. По-видимому, важную роль в
явлении возмущения группы OD (или ОН) играет резонансный эффект. Таким образом,
с точки зрения резонансного взаимодействия очень важно, чем окружены молекулы
D2О - молекулами легкой или тяжелой воды.
Тяжелая вода в сравнении с обычной растворяется
в органических жидкостях хуже [26]. Если ее растворимость принять за единицу,
то растворимость обычной воды составляет 1,03 - 1,43. Кроме того, тяжелая вода
и худший растворитель. Так, если в 1 л обычной воды при 25 °С растворяется 4,34
моля NaBr, то в тяжелой всего 3,21 моля.
Температура кипения тяжелой воды при нормальном
давлении равна 101,41 °С, т. е. на 1,41 °С выше, чем у обычной воды. И теплота
испарения тяжелой воды выше: при 3,82 °С она равна 11 109 кал/моль (10 702
кал/моль для обычной воды); при 100 °С - 9927 (D2О) и 9719 (Н2О) кал/моль.
Таким образом, с повышением температуры разница сглаживается. Отношение теплоты
испарения тяжелой и легкой воды: 3,8 °С - 1,038; 10 °С - 1,034; 25 °С - 1,031;
40 °С - 1,028; 100 °С - 1,021.
Структура кристаллов тяжелой воды не отличается
от структуры кристаллов обычного льда. Основной параметр a - ячейки кристалла
тяжелой воды примерно лишь на 0,1% меньше параметра кристалла обычного льда.
Температура плавления тяжелой воды равна 3,79 °С, а теплота плавления - 1515 ±
10 кал/моль, т. е. на 5,5 % больше, чем для обычной воды (1436 кал/моль).
Теплота сублимации в тройной точке для тяжелой воды составляет 12 631 ± 20, а
для обычной воды - 12 170 кал/моль, отношение теплоты сублимации равно 1,04.
Теплоемкость тяжелой воды при 0 °С равна 20,13 по сравнению с 18,00 кал/моль
для обычной воды (отношение теплоемкости 1,12). Разница значений теплоемкости с
повышением температуры становится не столь существенной: при 20 °С отношение
равно 1,006, при 40 °С - 1,004 и при 60 °С -1,002.
Сведения о дипольном моменте воды разноречивы,
так как этот показатель трудно замерить и, кроме того, обычно его определяют
разными методами. Так, для Н2О значение дипольного момента колеблется в
пределах 1,76 - 1,86, а для тяжелой - 1,78 - 1,87. Однако во всех случаях
дипольный момент для D2О, выше, чем для Н2О приблизительно на 0,5 - 1,1 %.
В сравнении с обычной водой диэлектрическая
постоянная тяжелой во-ды немного меньше. Абсолютное значение при 25° С для D2О
равно 78,26, для Н2О - 78,54; отношение этих величин равно 0,9963. Тяжелая вода
ионизирована слабее; константа диссоциации для Н2О равна 10-14 , для D2О -
1,95·10-15. Обычные водородные ионы гораздо подвижнее ионов дейтерия. Так, если
для Н+ и ОН- подвижность составляет 349,8 и 197,6, то для иона D+ - 250,1 и для
OD- - 119,0. Подвижность ионов К+ и Na+ в обычной воде в 1,22 - 1,26 раза
больше, чем в D2О.
Из краткого сравнительного обзора
физико-химических свойств дейтерия и протия отчетливо видно, что эти «близнецы»
всегда в той или иной мере отличны друг от друга. И это определяет различное
поведение их соединений. Изотопный эффект особенно ярко проявляется в живых
структурах, так как резко отличаются именно те свойства изотопов, которые
наиболее важны для живых структур [27]. Как мы говорили, водородные «близнецы»
не похожи друг на друга в гораздо большей степени, чем «близнецы» всех
остальных элементов. Среди изотопов такое различие в поведении «близнецов»
беспрецедентно.
Это своеобразие того и другого водорода
используется в науке и технике. Атомы дейтерия, например, исключительно удобны
в качестве меченых. С их помощью с большим успехом исследовались сложные
химические реакции, в частности процессы фотосинтеза. В растение (или его
препарат) вводят какое-либо из соединений, входящих в состав растения.
Предварительно в соединении протий замещают дейтерием. Растение подвергают
действию света, а затем составляют баланс по дейтерию, т. е. наблюдают его
перемещение. Дейтерий в качестве метки удобен тем, что он не радиоактивен.
Однако, поскольку поведение его не вполне аналогично поведению протия,
необходима поправка на индивидуальность дейтерия. Эти коррективы вносят
исследования с применением других меченых атомов, например радиоактивного
углерода 14С или радиоактивного азота 16N.
Дейтерий наряду с тритием (еще более тяжелым
изотопом водорода) служит исходным сырьем для реакции термоядерного синтеза.
После разработки технологического оформления этой ядерной реакции
электростанции, работающие на дейтерии, станут основным источником энергии для
человечества. Когда запасы нефти, газа, урана будут уже на грани полного
исчерпания, все надежды поневоле станут возлагаться на дейтерий.
В виде тяжелой воды дейтерий применяется теперь
как замедлитель нейтронов в атомных реакторах, работающих на тепловых нейтронах
[22]. Некоторая инертность его химических соединений по сравнению с таковыми же
соединениями протия тоже нашла применение в технике. Обычная перекись водорода,
как известно, используется в качестве окислителя, но представляет неудобства
из-за своей взрывоопасности. Замена ее на перекись дейтерия делает такой
окислитель безопасным.
Протий в настоящее время применяется в гораздо
более скромных масштабах - главным образом для приготовления протиевой воды.
Последняя производится в небольших количествах как стандартный образец для
хи-мических лабораторий, а также для экспериментов в биологических лабораториях
при изучении влияния дейтерия на жизнедеятельность организмов. Не так давно
протиевая вода нашла применение в биохимических реакторах где она оказывает
стимулирующее влияние на выход биомассы.
Что же касается живой воды, то пока что она
используется только в экспериментах, проводимых в клиниках нашей страны и за
рубежом, а также в сельском хозяйстве, где ее опробывают в качестве стимулятора
развития растений и животных.
1.5 Влияние воды с
измененным изотопным составом на биологические объекты
.5.1 Влияние тяжелой
воды на биологические объекты
Одним из первых этим вопросом занялся
американский ученый Дж. Льюис. Он нашел, что в тяжелой воде высокой
концентрации размножение микробов сильно задерживается: помутнение питательного
бульона наблюдается лишь через две недели (контрольная пробирка мутнела за
несколько часов) [28].
Расщепление сахара дрожжами идет в тяжелой воде
в 9 раз медленнее. Некоторые простейшие и коловратки погибают в тяжелой воде.
Действие энзимов заметно задерживается. М.
Ричардс обнаружил, что дрожжи в тяжелой воде растут гораздо медленнее. Х. Паксу
установил, что скорость выделения углекислого газа при брожении альфа-глюкозы
под влиянием дрожжей в чистой D2О в 9 раз меньше, чем в чистой Н2О, а в 60 %
D2О в 1,6 раза меньше. Зимазный комплекс необратимо дезактивируется [29].
Семена табака не прорастают в тяжелой воде. В
50%-ной D2О они прорастают вдвое медленнее по сравнению с обычной водой. Если
семена из тяжелой воды перенести в обычную, то часть их через неделю начинает
прорастать, хотя и не вполне нормально.
Плоские черви вида планария макулета за 1-2 часа
пребывания в D2О теряли всякие признаки жизни. После того как их переносили в
обычную воду, только часть из них через несколько часов начинали приходить в
норму, остальные погибали. Для головастиков и мальков 40-часовое пребывание в
92 и даже 30 % D2О оказывалось смертельным. Интересно отметить то
обстоятельство, что в то время как в большой концентрации тяжелая вода
смертельна для рыб, головастиков и червей, инфузория парамеция жила в этих
условиях 24 часа. Во время этих исследований было также замечено, что белые
мыши, которых поили тяжелой водой, обнаруживали крайнее беспокойство,
выражающее острую жажду.
Когда развивается какое-нибудь новое научное
направление, то обычно в первую очередь замечаются и исследуются прямолинейные
зависимости, как, например, в данном случае: тяжелая вода - яд. Но со временем
накапливаются факты, не укладывающиеся в первоначальные примитивные схемы,
выясняется, что есть какие-то противоречия. На них - противоречиях - должно
быть сосредоточено главное внимание. Они либо открывают глаза на допущенные
ранее ошибки, на невольное преувеличение значения отдельных факторов, либо
проясняют более глубокую и тонкую структуру явлений и переводят этим самым
исследование на более высокую ступень достоверности и убедительности. Так было
и при изучении влияния дейтерия на жизнедеятельность организмов,
сопровождавшемся борьбой противоположных мнений.
Так, например, с утверждением, что дейтерий -
яд, был не согласен крупный биохимик Р. Бэрнс. Поместив спирогиру в воду с
повышенным содержанием дейтерия, он наблюдал то же замедленное движение клеток
и прекращение их деления, но сделал из этого совершенно противоположный вывод.
По его мнению, такое поведение клеток говорит не о старении организмов, а об
увеличении продолжительности жизни [30].
Некоторые авторы утверждают, что тяжелая вода не
ядовита. Для доказательства такой точки зрения был проведен, в общем-то, очень
интересный опыт. Жир, в котором часть протия была замещена дейтерием,
скармливался мышам. Оказалось, что дейтерированный жир быстро попадает в запас,
в жировое депо. Одновременно из депо уходит обычный, протиевый жир. За три дня,
таким образом, обновляется 2/3 жирового запаса депо. Такой процесс вполне
соответствует пониженной химической активности дейтериевых соединений. Обратный
обмен меченного дейтерием жира из запаса на обычный жир, поступающий с пищей,
проходил с такой же скоростью. Но подопытные мыши остались живы, здоровы и
активны. Жаль, что эти опыты не были продолжены на срок более трех суток.
Длительные опыты, наверное, рассеяли бы заблуждение о безвредности дейтерия. Да
что говорить о безвредности, если К. Уэпер в своих экспериментах нашел, что
тяжелая вода в небольших количествах определенно стимулирует рост и развитие
плесневого грибка аспергиллус. Н. А. Шишаков добавляет, что так же действует
тяжелая вода и на спирогиру. Г. Махт и Р. Дэвис считают, что вода содержащая
0,2 % D2O, не отличается по физиологическому действию от обыкновенной воды.
Хотя некоторые простейшие и коловратки погибают в D2O, но евглена и целый ряд
бактерий при возвращении в обычную воду оживают вновь [31]. На клетки D2O
оказывает очень медленное действие.
Из последних работ, «защищающих» дейтерий,
относится еще исследование Стрелера. Он поил плодовых мушек дрозофил 20 %-ной
D2O. Срок жизни мушек опытной партии сократился вдвое по сравнению со сроком
жизни контрольной партии, которую поили обычной водой. Стрелер счел
преждевременное старение мушек за активизацию частоты смены поколений, т. е. за
своего рода омоложение.
Итак, эксперименты показывают, что организмы
относятся к тяжелой воде по-разному: одни (большинство) в ней погибают,
жизненные процессы других (меньшинства) тормозятся, третьи, наоборот, в тяжелой
воде процветают.
1.5.2 Влияние лёгкой
воды на биологические объекты
Легкая вода - продукт современных технологий.
Воду, в которой содержание тяжелых изотопов водорода снижено по отношению к
природному уровню, называют легкой водой. Как показали многочисленные опыты и
экспертизы, такая вода оказывает удивительно благотворное влияние на организм
человека. А в США легкая вода официально рекомендована как профилактическое
противораковое средство.
Вода является наиболее важной составляющей
жизнедеятельности человека, организм которого на 65% состоит из воды. В одном
литре природной воды, которую мы ежедневно употребляем, помимо химических
примесей содержится около 2,33 г «тяжелой» воды, образованной за счет
соединения тяжелых изотопов водорода (дейтерия, трития) и кислорода. Попадая в
организм, тяжелые изотопы загрязняют клеточные мембраны, ухудшая водообмен, что
является, по мнению ученых, причиной сбоев различных систем организма, вплоть
до возникновения онкологических заболеваний.
Чем ниже природный уровень тяжелых изотопов в
воде, тем больше на этой территории долгожителей и меньше заболеваний раком. В
отличие от тяжелой воды, которая в концентрированном виде является ядом для
всего живого, легкая вода (со сниженным содержанием тяжелых изотопов) обладает
ярко выраженными лечебными качествами. Основное действие, оказываемое легкой
питьевой водой на человеческий организм, - постепенное снижение содержания
дейтерия в жидкостях тела, общее повышение иммунитета и улучшение работы
важнейших систем организма. С помощью легкой воды можно предотвратить многие
болезни, даже те, которые не поддаются лечению. И это подтверждают множество
примеров из жизни.
Очистка природной воды от тяжелых вод
осуществляется по весьма сложным, энергоемким и дорогостоящим технологиям,
объем производства ограничен, а потому такой продукт не так доступен. По этой
причине до сих пор легкая вода не получила широкого распространения. В
настоящее время легкая вода в небольших объемах производится за рубежом и
известна как DDW (deuterium depleted water) - частично бездейтеривая вода - и
успешно используется в комплексном лечении опухолевых заболеваний в течение 10
лет.
В России легкая вода производится под торговой
маркой «Лангвей». В ней по отношению к природной содержание тяжеловодородной
воды снижено в 1,5-2,5 раза, а тяжелокислородной - на 15%. Легкая вода
«Лангвей» проходила множество лабораторных и клинических испытаний,
использовалась в лечении больных раком в ведущих медицинских и научных
организациях России.
Сегодня доказано, что лёгкая вода способствует:
нормализации обмена веществ, выведению шлаков, токсинов
и радионуклидов из организма;
лечению и профилактике онкологических
заболеваний, сахарного диабета, болезней почек и печени;
восстановлению организма при стрессах и
переутомлении;
нормализует артериальное давление, липидный и
углеводный обмен;
обладает мощным косметическим эффектом;
замедляет процессы старения и увеличивает
продолжительность жизни.
Результаты клинических испытаний и исследования
биологической активности воды с пониженным содержанием тяжёлого изотопа
водорода, полученные российскими и зарубежными учёными [31], показывают, что
такая вода обладает ярко выраженным противораковым и антиметастазным действием
и может с успехом использоваться для профилактики и лечения онкологических и
других заболеваний. Кроме того, длительное потребление лёгкой воды благотворно
влияет на жизнедеятельность организма в целом, вызывает эффект омоложения
организма.
В 60-х годах XX века томские ученые Б. Н.
Родимов и И. Н. Торопцев опубликовали первые работы об удивительных свойствах
воды с пониженным, по отношению к природному, содержанием дейтерия - тяжелого
изотопа водорода. Было показано, что такая вода, полученная из снега и
реликтового льда, оказывает благоприятное воздействие на растения, животных и
человека [31].
В семидесятые годы советским ученым В. М.
Мухачевым [32] было впервые высказано предположение о том, что лёгкая вода
может помочь в борьбе с одной из смертельных опасностей нашего времени -
онкологическими заболеваниями. Но в тот период эта смелая гипотеза не вызвала
особого интереса в научном мире.
Интерес к лёгкой воде вновь возник лишь в 90-х
годах - в связи с широкомасштабными исследованиями, связанными с созданием
наиболее благоприятной среды обитания для космонавтов при длительных
космических полетах. Было доказано, что лёгкая вода не только улучшает обменные
процессы, но и способствует увеличению защитных сил организма.
На Западе интерес к лёгкой воде проявился лишь в
1993 году, когда в экспериментах на опухолевых клетках были обнаружены ее
антираковые свойства. Очень много сделал для изучения антираковых свойств
лёгкой воды венгерский ученый Г. Шомлаи, который считает ее совершенно новым
инструментом субмолекулярной медицины для лечения и предупреждения рака.
Следует отметить, что одновременно с зарубежными учеными противоопухолевые
свойства лёгкой воды в экспериментах на животных были обнаружены группой ученых
под руководством И. Н. Варнавского, работавшего в тесном контакте с учеными
Института медико-биологических проблем, руководимых профессором Ю. Н. Синяком.
Позднее в НИИ Канцерогенеза Российского онкологического научного центра им. Н.
Н. Блохина в экспериментах на мышах, проведенных совместно с Государственным
научным центром РФ «Институт медико-биологических проблем, были подтверждены
тормозящие эффекты лёгкой воды на рост перевиваемых опухолей и начало
опухолевого процесса» [32].
Поразительные результаты были получены и при
изучении влияния очищенной, легкой воды на организм человека в Российском
научном центре восстановительной медицины. Полученную промышленным путем легкую
воду, использовали в лечении больных сахарным диабетом и другими нарушениями
обмена веществ. Для достоверности исследования часть пациентов пила обычную
питьевую, хотя и хорошего качества. По окончании курса истории болезни этой
группы сравнили с другой, получавшей легкую воду. Действие очищенной воды на
обмен веществ оказалось комплексным, словно в организме пациента высвобождался
скрытый резерв сил, помогающий бороться с возникшими сбоями.
Больным с диагнозом аденокарцинома легкого
давали принимать легкую воду непрерывно в течение двух месяцев. За это время
прогрессирование болезни не наблюдалось, а опухоль стала меньше [32]. Так же у
больных с неоперабельной раковой опухолью простаты после месяца употребления
легкой воды опухоль становилась практически незаметной. Действительно, сегодня
имеются убедительные доказательства того, что легкая вода может противостоять
раку.
Питьевая вода - это сложный по своей структуре и
составу продукт, оказывающий полифизиологическое действие на организм человека.
Очистка питьевой воды от тяжелых молекул оказывает на организм человека
оздоравливающее действие.
В исследовании, проведенном в отделе
эндокринологии РНЦ восстановительной медицины и курортологии МЗ РФ, участвовало
50 больных сахарным диабетом 1 и 2 типа. Больные имели сопутствующие
заболевания: артериальная гипертония, ишемическая болезнь сердца, ожирение 1-2
степени. Больные принимали легкую воду в течение 28 дней в суточной дозе 1
литр. После курса приема легкой воды у больных сахарным диабетом 1 типа было
отмечено статистически достоверное снижение веса больных, гликемии через 1 час
после завтрака, суточной гликозурии (в 1,5 раза). Нормализовалось содержание
сахара в крови.
У больных сахарным диабетом 2-го типа было
отмечено статистически достоверное снижение веса, индекса массы тела,
количества жировой ткани. Наметилась тенденция к снижению артериального
давления. Из заключения: «Результаты проведенных клинических испытаний
свидетельствуют о хорошей переносимости, гипотензивном, гипогликемическом и
гиполипидемическом действии легкой воды «Лангвей» при лечении больных сахарным
диабетом, особенно типа 2».
Вода - фактор очень важный. Водород входит в
молекулы ДНК, так что эффект наследуется.
Самой высокой продолжительностью жизни на территории
бывшего СССР отличались жители Кавказа. Это и понятно: целебный воздух гор,
здоровое питание, включающее свежие молочные продукты и зелень. Однако самыми
большими долгожителями после кавказцев почему-то оказались жители крайнего
севера, и с точки зрения прежних представлений о здоровом питании это было
совершенно необъяснимо. Исследования природной воды различного происхождения
показали, что если содержание тяжелых молекул в обычной воде (как
водопроводной, так и бутилированной) соответствует уровню почти 150 ppm, то
именно в регионах Севера и Кавказа она отличается более легким составом, а
самая легкая вода на планете в природе встречается во льдах Гренландии (около
120 ppm), и в Антарктике (89 ppm). Именно это и является объяснением
загадочного факта [33].
На один миллион жителей в среднем в Росии - 8
долгожителей, Чечено-Ингушетии - 353 (Кавказ), в Якутии - 324. Цифры эти
объясняются употреблением талых вод. Например, в талой воде высокогорных
ледников содержание дейтерия в среднем на 10-12% ниже, чем в обычной, поэтому
среди горцев, ее пьющих, так много долгожителей.
В Институте красоты курс лечения с применением
легкой воды прошли пациентки экспериментальной группы. У них быстрее, чем у
остальных, нормализовался обмен веществ, они в более короткие сроки теряли
лишний вес. Кроме того, на проблемные участки кожи пациентам наносили
специальные маски на основе легкой воды - и гнойнички, угри, экзема проходили
быстрее, чем у тех, кто применял классические косметические средства. Более
ярко были выражены регенерация тканей, омолаживающий и увлажняющий эффект.
Хорошо известно, что необходимая человека энергия накапливается в клетках в
виде особых молекул (АТФ). Исследования показали: применение легкой воды
увеличивает уровень АТФ на 30%. Все клетки организма чувствуют прилив энергии -
это отражается на цвете лица, блеске волос и тонусе кожи. Повышается иммунитет,
препятствуя развитию воспалительных реакций, которые, как известно, являются
одной из главных причин преждевременного старения.
2. Экспериментальная
часть
В данной работе исследовалось влияние воды с
пониженным содержанием дейтерия (40±2ppm)
на функциональные свойства иммунокомпетентных клеток крови человека
(лимфоцитов). Для этого определялось количество однонитевых разрывов ДНК в
лизатах лимфоцитов, выделенных из цельной крови здоровых доноров и больных с
врожденными пороками развития челюстно-лицевой области (ВПР ЧЛО).
Предварительно клетки инкубировали в физиологическом растворе на легкой
(экспериментальные образцы) и обычной воде (контрольные образцы). Однонитевые
разрывы ДНК являются начальным этапом фрагментации молекулы ДНК и предшествуют
переходу клетки в состояние апоптоза (гибели).
Так же было определено содержание дейтерия в
питьевой воде различных районов города Краснодара.
Воду с пониженным содержанием дейтерия
производили на установке ЛВ-1 [34] в Бизнес-инкубаторе Кубанского
государственного университета.
Определение концентрации дейтерия в полученной
воде были проведены на импульсном ЯМР спектрометре JEOL
JNM-ECA
400MHz в центре коллективного
пользования "Диагностика структуры и свойств наноматериалов" КубГУ по
методике, изложенной в работе [35].
2.1 Определение
содержания дейтерия в питьевой воде
Для определения изотопного состава использовался
ЯМР спектрометр. Физические основы спектроскопии ядерного магнитного резонанса
определяются магнитными свойствами атомных ядер. Взаимодействие магнитного
момента ядра с внешним магнитным полем В0 приводит в соответствии с правилами
квантовой механики к диаграмме ядерных энергетических уровней, так как
магнитная энергия ядра может принимать лишь некоторые дискретные значения Ei, -
так называемые собственные значения. Этим собственным значениям энергии
соответствуют собственные состояния - те состояния, в которых только и может
находиться элементарная частица. Они также называются стационарными
состояниями. С помощью высокочастотного генератора можно вызвать переходы между
собственными состояниями на диаграмме энергетических уровней. Поглощение
энергии можно обнаружить, усилить и записать как спектральную линию, или так
называемый резонансный сигнал (рисунок 1).
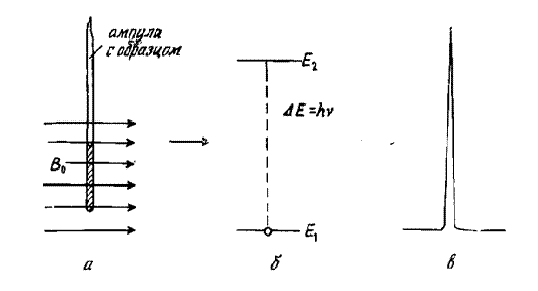
а - образец в магнитном поле В0; б - диаграмма
энергетических уровней; в - резонансный сигнал
Рисунок 1 - Получение спектральной линии методом
ЯМР
Определение концентрации дейтерия пробах
питьевой воды были проведены на импульсном ЯМР спектрометре JEOL JNM-ECA
400MHz. Съёмка спектров проводилась на соответствующей резонансной частоте ядер
дейтерия - 61,4 MГц. Параметры съёмки:
6,7 с
(acquisition time), 20 с
(relaxation delay), 5,6 мкс
(x-pulse), 0,15 Гц
(resolution). Температура съёмки - 25 ◦C, при этом
точность стабилизации 0,2 ◦C. Измерения проводились с использованием 5 мм
ампулы, внутри которой был строго зафиксирован запаенный капилляр, содержащий
откалиброванную в определяемой концентрационной шкале смесь дейтерированного и
недейтерированного диметилсульфоксида (DMSO), дающего 2D ЯМР сигнал в области
3,4 м.д. (относительно Si(СD3)4), в то время как 2D ЯМР сигнал HDO находится в
области 4,7 м.д. (относительно Si(СD3)4).
Обработка полученных спектров заключалась в
определении соотношения интегральных интенсивностей 2D ЯМР сигнала HDO,
содержащейся в исследуемом образце относительно 2D ЯМР сигнала DMSO-D1,
интенсивность которого, в свою очередь, была определена при таких же условиях
относительно стандартов - образцов воды с точно определённым содержанием
дейтерия (8,2 мг/л, 110,5 мг/л, 332 мг/л). Измерения каждого образца
проводились неоднократно для уменьшения погрешностей эксперимента.
В таблице 1 приведены результаты определения
содержания дейтерия в пробах воды питьевой, взятой из разных районов г.
Краснодара.
Таблица 1 - Результаты определения содержания
дейтерия в пробах питьевой воды г. Краснодара
|
№
пробы
|
Содержание
дейтерия D/H, ppm, (± 3 ppm)
|
|
1
|
152
|
|
2
|
151
|
|
3
|
152
|
|
4
|
154
|
|
5
|
152
|
|
6
|
152
|
Из таблицы 1 видно, что во всех пробах питьевой
воды содержание дейтерия находится на одном уровне 152 ± 3 ppm, что
соответствует его содержанию в природной воде.
.2 Выявление и
выделение лимфоцитов из цельной крови человека
Для определения наличия и концентрации
иммунокомпетентных клеток в донорской крови, использовался счетчик форменных
элементов крови «Пикоскель ПС-4М». Данный счетчик используется в медицинской
практике для счета форменных элементов крови: числа эритроцитов, лейкоцитов, и
тромбоцитов.
Для «Пикоскеля ПС-4М» наиболее важными
техническими характеристиками являются:
определяемая концентрация форменных элементов
крови от 2·103 до 105 см-3;
определяемые размеры форменных элементов от 2 до
12 мкм;
систематическая погрешность не более 15 %;
случайная погрешность не более 4%;
время измерения одной пробы не более 40 с.
Работа счётчика форменных элементов крови
«Пикоскель ПС-4М» построена на принципе измерения импеданса и реализована на
счёте электрических импульсов, вызванных исследуемыми частицами, проходящими
через отверстие измерительной трубки. Исследуемые частицы помещаются с помощью
дозирующих устройств в электропроводящую жидкость (электролит), который
совместно с ними представляет собой вид суспензии.
При запуске цикла измерения в измерительной
трубке возникает вакуум, под действием которого находящиеся в электролите
частицы засасываются в измерительную трубку через отверстие. Когда уровень
суспензии внутри измерительной трубки достигает первого внутреннего электрода,
между ним и внешним электродом протекает постоянный по величине измерительный
ток. Электрическое сопротивление между электродами значительно изменяется
каждый раз, когда через отверстие измерительной трубки проходят частицы с
электропроводимостью, отличающейся от электропроводимости электролита.
Изменение сопротивления создает импульсы напряжения. Подключенный к электродам
регистрирующий узел может определить концентрацию частиц. Когда внутри
измерительной трубки уровень суспензии достигает второго внутреннего электрода,
в измерительной трубке создаётся давление, под действием которого тот же самый
объём суспензии из неё выталкивается и, находящиеся в нём частицы, снова
проходят через измерительную трубку.
Подсчёт частиц всегда происходит в постоянном
объёме измерительной трубки, ограниченном первым и вторым внутренними
электродами. По окончании цикла измерения результаты счёта можно снять с
дисплея счётчика или распечатать.
Для определения значения фона. Была установлена
измерительная трубка, затем в измерительный стакан налили 10 мл чистого
физиологического раствора с последующим добавлением трех капель гемолитика.
Далее стакан с физиологическим раствором был установлен на столик. После был
выбран режим для измерения лейкоцитов при измерительном токе 200 мкА. Значение
фона составило 0,7·109 шт/л.
Для подсчета частиц крови одинаково пригодна
кровь, взятая из вены в пробирку (цельная), а так же проба крови, взятая из
кончика пальца (периферическая).
Для проведения данного опыта была использована
цельная кровь, отобранная у здоровых и больных (ВПР ЧЛО) доноров.
Проведение измерения числа лейкоцитов
производилось следующим образом. Измерительная трубка была установлена на 100
мкм, затем был выбран режим счета лейкоцитов WBC,
с последующим выбором тока 200 мкА. Далее разбавляем кровь физиологическим
раствором в пропорции 1:630 (16 мкл крови на 10 мл физиологического раствора) и
добавляем три капли гемолизируюющего раствора (гемолитика). Спустя три минуты
полученный раствор был установлен на измерительный столик и производим счет
лейкоцитов.
Были определено, что в одном литре крови доноров
содержится 4,6·109 штук лейкоцитов. Лимфоциты составляют 28% от общего числа
лейкоцитов, следовательно, их концентрация 1,288·109шт/л.
Для выделения лимфоцитарной массы из цельной
крови была использована методика [36]. Метод основан на разделении клеток крови
при центрифугировании в градиенте плотности фиколла-урагрофина.
За сутки до выделения лимфоцитов из цельной
крови, необходимо приготовить раствор фиколла-урографина с плотностью 1,093
г/мл. Раствор фиколла-урографина готовился следующим образом: в небольшом
количестве дистиллированной теплой воды растворили 4,1 г фиколла 400, добавили
10 мл 76 % урографина и добавили дистиллят. Приготовленный раствор оставили на
сутки. На следующий день довели водой до нужной плотности. Плотность раствора
измеряли с помощью ареометра.
Для каждого исследуемого образца промаркировали
по два эппендорфа вместимостью 1,5 мл - A
и B. В пробирки,
маркированные A, внесли с помощью
дозатора по 500 мкл 0,9 % раствора NaCl
стерильного, а затем таким же образом, поместили 500 мкл цельной крови и
аккуратно смешали кровь с физраствором, тем самым стабилизировав кровь.
В эппендорфы, маркированные В, стерильных,
внесли по 500 мкл фиколл-урографина. На фиколл-урографин аккуратно, избегая
смешивания, наслаивали стабилизированную кровь, а затем, закрыв эппендорфы,
поместили их в центрифугу Sigma
1-14 на 20 мин при скорости вращения равной 400 об/мин. По истечению 20 мин,
содержимое эппендорфа представляло собой следующий гетерофазный раствор. На дно
выпадал осадок красного цвета из эритроцитов и тромбоцитов, т. к. их плотность
выше плотности фиколла-урографина. Надосадочная жидкость разделилась на две
фазы: прозрачная - фиколл-урографин и красная жидкость, представляющая собой
плазму крови. На границе раздела этих двух фаз образовалось кольцо из
бело-желтых сгустков, содержащее лимфоциты. С помощью микродозатора
производился сбор межфазного кольца, содержимое которого было помещено в
отдельный стерильный эппендорф для дальнейшей отмывки клеток от примесей. Для
отмывки клеток был добавлен физраствор в количестве 500 мкл, а затем эппендорфы
снова были помещены в центрифугу на 10 мин со скоростью вращения 400 об/мин.
После этого отбирали надосадочную жидкость. Выделенные лимфоциты цельной крови
можно хранить при температуре минус 20 0С. На рисунке 2 представлена фотография
выделенных лимфоцитов.
Рисунок 2 - Фотография выделенных лимфоцитов,
сделанная на оптическом микроскопе БИОМЕД-6 Вар 3 при увеличении 1 : 1000
2.3 Инкубирование
лимфоцитов в воде с измененным изотопным составом и определение однонитевых
разрывов ДНК
Лимфоциты, изолированные из крови,
инкубировались в течение 16 часов при комнатной температуре в физиологическом
растворе, приготовленном на воде с пониженным содержанием дейтерия (40 ± 2 ppm)
и обычной воде (150 ± 2ppm).
Это необходимо для того, что бы выяснить, как влияет легкая вода на
жизнеспособность клеток in
vitro. Для выяснения
влияния времени инкубирования на жизнеспособность лифоцитов, последние
вымачивались в физрастворе, приготовленном на легкой воде в течение 3, 8, 16,
24 часов. Проведенные эксперименты показали, что при времени инкубирования 16
часов наблюдалась самая высокая эффективность репарации ДНК.
Для инкубирования две пробы лимфоцитов,
выделенных из крови здоровых и больных ВПР ЧЛО доноров, замачивали в 1 мл
физиологического раствора на легкой воде, а две другие аналогичные пробы
замачивали в физиологическом растворе на обычной воде.
Для лизирования клеток был приготовлен 4,5М
раствор мочевины. Мочевина является детергентом, используется в биологических и
биохимических лабораториях, представляет собой мягкий реагент, который
используются для разрушения мембраны клеток (лизиса клеток) и трансформации
внутриклеточного материала в растворимую форму. Детергенты используются в
основном для разрушения межбелковых, белково-липидных и межлипидных связей,
денатурации белковых структур, предотвращения неспецифического связывания в
иммунохимических анализах и кристаллизации белков. После инкубирования во все
пробы было добавлено по 0,2 мл 4,5М раствора мочевины. Клетки лизировали в
течение 10 мин при комнатной температуре. В этом случае происходит разрушение
оболочки лимфоцитов, тем самом высвобождение молекулы ДНК.
Лизаты клеток в экспериментальных образцах
подвергались щелочной обработке в течение 30 мин при 0 0С, а затем 60 минут при
15 0С. Для этого во все пробы добавлялось по 0,2 мл 0,1 % HCl.
Далее образцы подвергались интенсивному встряхиванию на Вортексе. Этим
достигалось расплетание молекул ДНК.
После щелочной обработки лизатов в образцы
добавлялся раствор бромистого этидия. Это химическое вещество из группы
фенантридинов (3,8-диамино-6-этил-5-фенилфенантридиумбромид), широко
применяемое для флуорисцентной маркировки ДНК. При облучении бромистый этидий
флюоресцирует оранжевым цветом. Является интеркалирующим агентом, т. е.
веществом, способным встраиваться между основаниями ДНК, его интеркаляция
сопровождается раскручиванием суперспирализованных участков ДНК. Используется в
качестве красителя для детектирования двухцепочечных молекул ДНК и РНК.
Интенсивность флюоресценции полученных образцов
определялась на спектрофлуориметре Флюорат-02-Панорама в диапазоне длин волн
540-740нм.
Количество однонитевых разрывов ДНК оценивалось
по отношению величин флюоресценции контрольных и экспериментальных образцов.
Для снятия фоновой флуорисценции подготовили образец, содержащий все
компоненты, как в экспериментальных образцах и в той же концентрации, но без молекул
ДНК. Помещаем образец в кюветное отделение. На компьютере открываем программу
«Панорама», в ней выбираем режим флуориметрии. Затем задаем длину волны
возбуждения - 540 нм, спектральный диапазон регистрации 540-740 нм. Далее
нажимаем кнопку старт. Измерение флуоресценции в данном диапазоне идет около 2
минут для каждого образца. Полученные графики экспортируем непосредственно в
электронную таблицу Excel для дальнейшего анализа результатов.
В ряде экспериментов использовался
рекомбинантный человеческий фактор некроза опухоли hTNFα.
При
замачивании лимфоцитов здоровых доноров в физиологическом растворе на обычной
воде и воде с пониженным содержанием дейтерия в среде создавалась концентрация
hTNFα
равная
10 нг/мл.
2.4 Изучение влияния
воды с измененным изотопным составом на состояние ДНК лимфоцитов
Для изучения влияния воды с пониженным
содержанием дейтерия на жизнеспособность иммунокомпетентных клеток in
vitro, лимфоциты,
изолированные из крови здоровых доноров и больных с ВПР ЧЛО, инкубировались в
физрастворах, приготовленных на воде с природным содержанием дейтерия
(содержание D 150 ± 2 ppm)
и на воде с измененным изотопным составом (содержание D
40 ± 2 ppm). После
лизирования клеток и соответствующей обработки растворов получены спектры
флюоресценции.
Рисунок 4 - Интенсивность
флюоресценции раствора бромистого этидия с лизатами лимфоцитов крови здоровых
доноров. (Инкубирование в физрастворах, приготовленных на обычной
дистиллированной воде (содержание D 150 ppm) и воде с измененным изотопным
составом (содержание D 40 ppm). Время инкубирования 16 час, t = 24 0С.)
На рисунке 4 представлены снятые
спектры флюоресценции для здоровых доноров. При замачивании в физрастворе на
обычной и легкой воде величина флюоресценции от фона не отличается, что говорит
об отсутствии однонитевых разрывов ДНК лимфоцитов.
На рисунке 5 представлены снятые
спектры флюоресценции для больных с ВПР ЧЛО доноров, ДНК которых имеет
множество разрывов. Из рисунка видно, что при инкубировании лимфоцитов
физрастворе на легкой воде флюоресценция образцов выше, т. е. количество
однонитевых разрывов меньше, чем при инкубировании в физрастворе на обычной
воде.
Таким образом, в ходе выполнения
эксперимента показано, что вода с пониженным содержанием дейтерия является либо
ингибитором апоптоза иммунокомпетентных клеток, либо активирует их
ДНК-репарирующие системы.
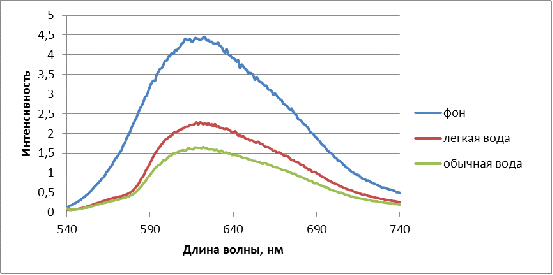
Рисунок 5 - Интенсивность
флюоресценции раствора бромистого этидия с лизатами лимфоцитов крови больных с
ВПР ЧЛО. (Инкубирование в физрастворах, приготовленных на обычной
дистиллированной воде (содержание D 150 ppm) и воде с
измененным изотопным составом (содержание D 40 ppm). Время
инкубирования 16 час, t = 24 0С.)
Для выяснения данного предположения
были проведены эксперименты с использованием рекомбинантного человеческого
фактора некроза опухолей hTNFα. Как известно [36], hTNFα является
провоспалительным цитокином, который инициирует апоптоз как в лимфоцитах, так и
в нейтрофилах. В экспериментах в среде создавалась концентрация hTNFα, равная 10
нг/мл, которая гарантированно инициирует апоптоз лимфоцитов. Клетки, выделенные
из крови здоровых доноров, инкубировались в физрастворе, приготовленном на воде
с пониженным содержанием дейтерия, в присутствии hTNFα при комнатной
температуре. Для контроля лимфоциты инкубировались в физрастворе,
приготовленном на обычной дистиллированной воде, также в присутствии и в
отсутствии hTNFα. По
истечении времени инкубации проводили измерения количества однонитевых разрывов
ДНК. На рисунке 6 приведены соответствующие спектры флюоресценции растворов
лизатов клеток с бромистым этидием. Из рисунка видно, что при использовании
обычной воды действие фактора некроза hTNFα приводит к прогрессивному
накоплению однонитевых разрывов ДНК в клетках - интенсивнось флюоресценции
снижалась. При замачивании на легкой воде разрывов ДНК не появлялось, что
говорит защищающем действии легкой воды.
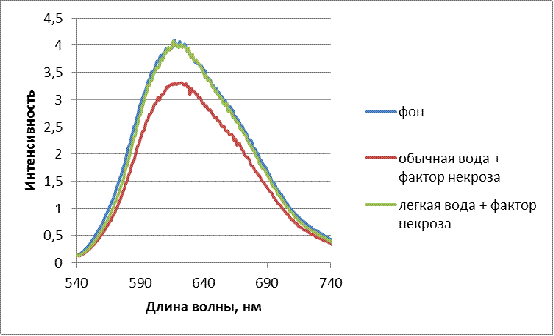
Рисунок 6 - Интенсивность
флюоресценции раствора бромистого этидия с лизатами лимфоцитов крови здоровых
доноров. (Инкубирование в физрастворах с 10 нг/мл hTNFα,
приготовленных на обычной дистиллированной воде (содержание D 150 ppm) и воде с
измененным изотопным составом (содержание D 40 ppm). Время
инкубирования 16 час, t=24 0С.)
На рисунке 7 представлена диаграмма
процентного содержания однонитевых разрывов ДНК в норме, при добавлении фактора
некроза и больных с ВПР ЧЛО при инкубировании в физиологическом растворе на
легкой и обычной воде. Обнаружено, что инкубация лимфоцитов больных доноров в
физрастворе, приготовленном на воде с содержанием дейтерия 40 ppm за 16 часов
уменьшает количество однонитевых разрывов ДНК по сравнению с контролем с 59 -
62 % до 36 - 40 %. Увеличение времени инкубирования до 24 час существенно не влияло
на полученные значения.
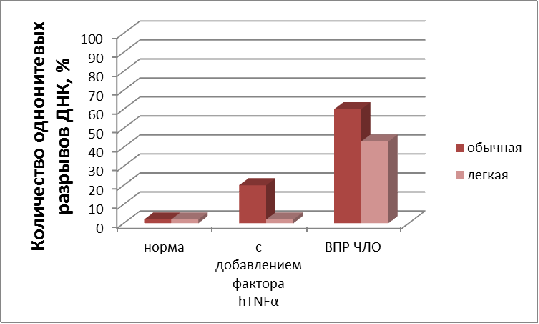
Рисунок 7 - Влияние воды с
измененным изотопным составом на количество однонитевых разрывов лимфоцитов в
норме, с добавлением в инкубационную среду 10 нг/мл hTNFα и у больных
ВПР ЧЛО. (Инкубирование в физрастворах, приготовленных на обычной
дистиллированной воде (содержание D 150 ppm) и воде с
измененным изотопным составом (содержание D 40 ppm). Время
инкубирования 16 час, t = 24 0С.)
При аналогичной обработке
лимфоцитов, полученных из крови здоровых доноров, количество однонитевых
разрывов ДНК было существенно меньше, мало зависело от среды инкубирования и
составляло 2,5 ± 0,2 %. Это свидетельствует, о том, ДНК лимфоцитов здоровых
доноров менее подвержены повреждениям по сравнению с ДНК лимфоцитов больных с
ВПР ЧЛО, в которых наблюдаются мутации генов.
При инкубировании лимфоцитов
здоровых доноров с добавлением фактора некроза опухоли в физрастворе на обычной
воде, количество разрывов ДНК увеличивалось с 2,5 ± 0,2%до 23 - 25 %, а при
замачивании на легкой воде, однонитевых разрывов не наблюдалось.
При использовании воды с содержанием
дейтерия 40 ppm количество
однонитевых разрывов в лимфоцитах достигало максимума через 2 часа инкубации, а
затем резко снижалось. Такое поведение клеток в воде с пониженным содержанием
дейтерия, возможно, связано с тем, что наряду с возникновением однонитевых
разрывов в клетках активируются системы ее репарации, ликвидирующие эти
разрывы. Появлению однонитевых разрывов ДНК предшествует ее фрагментация,
которая наблюдается при вхождении клеток в стадию апоптоза. Вода с пониженным
содержанием дейтерия, по-видимому, делает обратимым этот процесс.
Повреждения ДНК могут быть
ликвидированы с помощью различных механизмов. Основные репаративные механизмы
вырезания (BER) и механизмы репарации нуклеотидов (NER) позволяют
удалить поврежденные и модифицированные нуклеотиды. В частности, NER работает
главным образом на спирали ДНК, препятствуя транскрипции поврежденных участков,
в то время как BER удаляет одиночные нуклеотиды, модифицированные с помощью
метилирования, алкилирования, дезаминирования, или окисления.
Одно- и двунитевые разрывы ДНК
являются частыми событиями в эукариотических клетках: либо при физиологических
условиях в лимфоцитах, либо при патологических процессах, при окислительном
стрессе, ионизирующем излучении, нарушении функционирования ферментов
клеточного ядра.
Адаптация клеток к пониженным
концентрациям дейтерия в среде может способствовать увеличению функциональной
активности систем клетки, связанных со значительными траффиками ионов водорода
и последующей активацией системы ДНК-репарации, связанной с большими затратами
энергии.
Среда с пониженным содержанием
дейтерия создает более благоприятные условия функционирования клеток иммунной
системы, о чем свидетельствует большая сохранность лимфоцитов при инкубации в
подобной среде.
ЗАКЛЮЧЕНИЕ
Основные результаты дипломной работы
состоят в следующем:
изучена литература, посвященная
воздействию воды с измененным изотопным составом на живые системы;
проведены исследования влияния воды
с измененным изотопным составом на состояние ДНК лимфоцитов в норме и
патологии;
экспериментально показано, что вода
с пониженным содержанием дейтерия уменьшала количество однонитевых разрывов ДНК
лимфоцитов больных с ВПР ЧЛО от 60% до 43%, так же легкая вода защищала ДНК
лимфоцитов от повреждения, наносимого фактором hTNFα;
проверен и подтвержден факт
активизации репаративной системы лимфоцитов при их инкубации в воде с
пониженным содержанием дейтерия;
показано, что вода с пониженным содержанием
дейтерия предотвращает апоптоз (массовую гибель) иммунокомпетентных клеток, что
обеспечивает их большую сохранность при воздействии повреждающих факторов
(некроз, ионизирующие излучения, токсины и др.);
впервые получены данные о влиянии
воды с пониженным содержанием дейтерия (40 ppm) in vitro на
некоторые функциональные особенности иммунокомпетентных клеток в норме и
патологии.
Это открывает перспективы для
использования такой воды при различных видах ВПР с целью предотвращения
неконтролируемой массовой гибели иммунокомпетентных клеток.
Результаты дипломной работы изложены
в следующих публикациях:
Текуцкая Е.Е., Барышев М.Г. Сингур
З.Н. Хачатрян А.Ш. Захарова Н.А. «Изучение воздействия низкочастотного
электромагнитного поля на молекулы ДНК в водных растворах» в коллективной
монографии // Современные проблемы физики, биофизики и инфокоммуникационных
технологий»;
Текуцкая Е.Е., Барышев М. Г., Джимак
С. С., Васильев Ю.А., Захарова Н.В. Влияние воды с пониженным содержанием
дейтерия на иммунокомпетентные клетки человека в норме и патологии.» //
Бюллетень экспериментальной биологии и медицины:
Захарова Н.А., Текуцкая Е.Е.,
Храмцова А.А., «Влияние воды с измененным изотопным составом на лимфоциты
человека в норме и паталогии» // Материалы научно-практической конференции
студентов и аспирантов.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1
Петровский. Б. В. Краткая медицинская энциклопедия / Б. В. Петровский. - М.:
Советская энциклопедия, 1989. - 670 с.
Галактионов
В. Г. Эволюционная иммунология / В. Г. Галактинов - М.: ИКЦ «Академкнига»,
2005. - 408 с.
Воробьев
А. В. Микробиология / А. В. Воробьев, А. С. Быков, Е. П. Пашков - М.: Медицина,
1998. - 336 с.
Ярилин
А. А. Основы иммунологии / А. А. Ярилин - М.: Медицина, 1999. - 752 с.
Молекулярные
механизмы апоптоза / В. К. Кухта, Н. В. Морозкина, Е. В. Богатырева, и др. //
БМЖ. - 2004. - № 1. - С. 1-8.
6
Brune B. Nitric oxide: NO apoptosis or turning it ON? / Brune B. // Cell Death
Differ. - 2003. - Vol. 10. - № 8. - P. 864-869.
Ghobrial
I. M. Targeting apoptosis pathways in cancer therapy / I. M. Chobrial, T. E.
Witzig, A. A. Adjei / CA Cancer J. Clin. - 2005. - Vol. 55. - P. 178-194.
Szende
B. The occurrence and significance of apoptosis in tumors / B. Szende // Magy
Onkol. - 2004. - Vol. 48. - № 3. - P. 215-219.
Vermeulen
K. Apoptosis: mechanisms and relevance in cancer / K. Vermeulen, D. R. Van
Bockstaele, Z. N. Berneman // Ann. Hematol. - 2005. - Vol.
84. - P. 627-639.
Широкова
А. В. Апоптоз. Сигнальные пути и изменение ионного и водного баланса клетки /
А. В. Широкова // Цитология. - 2007. - Т. 49. - № 5. - С. 385-394.
Манских
В. Н. Морфологические методы верификации и количественной оценки апоптоза / В.
Н. Манских // Бюллетень сибирской медицины. - 2004. - № 1. - C. 63-70.
Сингер
М. Гены и геномы / М. Сингер, П. Берг - М.: Мир, 1998. - 373 с.
Стент
Г. Молекулярная генетика / Г. Стент, Р. Кэлиндар - М: Мир, 1981. - 646 с.
Глик
Б. Молекулярная биотехнология. Принципы и применение / Б. Глик, Дж. Пастернак -
М.: Мир, 2002. - 592 с.
Курчанов
Н. А. Генетика человека с основами общей генетики / Н. А. Курчанов - СПб.:
СпецЛит, 2009. - 191 с.
Тронов
В. А. Остаточные повреждения ДНК в периферических лимфоцитах после тотального
облучения человека / В. А. Тронов, Е. В. Гринько, М. В. Кончаловский //
Медицинская радиология. - 1993. - Т. 38. - № 2. - С. 38-41.
17
Nataraiau A. I. DNA repair and chromosomal alterations / A. I. Nataraiau, K.
Palilti // Mutdtioh Research. - 2008. - Vol. 657. - № 1. - P. 3-7.
Kolodner
R. D. Coupling distain sates in DNA during DNA mis-match repair / R. D.
Kolodner, M. M. Mendillo, C. D. Putnam // Proceedings of the Natural Academy of
Sciences of the United Slates of America. - 2007. - Vol. 104. - № 32. - P.
12953 - 12955.
Hoctimakers
J. H. Genome maintenance mechanisms for reverting cancer / J. H. Hoctimakers //
Nature. - 2001. - Vol. 411. - № 6835. - P. 366-374.
Lifter
M. R The mechanism of double-strand DNA break repair by the nonhomologous DNA
end joining pathway / M. R. Lifter // Annual Review of Biochemastry. - 2010. -
Vol. 79. - № 6. - P. 181-211.
Shibata
A. Factors determining DNA double strand break repair pathway choice in G12
phase / A. Shibata, S. Conrad // EMBO Journal. - 2011. - Vol. 30. - № 6. - P.
1079-1092.
22
Антонченко В. Я. Основы физики воды / В. Я. Антонченко, А. С. Давыдов, В. В.
Ильин - Киев: Наук. Думка, 1991. - 672 с.
Баранова
В. Ю. Изотопы: свойства, получение, применение / В. Ю. Баранова - М.: ИздАТ,
2000. - 703 с.
Бармин
М. И. Экология воды / М. И. Бармин, П. Н. Темнов - M.:
Комильфо, 2010. - 237 с.
Мухачев
В. М. Живая вода / В. М. Мухачев. - М.: Наука, 1975. - 143 c.
26
Bild W. Research concerning the radioprotective and im-munostimulating effects
of deuterium-depleted water / W. Bild, I. Stefanescu, I. Haulica // Rom J
Physiol. - 1999. - № 36. - P. 205-218.
Doina
P. M. Variation of the deuterium concentration in rats» blood after deuterium
depleted water administration and intoxication with cadmium / P. M. Doina, L.
Olariu, S. Cun // Bulletin UASVM Veterinary Medicine. - 2008. - Vol. 65. - № 1.
- P. 418-423.
28
Мосин О. В. Изучение биологических эффектов тяжелой воды в биологических
системах на примере клеток прокариот и эукариот / О. В. Мосин, И. Игнатов //
Биомедицина. - 2012. - №3. - С. 35-50.
Лобышев
В. Н. Изотопные эффекты D2О
в биологических системах. / В. Н. Лобышев, Л. П. Калиниченко - М.: Наука, 1978.
- 215 с.
Рыжова
А. И. Цитохимия нуклеиновых кислот в норме и патологии / А. И. Рыжова - Томск:
Изд-во Томского ун-та, 1965. - 166 с.
Кисловский
Л. Д. Структура и роль воды в живом организме / Л. Д. Кисловский. - Л.: Изд-во
ЛГУ, 1966. - 175 с.
32
Cioni P. Effect of Heavy Water on Protein Flexibility/ P. Cioni, G. B.
Strambini // Biophysical Journal. - 2002. - Vol. 82. - № 6. - P. 3246-3253.
Cong
F. S. Deuterium-depleted water inhibits human lung carcinoma cell growth by
apoptosis / F. S. Cong, Y. R. Zhang, H. C. Sheng // Experimental and
Therapeutic Medicine. - 2010. - Vol. 1. - № 2. - P. 277-283.
34 Барышев
М. Г. Способы получения воды с пониженным содержанием дейтерия / М. Г. Барышев,
С. Н. Болотин, С. С. Джимак. // Экологический вестник научных центров
Черноморского экономического сотрудничества. - 2013. - № 1. - С. 13-17.
Оценка
антирадикальной активности воды с модифицированным изотопным составом с помощью
ЯМР, ЭПР и масс-спектроскопии / М. Г. Барышев, А. А. Басов, С. Н. Болотин и др.
// Известия РАН. Серия Физическая.
- 2012. - Т.76. - №12. - С.
1507-1510.
Boyum
A. Separation of leukocytes from blood and bone marrow / A. Boyum // Scandinavian
Journal of Clinical & Laboratory Investigation. - 1968. - Vol. 21. - № 97.
- P. 1-9.
37
Черешнев В. А. Иммунология воспаления. Роль цитокинов / В. А. Черешнев, Е. Ю.
Гусев // Медицинская иммунология. - 2001. - Т. 3. - № 3. - С. 361 - 368.