Методические особенности подготовки учащихся к государственной итоговой аттестации по химии в условиях малокомплектной сельской школы
ФГАОУ ВПО «СЕВЕРО-ВОСТОЧНЫЙ
ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ имени М.К. АММОСОВА»
ИНСТИТУТ НЕПРЕРЫВНОГО
ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
БИОЛОГО-ГЕОГРАФИЧЕСКИЙ ФАКУЛЬТЕТ
КАФЕДРА МЕТОДИКИ ПРЕПОДАВАНИЯ
БИОЛОГИИ, ХИМИИ и ГЕОГРАФИИ
Методические особенности подготовки
учащихся к государственной итоговой аттестации по химии
в условиях малокомплектной сельской
школы
(Дипломная работа)
Выполнила: слушатель курсов ПП «Учитель биологии и химии»
Буслаева Татьяна Николаевна
Якутск 2013
Содержание
Введение
Глава 1. Государственная итоговая аттестация по химии как
основа подготовки учащихся к ЕГЭ
1.1 Сущность государственной итоговой аттестации (ГИА) по
химии учащихся основной школы
1.2 Спецификация заданий КИМ-ов ГИА по химии
.3 Формы и средства подготовки учащихся к ГИА по химии
1.3.1 Система оценивания экзаменационной работы по химии
1.3.2 Инструкция заполнения бланков
Глава 2. Пути и условия подготовки учащихся к ГИА в сельской
малокомплектной школе
2.1 Организация и проведение подготовки к ГИА по химии в
условиях малокомплектной сельской школе
2.2 Методика подготовки учащихся к ГИА по химии
.3 Педагогический эксперимент по подготовке учащихся к
ГИА по химии
2.3.1 Выявление уровня знаний учащихся по химии
2.3.2 Постановка и проведение педагогического эксперимента
.3.3 Анализ работ учащихся к ГИА по химии
Выводы
Список использованной литературы
Приложение №1
Приложение №2
Приложение №3
Приложение №4
Приложение №5
Приложение №6
Введение
Актуальность сформулированной темы дипломного проекта обусловлена тем,
что сдача ГИА является одним из важнейших аспектов обучения в школе, так как
окончание 9 класса является обязательным курсом обучения в школе. Кроме того,
ГИА является подготовкой к сдаче ЕГЭ, по результатам которого школьник
поступает в ССУЗы и ВУЗы. ГИА по химии - это один из экзаменов в конце 9-го
класса, который может сдаваться по выбору ученика. Результаты этого экзамена
будут рассматриваться при зачислении в 10-й класс с профильным уклоном, а также
при поступлении в профессиональные училища, где требуется знание химии,
например в медицинские училища.
Государственная итоговая аттестация школьников по химии является сложным
процессом обучения. У любой науки, в том числе и химии свои законы, теории,
свой накопленный опыт, который усваивают многие поколения школьников. То есть
наука - это главным образом сокровищница накопленных знаний, и обучение, в
общем, и целом можно рассматривать как процесс переноса научных знаний из
учебника в голову ученика. Но в то же время, накопленные знания - это продукт
духовной деятельности, органично включающий в себя нечто живое человеческое и,
следовательно, не могут быть отделимы от человека. Поэтому перенос научных
знаний из учебника или головы учителя в головы учеников нельзя осуществлять
механически, игнорируя познавательную активность учащегося. На современном
этапе к основной задаче обучения следует отнести действительное, истинное
освоение учебного материала, что возможно лишь при творческом его восприятии, а
не зубрежке, вызывающей отвращение к учебе.
Чтобы решить эту проблему, необходимо использовать современные методики
обучения, развивающие обучение и научить школьников «учить творчески».
Сегодня учитель вправе самостоятельно выбирать содержание,
организационные формы и методы обучения. В его распоряжении альтернативные
концепции химического образования, вариативные программы и учебники, в основе
которых, прежде всего, лежит химический эксперимент, без которого невозможно
успешное изучение химии.
Проблема исследования: вытекает из противоречия между
необходимостью истинного освоения учебного материала и механическим выбором
ответов заданий ГИА по шаблону.
Целью данного дипломного проекта является повышение эффективности
подготовки учащихся к ГИА по химии в условиях сельской малокомплектной школы.
Для достижения поставленной цели, выдвинуты следующие задачи:
· Анализ научной и научно-методической литературы по проблеме
подготовки учащихся к ГИА по химии;
· Определить методические пути и условия подготовки учащихся к
ГИА по химии в малокомплектной сельской школе;
· Разработать методику подготовки учащихся малокомплектной
сельской школы к ГИА по химии;
· Выявить эффективность использованной методики подготовки
учащихся к ГИА по химии.
Глава 1. Государственная итоговая аттестация (ГИА) по химии как основа
подготовки учащихся к ЕГЭ
1.1 Сущность государственной итоговой аттестации по химии
учащихся основной школы
Целью итоговой государственной аттестации является определение
соответствия уровня и качества подготовки выпускника требованиям
государственных образовательных стандартов (включая федеральный,
национально-региональный и другие компоненты). Задачей итоговой государственной
аттестации является определение теоретической и практической подготовленности
выпускника.
Государственная (итоговая) аттестация выпускников представляет собой
форму государственного контроля (оценки) освоения выпускниками основных
общеобразовательных программ основного общего и среднего (полного) общего
образования в соответствии с требованиями федерального государственного
образовательного стандарта среднего (полного) общего образования.
Государственная (итоговая) аттестация завершает освоение указанных
образовательных программ в образовательных организациях, имеющих
государственную аккредитацию. [Корощенко, 2011]
Формы и порядок проведения государственной (итоговой) аттестации
установлены приказом Министерства образования и науки РФ от 28 ноября 2008 г. №
362 «Об утверждении положения о формах и порядке проведения государственной
(итоговой) аттестации обучающихся, освоивших основные общеобразовательные
программы среднего (полного) общего образования» и приказом Министерства
образования РФ от 3 декабря 1999 г. № 1075 «Об утверждении положения о
государственной (итоговой) аттестации выпускников IX и XI (XII) классов
общеобразовательных учреждений». Следует отметить, что Приказ № 1075
применяется на настоящий момент только в отношении итоговой аттестации
обучающихся, освоивших программы основного общего образования.
Действующим законодательством предусматривается несколько форм
государственной (итоговой) аттестации:
· для контроля освоения программ основного общего образования
государственная (итоговая) аттестация проводится в форме устных и письменных
экзаменов;
· освоение программ среднего (полного) общего образования
завершается единым государственным экзаменом;
· государственная (итоговая) аттестация в форме
государственного выпускного экзамена проводится для отдельных категорий
обучающихся.
Государственная (итоговая) аттестация лиц, закончивших освоение программ
основного общего образования. Государственная (итоговая) аттестация выпускников
IX классов общеобразовательных учреждений проводится по завершении учебного
года в виде письменных и устных экзаменов. Форму проведения письменных
экзаменов устанавливает Министерство образования Российской Федерации, устных
экзаменов - общеобразовательное учреждение.
Государственная (итоговая) аттестация по всем общеобразовательным
предметам (за исключением иностранных языков), проводится на русском языке.
Государственная (итоговая) аттестация в форме ЕГЭ проводится для
выпускников образовательных учреждений, в том числе для иностранных граждан,
лиц без гражданства, беженцев и вынужденных переселенцев, освоивших основные
общеобразовательные программы среднего (полного) общего образования в очной,
очно-заочной (вечерней), заочной формах, а также для лиц, освоивших основные
общеобразовательные программы среднего (полного) общего образования в форме
экстерната, семейного образования или самообразования и допущенных в текущем
году к государственной (итоговой) аттестации.
Итак, подготовка учащихся к ГИА - ответственный и трудоёмкий процесс, как
для учителя, так для ученика и его родителей. Волнения, сомнения, опасения
наблюдаются у всех. Ученикам кажется, что объем материала для ГИА не посильный,
учитель вынужден неоднократно объяснять один и тот же материал во внеурочное
время, родители в поисках репетитора.
Снять нервозность при подготовке и достичь хороших результатов на ГИА
помогает системный подход, который включает:
· четкое планирование содержания и вида деятельности всех
участников, на основе которого составляются технологические карты учителя и
ученика, учитель выступает в роли модератора;
· использование активных методов обучения, позволяющих
реализовать принципы сознательности, активности и самостоятельности учащихся
при руководящей роли учителя.
Что касается описание опыта работы, то деятельность учителя заключается в
том, что на основе анализа министерских документов составляется таблица «План
ГИА», в которой указаны: номер задания, краткое содержание задания, время на
выполнение, сколько баллов за него. Кроме того, прогнозируются и выделяются
сложные вопросы, которые заведомо вызовут у учащихся затруднения. Эти вопросы
учитель объяснит сам на фронтальных консультациях, оформит на
карточках-инструкциях в письменном виде для самостоятельного повторения,
подберет ЭОРы для самоподготовки и самопроверки учащимися. Подбирается,
оформляется и ежегодно дополняется дидактический материал в специальных папках.
Папки пронумерованы по числу столов в классе и используются как для подготовки
к ГИА, так и на уроках для закрепления и проверки учебного материала. Начинаем
применять этот материал с первого года обучения химии, т.е. с 8 класса. По
каждой теме составлена рекомендация для успешного выполнения задания. Данный
дидактический материал доступен учащимся для самоподготовки. Составляются
«Тренажеры» по основным темам, в которых ученик сам пошагово выявляет: «Я
могу?», «Я умею?», - для выявления того момента, с которого начинается «не
знание» при выполнении задания. Составляется для ученика лист «Самоанализ
подготовки к ГИА», в котором ученик сам будет фиксировать, в каких заданиях
теста допустил ошибку, и на этой основе планировать свой дальнейший
образовательный маршрут. [#"788923.files/image001.gif">
Рис. 1.1
Глава 2. Методические особенности подготовки учащихся к ГИА в сельской
малокомплектной школе
.1 Организация и проведение подготовки к ГИА по химии в условиях
малокомплектной сельской школе
Сельская малокомплектная школа является составной частью общегосударственной
системы образования. Это главный резерв пополнения кадров для
сельскохозяйственного производства. Её состояние и уровень работы оказывает
огромное влияние на социально-экономическое развитие села, на
культурно-образовательный уровень населения, решение демографических проблем.
Образование в сельской местности должно соответствовать социальным
ожиданиям людей, социально-ценностному заказу сельского сообщества, должно
учитывать психолого-социологические особенности обучения учащихся.
Школа представляет собой важную часть сельского социума и не может
развиваться в отрыве от него. Инертность социально-экономического развития
жизни села оказывает большое влияние на развитие мышления учащихся - мышление
детей не совпадает с современным темпом развития общества в целом, и в
частности городским темпом развития. Безусловно, удаленность от культурного
центра, особенности языковой среды, узкий круг общения, низкий образовательный
ценз родителей и другие социальные особенности села оказывают большое значение
в развитии ребенка.
Безальтернативность образовательного пространства, отсутствие в
социальной инфраструктуре отдаленных сельских округов других образовательных
учреждений лишает ученика сельской школы возможностей дополнительного
образования.
Особо стоит отметить, что языковая среда в наших условиях чисто якутская,
существующий языковой барьер, а также удаленность и изолированность места
проживания от культурного центра сужает круг общения. Это приводит к
недостаточному развитию коммуникативных способностей. Такие
психолого-социологические особенности обучения учащихся делают условия работы
сельской малокомплектной школы весьма специфичными.
Таким образом, вышеуказанные особенности учащихся позволяют сделать вывод
о том, что школа в селе должна стать носителем инноваций, вооружать ребенка
видением, способами, идеологией качественной жизни на селе. Именно со школой
сегодня связаны надежды на воспитание сельского труженика нового типа,
повышение роли человеческого фактора в сельском хозяйстве, совершенствование
культуры и социально-бытовых условий жизни современного села.
Наша школа имеет статус малокомплектной школы с 2012 г.
Отдаленность от улусного центра - 200 км.
Полное наименование общеобразовательного учреждения в соответствии с
Уставом
Муниципальное бюджетное общеобразовательное учреждение
«Югюлятская средняя общеобразовательная школа» МР «Вилюйский улус
(район)» Республики Саха (Якутия)
Юридический адрес
, Россия, Республика Саха (Якутия), Вилюйский улус (район), с.Кюбеингде,
ул.Попова 28.
Директор образовательного учреждения (Ф.И.О. полностью)
Ксенофонтова Любовь Алексеевна
Заместители директора ОУ по направлениям (Ф.И.О. полностью)
Заместители директора (по видам деятельности) Ф.И.О.
Заместитель директора по учебной работе Кузнецова Юлия Николаевна
Из истории школы: 1920 -22 гг. - в церкви открылась и работала
двухклассная школа-пансион. Учительствовала Попова Анна Александровна, дочь
священника Александра. 1926 г. - открывается 4-летняя начальная школа. Учителем
работал сын того же священника Ванифатий Попов. 1934-35 гг. - в школе открылся
пятый класс. 1936-37 гг. - открылись 6, 7 классы. 1954 г. - вводится здание
школы на 52 места. 1958 г. - школа становится средней. 1965 г. - силами
учащихся старших классов построен второй корпус школы, где учились начальные
классы. 1970-71 гг. - школа стала восьмилетней. 1985 г. - вводится новое 2-х
этажное здание школы на 192 места. 1997 г. - школа получила статус «Улусная
экспериментальная площадка»
г. - статус «Республиканская экспериментальная площадка»
Телефон 8(41132)29-8-56 Факс
8(41132)29-8-46
e-mail schugul2@gmail.com
Характеристика педагогического коллектива.
Образовательный уровень педагогов.
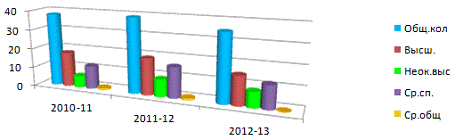
Рис. 2.1
Из-за сокращения штатных единиц количество педагогов уменьшилось до 35.
61% педколлектива составляют молодые специалисты. Имеем 5 заочников, 2 педагога
обучаются на курсах переподготовки по специальности, 1 - в Институте управления
при Президенте, из них соответственно оканчивают ВУЗ в этом году 3,
переподготовку - 2. Если в прошлые годы работало не по специальности 5
педагогов, то в этом году только 1.
Профессиональный уровень педагогов.

Рис. 2.2
За 3 года за счет «омоложения» педагогического коллектива увеличилось
количество работников с базовой категорией и категорией на соответствие
занимаемой должности. В этом году в % отношении увеличилось количество
педагогов, имеющих высшую квалификационную категорию по сравнению с прошлым
учебным годом. По плану аттестацию проходят нынче на подтверждение высшей
категории 2 педагога, на соответствие - 3.
Организация образовательного процесса.
Таблица 2.1 Контингент обучающихся и его структура.
|
I ступень
|
II ступень
|
III ступень
|
Всего по ОУ
|
|
Количество обучающихся
|
44
|
36
|
22
|
102
|
|
Общее количество классов
|
4
|
5
|
2
|
11
|
|
Средняя наполняемость классов
|
11
|
7
|
12
|
10
|
С целью обеспечения открытости деятельности школы, оперативного и
объективного информирования участников образовательного процесса, социальных
партнеров и других заинтересованных лиц по всем направлениям деятельности
школы, позитивной презентации школы, формирования ее положительного имиджа
функционирует информационный сайт.
Образовательный процесс проходит в одну смену.
Обучение в средней школе ведётся по базисному учебному плану РС(Я) 2005г.
Дополнено школьным и региональным компонентом.
В организационной структуре системы управления представлены все субъекты
управления: Педагогический совет, Ученический совет, директор школы,
заместитель директора по УВР.
Органы государственно-общественного управления. Для решения вопросов
функционирования и развития школы в 2008 г. создан ШУС школы, состоящий из
представителей педагогической, ученической, родительской общественности,
представителя управления образования.
Органы самоуправления представлены Ученическим советом. Обобщая
вышесказанное можно отметить такие особенности малокомплектной сельской школы:
• Отдаленность от культурного центра, изолированность места
проживания от культурного центра;
• Особенности языковой среды;
• Узкий круг общения;
• Низкий образовательный ценз родителей;
• Отсутствие возможностей дополнительного образования;
• Мышление детей не совпадает с современным темпом развития
общества в целом;
• Низкий уровень социально-бытовых условий жизни.
2.2 Методика подготовки учащихся к ГИА по химии
Констатирующий эксперимент проводился в 2012 - 13
учебном году на базе МБОУ «Югюлятская средняя общеобразовательная школа», в нем
участвовали учащиеся IX
класса, выбравших предмет химия для сдачи ГИА, в количестве 3 человек (Иванов Айсен,
Николаев Вася, Попова Настя), обучающиеся по учебнику
Цель педагогического эксперимента заключалась в выявлении и обосновании
педагогических условий, которые являются эффективным средством подготовки к ГИА
по химии учащихся IX класса.
Для достижения цели необходимо решить следующие
задачи:
. Выявить уровень подготовленности школьников к
ГИА по химии.
. Изучить и подобрать соответствующие уроки для
изучения.
. Провести занятия по подготовке учащихся к ГИА
по химии.
. Проанализировать и обобщить полученные
данные.
В соответствии с целью и задачами были определены и
использованы следующие методы исследования:
· теоретический анализ методической
литературы по теме исследования;
· методика изучения;
· педагогическое наблюдение;
· анализ экспериментальных данных.
Исследование проходило в 3 этапа.
На 1 этапе изучался уровень знания и подготовленности
к сдаче ГИА по химии.
этап был направлен на экспериментальную реализацию
методики изучения химии для сдачи ГИА. На заключительном 3 этапе оценивалась
эффективность мероприятий.
С самого начала обучения необходимо формировать
познавательную активность учеников, что должно стать неотъемлемой чертой
обучения учащихся. Мы считаем, для того, чтобы повысить уровень знания по
химии, а также подготовленность к сдаче ГИА учащихся необходимо использовать
методы работы, назначение которых формирование интереса к предмету, активизация
учащихся, развитие мыслительных операций. Активизацию учащихся на уроках химии
можно достичь не только через теорию, но и через решения задач, лабораторные
работы, проявлением творческих и интеллектуальных способностей учеников.
Методика проведения занятий по подготовке учащихся к
ГИА состоит из 5 этапов: мотивация, актуализация, тренинг, активизация,
рефлексия (таблица 5).
Таблица 6 Методика проведения занятий по подготовке к
ГИА учащихся
|
№
|
Этапы урока
|
Деятельность учителя
|
Деятельность учащихся
|
|
1
|
Мотивация
|
Организация Информирование Диагностика
|
Знакомство с правилами, инструкциями
|
|
2
|
Актуализация
|
Проведение занятий, химического эксперимента
|
Групповая работа, лабораторная работа
|
|
3
|
Тренинг
|
Разбор заданий
|
Тесты, задания
|
|
4
|
Активизация
|
Контроль, коррекция, организация химического эксперимента
|
Автомониторинг, практические занятия
|
|
5
|
Рефлексия
|
Выявление зон затруднения
|
Самоконтроль, решение задач
|
Средства обучения, использованные в подготовке к ГИА
по химии:
. Научно-методические журналы, газеты,
электронные пособия «Химия. Все для учителя», «1 сентября».
. Сборники для подготовки к экзаменам,
рекомендованные ФИПИ.
. ИКТ технологии (цифровые образовательные
ресурсы, а также Интернет ресурсы, тесты в режиме он-лайн ).
. Справочные таблицы, схемы
. Инструкции к практическим и лабораторным
работам
. Опорные конспекты
2.3 Педагогический эксперимент по подготовке учащихся к
ГИА по химии
.3.1 Выявление уровня знаний учащихся по химии
Для определения уровня знаний по химии, а также для
определения подготовленности к сдаче ГИА по химии мы использовали метод
наблюдения.
Были выявлены следующие методические условия
проведения занятий:
• Особенности малокомплектной сельской школы
• Обязательные этапы проведения
подготовительных занятий
• Средства обучения к ГИА
Ход проведения: планирование последовательности
наблюдения, порядка и способа фиксирования результатов, занесение данных в
таблицу.
Итак, мы провели тестирование по типовому тесту ГИА по
химии с целью выявления уровня знаний (Приложение №4).
Для выявления уровня знаний использованы тесты,
состоящая из трех частей в котором:
Часть А. В экзаменационной работе представлены две разновидности заданий
с выбором ответа:
· для выполнения задания обучающийся должен выбрать один из
четырех предложенных вариантов ответа, например:
А3 Ковалентная полярная
связь образуется между атомами
) натрия и брома
) серы и кислорода
) водорода
) Калия и хлора
· другая разновидность заданий части А предлагает два суждения,
верность этих суждений обучающему необходимо оценить и выбрать правильный
ответ, например:
А17. Верны ли следующие
суждения о правилах безопасной работы в химической лаборатории?
А. При нагревании
жидкости в пробирке горлышко пробирки необходимо направлять в сторону от соседа
по парте
Б. Сосуд с горячей
жидкостью необходимо закрывать пробкой сразу после окончания нагревания.
) верно только А
) верно только Б
) верны оба
суждения
) оба суждения неверны
Задания части А входят в состав каждого
содержательного блока. Блок «Вещество» и «Элементарные основы неорганической
химии. Представления об органических веществах» содержит по шесть заданий части
А, блок «Химическая реакция» - пять заданий, блок «Методы познания веществ и
химических явлений» - два задания.
Часть В включает задания с кратким ответом (повышенного уровня
сложности). Задания части В оцениваются двумя баллами. Максимальный первичный
балл этой части 8, что составляет 23,5 процентов максимального первичного балла
за задания данного уровня сложности (от общего максимального первичного балла -
34). Доля заданий повышенного уровня сложности составила в работе 16 процентов.
В экзаменационной работе 2010 года предложены:
· два задания на выбор нескольких правильных ответов из
предложенного перечня (множественный выбор), например:
В1 В ряду химических
элементов As - P - N
) увеличиваются
радиусы атомов
) увеличивается
электроотрицательность
) усиливаются
кислотные свойства их высших оксидов
) возрастает
значение высшей степени окисления
) увеличивается
число электронов во внешнем слое атомов
Ответ:____________________________________
· два задания на установление соответствия позиций,
представленных в двух множествах, например:
В3 Установите соответствие
между изменением степени окисления атома и схемой превращения вещества
А) H2S + O2 →
H2O + SO2 1) S+4
→ S+6
Б) H2SO4 + Na
→ Na2SO4 + H2S + H2O 2) S+6
→ S-2
В) SO2 + H2O
+ Br2 → H2SO4 + HBr 3) S+6
→ S+4
4) S-2 → S+6
5) S-2 → S+4
Ответ:____________________________________
Правильный ответ записывается в виде набора цифр.
Задания части В входят в состав трех блоков: Блоки «Вещество» и
«Химическая реакция» содержат по одному заданию, «Элементарные основы
неорганической химии. Представления об органических веществах» содержит два
задания.
Часть С включает задания с развернутым ответом (высокого уровня
сложности) и состоит из двух заданий. Задание С1 оценивается четырьмя баллами,
задание С2 - тремя баллами. Максимальный первичный балл этой части 7, что
составляет 20,6 процентов максимального первичного балла за задания данного
уровня сложности (от общего максимального первичного балла - 34). Доля заданий
высокого уровня сложности составила в работе 8 процентов.
Задания с развернутым ответом проверяют усвоение обучающимися следующих
элементов содержания: способы получения и химические свойства различных классов
неорганических соединений, реакции ионного обмена, взаимосвязь веществ
различных классов, количество вещества, молярный объем и молярная масса
вещества, массовая доля растворенного вещества.
При выполнении первого задания части С, необходимо составить уравнения
реакций, отражающих взаимосвязь между веществами, принадлежащими к различным
классам неорганических веществ, одно из превращений рассмотреть с точки зрения
реакций ионного обмена. Например:
С1. Дана схема превращений:
Cu → CuCl2 → Cu(OH)2 → CuO
Вопрос: Напишите молекулярные уравнения реакций, с помощью которых можно
осуществить указанные превращения. Для второго превращения составьте
сокращенное ионное уравнение реакции.
Второе задание представляет собою комбинированную задачу, в основе
которой два типа расчетов: вычисления массовой доли растворенного вещества в
растворе и вычисление количества вещества, массы или объема по количеству
вещества, массе или объему одного из реагентов или продуктов реакции. Например:
С2. Через 40 г раствора с массовой долей гидроксида натрия 6% пропустили
углекислый газ до образования карбоната натрия. Вычислите объем (н. у.)
вступившего в реакцию газа.
Выполнение заданий повышенного уровня сложности позволяет осуществлять
дифференциацию учащихся по уровню их подготовки и на этой основе выставлять им
более высокие отметки («4» и «5»).
Задания части С входят в состав двух содержательных
блоков: С1 - «Элементарные основы неорганической химии. Представления об
органических веществах»; С2 - блок «Методы познания веществ и химических
явлений».
Максимальное количество баллов, которые может получить
ученик - 33 балла.
Итак, результаты показали, что Иванов Айсен получил:
· в части А - 9 баллов из 15 (60% от
части А);
· в части В - 2 балла из 8 (25% от
части В);
· в части С 4 балла из 10 (40% от части
С).
Общее количество баллов составляет 15 баллов из 33,
что составляет 45,5% от всех заданий. Из его результатов видно, что ученик
лучше справился с частью С, чем с В. Это значит что он может решать задачи, а
на выявление правильного ответа в части В он путается.
Результаты Николаева Васи показали, что он получил:
· В части А - 12 баллов из 15 (80% от
части А);
· В части В - 4 балла из 8 (50% от
части В);
· В части С - 1 балл из 10 (10% от
части С).
Общее количество полученных Васей баллов составляет 17
из 33, что составляет 51,5% от всех частей задания. Из его результатов видно,
что ученик неплохо справился с частью А, часть В сделал наполовину, а в части С
всего лишь 1 балл, что означает ему нужно углубленно изучить решение задач.
Результаты тестирования Поповой Насти показали
следующее:
· В части А - 13 баллов из 15 (87% от
части А);
· В части В - 5 балла из 8 (62,5% от
части В);
· В части С - 3 балл из 10 (30% от
части С).
Общее количество баллов полученных Настей составляет
21 балл из 33, что составляет 63,6% от всего задания. Результаты тестирования
Насти показывают, что ученица хорошо справилась с заданием части А, часть В
выполнила больше половины и 3 балла части С. Знания Насти по химии достаточно
высокие, однако это не значит, что ей не надо заниматься, а как раз наоборот.
Для сравнения уровня знаний по частям всех трех учеников создадим диаграмму, в %.
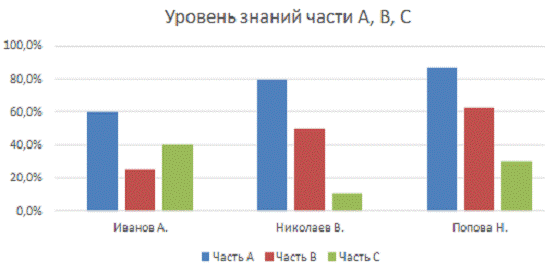
Рисунок 2. Сравнение уровня знаний учащихся по химии
по частям задания
Из указанной выше диаграммы видно, что со всеми
частями справилась лучше всего Попова Н. с баллами 87% части А, выше Иванова А.
на 17% и выше Николаева В. на 27%. В части В больше на 37,5% и на 12,5%
соответственно, а также в части С меньше Иванов А. на 10% и больше Николаева В.
на 20%.
Общее количество баллов наибольшее у Поповой Н. - 63,6 %, больше чем у
Иванова А. на 18,1%, а чем у Николаева В. на 12,1%.
Таким образом, результаты тестирования по выявлению уровня знаний по
химии к сдаче ГИА, показали, что уровень знания у школьников среднее. Чтобы
повысить этот уровень следует проводить уроки по темам части В и решением задач
части С.
2.3.2 Постановка и проведение педагогического эксперимента
На основании диагностики уровня знаний школьников по
химии к сдаче ГИА мы пришли к выводу, что необходимо применять такие формы и
методы работы, которые будут способствовать её активизации и актуализации.
Описанные ниже занимательные уроки использовались в
работе над некоторыми разделами программы по химии.
Таблица 2 Календарно-тематический план проведенных
уроков
|
№ п/п
|
Содержание
|
Основные умения и знания
|
Деятельность учителя
|
Деятельность учащихся
|
|
1
|
Вид итоговой аттестации в форме ЕГЭ. Структура и содержание
экзаменационной работы и условия ее проведения. Знакомство с КИМом, бланками
ответов
|
Знать: § Структуру КИМа; § Типы тестовых заданий; Ø А-задания с выбором ответа:
-Формулировка условия в виде вопроса; -В виде утверждения; -В виде двух
суждений; Результат - выбор правильного ответа из 4х предложенных. Ø В-задания с кратким ответом:
-выбор нескольких правильных ответов из предложенного перечня; -установление
соответствия позиций, представленных в двух множествах. Правильный ответ
записывается в виде набора цифр. Ø С-задания с развернутым ответом:
-цепочка превращений, отражающая генетическую связь между основными классами
неорганических соединений; -комбинированная задача: -задание, предполагающее
мысленный эксперимент. Уметь: § работать с бланками ответов
|
Микролекция
|
Заполнение бланка ответов
|
|
2
|
Вещество Строение атома. Периодический закон.
|
Составлять: § схемы строения атомов первых 20 элементов ПСХЭ Д.И.
Менделеева. Характеризовать: § химические элементы на основе их положения в ПС и
особенностей строения их атомов; Объяснять: § физический смысл порядкового номера
химического элемента, номеров группы и периода в ПС, к которым принадлежит
элемент; § закономерности
в изменении свойств химических элементов и их соединений
|
Беседа. Знакомство с тестами КИМа с выбором ответа и
кратким ответом: -А-1; А-2; -В-1
|
Тренинг (выполнение тематических тестов); Работа в парах
(умение комментировать)
|
|
3
|
Строение вещества. Химическая связь. Степень окисления
элементов.
|
Определять: § вид химической связи и степень окисления элементов
|
Беседа. Знакомство с тестами КИМа с выбором ответа и
кратким ответом: -А-3; А-4
|
Тренинг (выполнение тематических тестов) Автомониторинг
|
|
4
|
Простые и сложные вещества. Чистые вещества и смеси
|
Называть: § вещества по химическим формулам; § составлять формулы важнейших
неорганических соединений изученных классов; Определять: § принадлежность веществ к
определенному классу; Вычислять: § массовую долю химического элемента в веществе; § массовую долю растворенного
вещества в растворе; § массовую долю вещества в смеси.
|
Беседа Знакомство с тестами КИМа : -А-5; А-15; -В-4; -С-2
|
Игра-соревнование Практическая работа 1 «Решение расчетных
задач»
|
|
5
|
Химическая реакция. Методы познания веществ. Химическая
реакция. Условия и признаки протекания. Химические уравнения. Классификация
химических реакций по различным признакам.
|
Называть: § типы химических реакций; Составлять: § уравнения химических реакций;
Определять: § сущность
химических реакций; § тип химической реакции по известным классификационным признакам;
|
Беседа Знакомство с тестами КИМа части А и В: -А-6; -В-2
|
Лабораторная работа 1. Тренинг.
|
|
6
|
Вычисления по химическим уравнениям
|
Вычислять: § количество вещества, объем или массу вещества по количеству
вещества, объему или массе реагентов или продуктов реакции.
|
Знакомство с расчетными задачами части С-2.
|
Практическая работа 2 «Вычисления по химическим уравнениям»
|
|
7
|
Электролитическая диссоциация кислот, щелочей и солей.
Реакции ионного обмена и условия их осуществления.
|
Определять: § возможность протекания реакций ионного обмена; Объяснять: § сущность реакций ионного обмена;
Составлять: § уравнения
реакций ионного обмена в молекулярном и ионном видах;
|
Беседа. Знакомство с тестами КИМа части А, В, С: -А-7; А-8;
- В-3 - С-1; С-3;
|
Лабораторная работа 2 «Условия реакций ионного обмена».
Групповая работа.
|
|
8
|
Качественные реакции на ионы в растворе. Получение аммиака
|
Характеризовать: § качественные реакции на хлорид-, сульфат-, карбонат-ионы,
ионы аммония
|
Беседа с применением таблиц-подсказок
|
Лабораторная работа 3 «Качественные реакции на ионы».
Парная работа
|
|
9
|
Окислительно-восстановительные реакции
|
Составлять: § уравнения окислительно-восстановительных реакций;
Определять: § окислитель
и восстановитель; § процессы окисления и восстановления;
|
Беседа с применением опорных схем; -А-4; -В-3;
|
Тренинг. Работа в парах
|
|
10
|
Основы неорганической химии. Методы познания веществ и
химических явлений. Химические свойства простых веществ: металлов и
неметаллов. Получение простых веществ: водорода и кислорода.
|
Характеризовать: § химические свойства металлов и неметаллов; § качественные реакции на водород и
кислород;
|
Микролекция Знакомство с тестами КИМа части А и В: -А-9;
А-14: -В-4;
|
Практическая работа 3 «Получение газов» Групповая работа
|
|
11
|
Химические свойства оксидов: основных, кислотных и
амфотерных. Получение углекислого газа
|
Характеризовать: § химические свойства оксидов; § качественные реакции на углекислый
газ;
|
Беседа с применением опорных схем; -А-10; А-14; -В-4; -С-3;
|
Лабораторная работа 4 «Качественные реакции на СО2 Тренинг
(выполнение тематических тестов)
|
|
12
|
Химические свойства гидроксидов: оснований и кислот.
|
Характеризовать: § химические свойства оснований и кислот. § качественные реакции на ионы
водорода и гидроксид-ионы
|
Беседа с применением опорных схем; -А-11; А-12; -В-4; -С-1;
|
Лабораторная работа 5 «Качественные реакции на ионы Н+ и
ОН-« Тренинг
|
|
13
|
Химические свойства солей. Взаимосвязь веществ. Выявлять
|
Характеризовать: § химические свойства средних солей; Объяснять: § взаимосвязь состава, строения и
свойств веществ § классификационные признаки изученных веществ и реакций.
|
Беседа с применением опорных схем -А-12; А-8; -С-1; С-3;
|
Групповая работа (умение аргументировать ответы)
|
|
14
|
Представления об органических веществах
|
Называть: - вещества по химическим формулам; Определять:
- принадлежность вещества к определенному классу;
|
Беседа с применением опорных схем; Тесты КИМа: -В-2;
|
Тренинг. Самоконтроль.
|
|
15
|
Химия и жизнь
|
Применять теоретические знания о свойствах веществ в
различных ситуациях
|
Беседа; Тесты КИМа: -А-13; -С-3
|
Практическая работа 4 «Решение ситуационных задач»
|
2.3.3 Анализ работ учащихся к ГИА по химии
После педагогического эксперимента по методике
подготовки учащихся к сдаче ГИА по химии было повторно проведено аналогичное
тестирование выявления уровня знаний по химии (Приложение №5).
Результаты повторного тестирования после внедрения
методики подготовки к сдаче ГИА по химии показали, что уровень знания по химии
значительно повысились.
Так, Иванов Айсен получил:
· В части А - 13 баллов (87% от части
А);
· В части В - 4 балла (50% от части В);
· В части С - 4 балла (40% от части С).
Общее количество баллов составляет 21 балл, в
процентах - 63,6%.
Николаев Вася получил:
· В части А - 12 баллов (80% от части
А);
· В части В - 6 баллов (75% от части
В);
· В части С - 3 балла (30% от части С).
Общее количество баллов составляет 21 балл, в
процентах - 63,6%.
· В части А - 15 баллов (100% от части
А)
· В части В - 7 баллов (87,5% от части
В);
· В части С - 4 балла (40% от части С).
Общее количество баллов составляет 26 балл, в
процентах - 78,7%.
Для сравнения уровня знаний до и после проведения
педагогического эксперимента методики подготовки учащихся к сдаче ГИА по химии
создадим диаграмму.

Рисунок 4. Сравнения уровня знаний по химии до и после
внедрения мероприятия
Так, у Иванова А. по 100-балльной шкале всего задания
уровень знания повысился на 18,1%, у Николаева В. - на 12,1%, у Поповой Н. -
15,1%.
Таким образом, в выше указанной диаграмме видно, что
после внедрения педагогического эксперимента методики подготовки учащихся к
сдаче ГИА по химии уровень знания у учеников школы значительно повысился.
итоговый аттестация экзаменационный химия
Выводы
. Анализ научной и научно-методической литературы показывает, что
определение соответствия уровня и качества подготовки выпускника требованиям
государственных образовательных стандартов (включая федеральный,
национально-региональный и другие компоненты) является формой государственного
контроля (оценки) освоения выпускниками основных общеобразовательных программ
основного общего и среднего (полного) общего образования.
. Определены методические условия подготовки учащихся к ГИА по
химии в малокомплектной сельской школе: образовательная среда, уровень знаний
учащихся, средства и формы обучения по химии и др.;
3. Разработана методика подготовки учащихся
малокомплектной сельской школы, нацеленные на активизацию и актуализацию
теоретических и практических знаний учащихся.
4. Выявлена эффективность использованной методики подготовки
учащихся к ГИА по химии. Количество баллов у Поповой Н. - 63,6 %, у Николаева
В. - 51,5%, а у Иванова А. - 45,5%.
Список использованной литературы
1. Аблесимов Н.Е. Синопсис химии:
Справочно-учебное пособие по общей химии - Хабаровск: Изд-во ДВГУПС, 2005. - 84
с.
2. Аблесимов Н.Е. Сколько химий
на свете? ч. 1. // Химия и жизнь - XXI век. - 2009. - № 5. - С. 49-52.
. Ахметов Н.С. Общая и
неорганическая химия. - 4 изд., испр. - Москва: Высшая школа, Издательский
центр «Академия», 2001. - С. 253-269. - 743 с.
. Бейдер Р. Атомы в молекулах.
Квантовая теория. М.: Мир, 2001. - 532 c
. Бердоносов С.С., Менделеева
Е.А. Химия 9 класс. Просвещение. 2008.
. Бор О., Моттельсон Б.
Структура атомного ядра. - В 2-х т. - М.: Мир, 1971-1977.
. Габриелян О.С. Решебник
«Химия. 9 класс».
. Габриелян О.С. Химия. 8
класс: учеб. для общеобразоват. учреждений/ О.С. Габриелян-17- изд., стереотип-
М.:Дрофа,2010
. Гузей Л.С., В.В. Сорокин,
Р.П. Суровцева. Химия. 9 класс: Учебник - 6-е изд., перераб. и доп. - М.:
Дрофа, 2002 г.
. Добротин Д.Ю. ГИА 2011.
Химия: тематические тренировочные задания: 9 класс. М.: Эксмо, 2010. - 160 с.
. Доронькин В.Н., Бережная
А.Г. Химия. 9 класс. Тематические тесты для подготовки к ГИА-9. 2-е изд.,
исправл. и доп. - Р н/Д: 2011. - 368 с.
. Егорова К.Е., Андреева М.П.,
Павлова М.С.,. Лазарева П.В, Нахова Н.А.. - Якутск: Изд-во ЯГУ, 2008. - 136
с.Лабораторно-практические работы по методике обучения химии в средней школе:
учебно-методическое пособие для студентов.
. Жамбулова М.Ш. Развитие
неорганической химии (Историко-методологический аспект). Алма-Ата, 1981.- 187
с.
. Контрольные измерительные
материалы ГИА-2012.
. Корощенко А.С. Химия.
Государственная итоговая аттестация (в новой форме). 9 класс Издательство:
Экзамен. Серия: ГИА. 9 класс. Типовые тестовые задания. 2011
. Кузнецова Н.Е., Титова И.М.,
Гара Н.Н. и др. / Химия 8 класс. Под ред. Кузнецовой Н.Е. / Издательство:
ВЕНТАНА-ГРАФ
. Лапустинский А. Ф. Очерки по
истории неорганической и физической химии в России. М.-Л., 1949
. Лидин Р.А., Молочко В.А.,
Андреева Л.Л., Цветков А.А. Основы номенклатуры неорганических веществ / Под
ред. Б.Д. Стёпина. - М: Химия, 1983. - 112 с.
. Минченков Е.Е., Журин А.А.,
Оржековский П.А. Химия 9 класс. / Издательство: Мнемозина 2011
. Мур Джон. Химия для чайников
= Chemistry For Dummies. - М.: «Диалектика», 2011. - 320 с
. Нахова Н.А. Химия. Часть 1.
2 изд., доп. учебное пособие. Якутск: изд-во Якутского госуниверситета, 2010. -
112 с.
. Нахова Н.А. Химия. Часть 2.
Учебное пособие. Якутск: изд.-полиграф. Комплекс СВФУ, 2011. - 133 с.
. Неорганическое
материаловедение в СССР. Под ред. И. В. Тананаева - Киев: Наукова думка, 1983.
- 720 с.
. Петров С.В. Глава 2.
Асептика и антисептика // Общая хирургия. - СПб.: Лань, 1999. - С. 672.
. Популярная библиотека
химических элементов. Т. 1,2. / Под ред. И. В. Петрянова-Соколова - М.: Наука,
1983. - 575 с., - 572 с.
. Радецкий А.М., Горшкова В.П.
Дидактические материалы по химиии для 8-9 класса -3-е изд. - М.: Просвещение,
2000.
. Реми Г. Курс неорганической
химии. Т. 1. М.: Изд-во иностранной ли-тературы, 1963. - 920 с.
. Реми Г. Курс неорганической
химии. Т. 2. М.: Мир, 1974. - 775 с.
. Савинкина Е.В., Логинова
Г.П. Химия 9 класс. / Издательство: Баласс. 2009.
. Хомченко И.Г. Сборник задач
и упражнений по химии для средней школы. 8-11 классы - М.: Новая волна, 2009
. Шрайвер Э. Неорганическая
химия. Т. 1,2. / Э. Шрайвер, П. Эткинс - М.: Мир, 2004. - 679 с., - 486 с.
. Энциклопедия неорганических
материалов / Под ред. И.М. Федорчен-ко. В 2-х т. - Киев: Укр. сов.
энциклопедия, 1977. - 1652 с.
. Электронный ресурс ФИПИ
. Электронный ресурс
Югюлятская СОШ
Приложение №1
Периодическая система химических элементов Менделеева
Приложение №2
Таблица растворимости солей, кислот и оснований в воде

Приложение №3
Электрохимический ряд напряжений металлов
|
Li
|
Cs
|
K
|
Ba
|
Ca
|
Na
|
Mg
|
Al
|
Zn
|
Fe
|
Co
|
Ni
|
Sn
|
Pb
|
H2
|
Cu
|
Ag
|
Hg
|
Pt
|
Au
|
|
-3,04
|
-3,01
|
-2,92
|
-2,90
|
-2,87
|
-2,71
|
-2,36
|
-1,66
|
-0,76
|
-0,44
|
-0,28
|
-0,25
|
-0,14
|
-0,13
|
0
|
+0,34
|
+0,80
|
+0,85
|
+1,28
|
+1,5
|
|
Li+
|
Cs +
|
K+
|
Ba2+
|
Ca2+
|
Na+
|
Mg2+
|
Al3+
|
Zn2+
|
Fe2+
|
Co2+
|
Ni2+
|
Sn2+
|
Pb2+
|
2 H
|
Cu2+
|
Ag+
|
Hg2+
|
Pt2+
|
Au3+
|
|
Восстановительная активность металлов (свойство отдавать
электроны) уменьшается, а окислительная способность их катионов (свойство
присоединять электроны) увеличивается в указанном ряду слева направо.
|
Приложение №4
Тестирование для диагностики уровня знаний
К каждому из заданий A1-A15 даны 4 варианта ответа, из которых только
один правильный. Номер этого ответа обведите кружком.
А1. Четыре электрона находятся во внешнем электронном слое атомов каждого
из химических элементов в ряду
1) C, Si, Sn
) O, Cl, I
) N, C, S
4) Mg, Be, Ca
А2. В каком ряду химических элементов усиливаются неметаллические
свойства соответствующих им простых веществ?
) алюминий →фосфор →хлор
) фтор →азот→углерод
) хлор →бром→иод
) кремний →сера → фосфор
А3. Какой вид химической связи в молекуле фтора?
) ионная
) ковалентная полярная
) ковалентная неполярная
) металлическая
А4. В каком соединении степень окисления азота равна +3?
) Na3N
) NH3
3) NH4Cl
) HNO2
А5. Вещества, формулы которых - ZnO и Na2SO4,
являются соответственно
) основным оксидом и кислотой
) амфотерным гидроксидом и солью
) амфотерным оксидом и солью
) основным оксидом и основанием
А6. Признаком протекания химической реакции между оксидом меди и
водородом является
) появление запаха
) изменение цвета
) выпадение осадка
) выделение газа
А7. Одинаковое число молей катионов и анионов образуется при полной
диссоциации в водном растворе 1 моль
) H2SO4
) (NH4)2S
) BaCl2
) CuSO4
А8. Газ выделяется при взаимодействии
1) MgCl2 и Ba(NO3)2
) Na2CO3 и CaCl2
3) NH4Cl и NaOH
) CuSO4 и KOH
А9. Не реагируют друг с другом
) хлор и водород
) кислород и кальций
) азот и вода
) железо и сера
А10. Оксид цинка реагирует с каждым из двух веществ:
) Na2O и H2O
) SiO2 и Ag
) NaOH и HCl
) HNO3 и O2
А11. В реакцию с соляной кислотой вступает
) нитрат серебра
) нитрат бария
) серебро
) оксид кремния
А12. Среди веществ: NaCl, Na2S, Na2SO4 -
в реакцию с раствором Cu(NO3)2 вступает(-ют)
1) только Na2S
) NaCl и Na2S
) Na2S и Na2SO4
4) NaCl и Na2SO4
А13. Верны ли суждения о безопасном обращении с химическими веществами?
А. Разбитый ртутный термометр и вытекшую из него ртуть следует выбросить
в мусорное ведро.
Б. Красками, содержащими соединения свинца, не рекомендуется покрывать
детские игрушки и посуду.
) верно только А
) верно только Б
) верны оба суждения
) оба суждения неверны
А14. В приборе, изображённом на рисунке, получают
) хлор
) аммиак
) кислород
) хлороводород
А15. Массовая доля серы в сульфате алюминия равна
) 28,1%
) 9,4%
) 64,0%
) 32,0%
При выполнении заданий B1, B2 из предложенного перечня ответов выберите
два правильных и обведите их номера. Цифры выбранных ответов запишите в
указанном месте без дополнительных символов.
В1. В ряду химических элементов: Al → Si → P - происходит
увеличение (усиление)
) числа протонов в ядрах атомов
) числа заполняемых электронных слоёв в атомах
) радиуса атомов
) металлических свойств
) степени окисления в высших оксидах
Ответ:
В2. Для этанола верны следующие утверждения:
) в состав молекулывходит один атом углерода
) атомыуглерода в молекуле соединеныдвойной связью
) являетсяжидкостью (н.у.), хорошо растворимой в воде
) вступает в реакцию со щелочными металлами
) сгорает с образованием угарного газа и водорода
Ответ:
При выполнении заданий B3, B4 к каждому элементу первого столбца
подберите соответствующий элемент из второго столбца. Выбранные цифры запишите
под соответствующими буквами таблицы. Цифры в ответе могут повторяться.
В3. Установите соответствие между схемой химической реакции и
веществом-восстановителем в ней.
Схема реакции Восстановитель
А) HCl + MnO2→ MnCl2
+ Cl2 + H2O 1) MnO2
Б) H2S
+ HClO3→ HCl + S + H2O 2) HCl
В) HCl
+ Al → AlCl3 + H2 3) HClO3
4) H2S
) Al
В4. Установите соответствие между названием вещества и реагентами, с
которыми это вещество может взаимодействовать.
Название вещества Реагенты
А) сера 1) CO2, Na2SO4(р-р)
Б) оксид цинка 2) HCl, NaOH(р-р)
В) хлорид алюминия 3) AgNO3(р-р), KOH(р-р)
4) H2SO4(конц.),О2
Для ответов на задания C1-C3 используйте отдельный лист. Запишите сначала
номер задания (С1, C2 или С3), а затем развёрнутый ответ к нему. Ответы
записывайте чётко и разборчиво.
С1. Дана схема превращений:
CaO → X →(Na2CO3) CaCO3
→ CO2
Напишите молекулярные уравнения реакций, с помощью которых можно
осуществить указанные превращения. Для второго превращения составьте
сокращённое ионное уравнение реакции.
С2. 170 г раствора нитрата серебра смешали с избытком раствора хлорида
натрия. Выпал осадок массой 8,61 г. Вычислите массовую долю соли в растворе
нитрата серебра.
С3. Для определения качественного состава неизвестного кристаллического
вещества белого цвета к его раствору добавили раствор гидроксида калия. При
этом образовался осадок. К другой части раствора исследуемого вещества добавили
раствор нитрата бария. Наблюдали образование нерастворимого в кислотах белого
осадка. Известно, что катион металла, который содержится в данном соединении,
входит также в состав хлорофилла, а сам металл ранее применялся в фотографии
для получения вспышки.
Определите состав и запишите название исходного вещества. Запишите два
уравнения реакций, которые были проведены в процессе определения качественного
состава неизвестного вещества.
Приложение №5
Тестирование для диагностики уровня знаний после внедрения мероприятия
А1. Химическому элементу 3-го периода VA-группы соответствует схема распределения электронов по
слоям:
) 2, 8, 5
) 2, 8, 3
) 2, 5
) 2, 3
А2. От кислотных к основным меняются свойства оксидов в ряду
1) CaO → SiO2→ SO3
) CO2→ Al2O3→
MgO
) SO3→ P2O5→ Al2O3
) Na2O → MgO → Al2O3
А3. Какой вид химической связи в молекуле аммиака?
) ковалентная неполярная
) ковалентная полярная
) металлическая
) ионная
А4. Такую же степень окисления, как и в SO2, сера имеет в
соединении
) K2SO4
) H2SO3
) (NH4)2S
) SO3
А5. Основным оксидом и кислотой, соответственно, являются
1) FeO, Ba(OН)2
) K2O, (NH4)2S
3) MgO, H2SO4
) SO2, HNO3
А6. К химическим явлениям относится процесс
) измельчения сахара до состояния пудры
) превращения воды в лед
) появления капель воды на крышке чайника
) горения свечи
А7. Наименьшее число ионов образуется в разбавленном растворе при полной
диссоциации 1 моль
) FeCl3
) Na2S
) KNO3
) BaCl2
А8. Сокращенному ионному уравнению Ba2+ + SO42- = BaSO4↓ соответствует левая часть уравнения химической
реакции
1) BaСl2 + H2SO4→
) BaCO3 + Na2SO4→
) BaO + SO3→
4) Ba + H2SO4→
А9. И литий, и железо при комнатной температуре реагируют с
) гидроксидом натрия
) водой
) серой
) соляной кислотой
А10. Химическая реакция возможна между
) оксидом фосфора (V) и
оксидом калия
) оксидом алюминия и водой
) оксидом кремния и соляной кислотой
) оксидом цинка и кислородом
А11. Раствор гидроксида бария не реагирует с
) железом
) оксидом серы(VI)
) сульфатом натрия
) фосфорной кислотой
А12. И нитрат аммония, и нитрат цинка могут взаимодействовать с
) гидроксидом калия
) раствором хлорида натрия
) разбавленным раствором серной кислоты
) железом
А13. Верны ли следующие суждения о правилах хранения витаминов и
предназначении моющих средств?
А. Хранение витаминов не требует строгого соблюдения указанных в
инструкции правил.
Б. Для удаления жирных пятен с поверхности посуды целесообразно
использовать моющие средства, имеющие щелочную среду.
) верно только А
) верно только Б
) верны оба суждения
) оба суждения неверны
А14. В лаборатории имеются следующие растворы реактивов:
А) NaOH
Б) фенолфталеин
В) K2SO4
Г) AgNO3
Д)
Al(NO3)3
Е) HCl
Ж)NaCl
Для установления качественного состава хлорида алюминия необходимо
воспользоваться реактивами, указанными под буквами:
) А и Г
) Б и Ж
) В и Д
) Е и Ж
А15. Массовая доля азота в нитрате цинка равна
) 7,4%
) 11,0%
) 14,8%
) 22,2%
В1. В ряду химических элементов Si - Ge - Sn
) увеличивается число электронных слоев в атомах
) уменьшается число протонов в ядрах атомов
) увеличивается значение электроотрицательности
) усиливается оснувный характер высших оксидов
) увеличивается число электронов во внешнем слое атомов
Ответ:
В2. Метан
) является составной частью природного газа
) относится к непредельным углеводородам
) хорошо растворяется в воде
) не реагирует с кислородом
) вступает в реакцию с хлором
Ответ:
В3. Установите соответствие между схемой превращения и изменением степени
окисления окислителя в ней.
Схема превращений изменение степени окисления окислителя
A) Cl2 + K2MnO4→ KMnO4
+ KCl 1) Э+6→Э+7
Б) NH4Cl
+ KNO3→ KCl + N2O + H2O 2) Э+5→Э+1
В) HI + FeCl3→ FeCl2+ HCl + I2
3) Э+3→Э+2
4) Э0→Э-1
) Э-1→Э0
В4. Установите соответствие между веществом и реагентами, с которыми оно
может вступать в реакцию.
ВЕЩЕСТВО РЕАГЕНТЫ) железо 1)
K2O, Mg
Б) оксид углерода(IV) 2) Na2SO4, HNO3
В) гидроксид натрия 3) HCl, O2
4) CuSO4,
Al(OH)3
С1. Дана схема превращений:
Cu → Cu(NO3)2→ X →(t°)
CuO
С2. После пропускания через раствор гидроксида калия 1,12 л углекислого
газа (н.у.) получили 138 г раствора карбоната калия. Вычислите массовую долю
соли в полученном растворе.
С3. На занятиях химического кружка учащиеся исследовали кристаллическое
вещество белого цвета. В результате добавления к нему гидроксида калия и
последующего нагревания полученной смеси выделился газ с резким специфическим
запахом, при горении которого образовался азот.
Определите состав исследуемого вещества и запишите его название.
Составьте 2 уравнения реакций, которые были проведены учащимися в процессе его
распознавания.
Приложение 6
Урок 1. Строение атома. Состав атомных ядер. Изотопы.
Цель: изучить строение атома, состав атомных
ядер, изотопы; развивать логическое мышление, способность к рефлексии и
познавательный интерес; формировать умение работать с книгой через групповую
работу, культуру общения в микрогруппе.
Ход урока.. ОРГАНИЗАЦИОННЫЙ ЭТАП.
Настроить ребят на познание нового.. ИЗУЧЕНИЕ НОВОГО
МАТЕРИАЛА
Атом - это частица вещества микроскопических размеров
и массы, наименьшая часть химического элемента, являющаяся носителем его
свойств.
Атом состоит из атомного ядра и электронов. Если число
протонов в ядре совпадает с числом электронов, то атом в целом оказывается
электрически нейтральным. В противном случае он обладает некоторым
положительным или отрицательным зарядом и называется ионом. В некоторых случаях
под атомами понимают только электронейтральные системы, в которых заряд ядра
равен суммарному заряду электронов, тем самым противопоставляя их электрически
заряженным ионам.
Ядро, несущее почти всю (более чем 99,9 %) массу
атома, состоит из положительно заряженных протонов и незаряженных нейтронов,
связанных между собой при помощи сильного взаимодействия. Атомы
классифицируются по количеству протонов и нейтронов в ядре: число протонов Z
соответствует порядковому номеру атома в периодической системе и определяет его
принадлежность к некоторому химическому элементу, а число нейтронов N -
определённому изотопу этого элемента. Число Z также определяет суммарный
положительный электрический заряд (Ze) атомного ядра и число электронов в
нейтральном атоме, задающее его размер.
Атомы различного вида в разных количествах, связанные
межатомными связями, образуют молекулы.
Субатомные частицы.
Хотя слово атом в первоначальном значении обозначало
частицу, которая не делится на меньшие части, согласно научным представлениям
он состоит из более мелких частиц, называемых субатомными частицами. Атом
состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также
нейтроны.
Электрон является самой лёгкой из составляющих атом
частиц с массой 9,11·10−31 кг, отрицательным зарядом и размером, слишком
малым для измерения современными методами. Протоны обладают положительным
зарядом и в 1836 раз тяжелее электрона (1,6726·10−27 кг). Нейтроны не
обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929·10−27
кг).
При этом масса ядра меньше суммы масс составляющих его
протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют
сравнимый размер, около 2,5·10−15 м, хотя размеры этих частиц определены
плохо.
В стандартной модели элементарных частиц как протоны,
так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с
лептонами, кварки являются одной из основных составляющих материи. И первые и
вторые являются фермионами. Существует шесть типов кварков, каждый из которых
имеет дробный электрический заряд, равный +2⁄3 или −1⁄3
элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон -
из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и
зарядах протона и нейтрона. Кварки связаны между собой сильными ядерными
взаимодействиями, которые передаются глюонами.
Электроны в атоме.
При описании электронов в атоме в рамках квантовой
механики обычно рассматривают распределение вероятности в 3n-мерном пространстве
для системы n электронов.
Электроны в атоме притягиваются к ядру, между
электронами также действует кулоновское взаимодействие. Эти же силы удерживают
электроны внутри потенциального барьера, окружающего ядро. Для того чтобы
электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от
внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для
этого необходимо.
Электронам, как и другим частицам, свойственен
корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по
орбитали, что неверно. Состояние электронов описывается волновой функцией,
квадрат модуля которой характеризует плотность вероятности нахождения частиц в
данной точке пространства в данный момент времени, или, в общем случае,
оператором плотности. Существует дискретный набор атомных орбиталей, которым
соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии.
Электрон может перейти на уровень с большей энергией, поглотив фотон. При этом
он окажется в новом квантовом состоянии с большей энергией. Аналогично, он
может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при
этом будет равна разности энергий электрона на этих уровнях (см.: постулаты
Бора). [Савинкина, Логинова, 2009]
Атомное ядро - центральная часть атома, в которой сосредоточена основная
его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет
химический элемент, к которому относят атом. Размеры ядер различных атомов
составляют несколько фемтометров, что в более чем в 10 тысяч раз меньше
размеров самого атома.
Атомное
ядро состоит из нуклонов - положительно заряженных протонов и нейтральных
нейтронов, которые связаны между собой при помощисильного взаимодействия.
Протон и нейтрон обладают собственным моментом количества движения (спином),
равным  <#"788923.files/image009.gif"> - это
число равно порядковому номеру элемента, к которому относится атом, в таблице
Менделеева. Количество протонов в ядре определяет структуру электронной
оболочки нейтрального атома и, таким образом, химические свойства
соответствующего элемента. Количество нейтронов в ядре называется его
изотопическим числом
<#"788923.files/image009.gif"> - это
число равно порядковому номеру элемента, к которому относится атом, в таблице
Менделеева. Количество протонов в ядре определяет структуру электронной
оболочки нейтрального атома и, таким образом, химические свойства
соответствующего элемента. Количество нейтронов в ядре называется его
изотопическим числом  . Ядра с одинаковым числом протонов и разным числом
нейтронов называются изотопами. Ядра с одинаковым числом нейтронов, но разным
числом протонов - называются изотонами. Термины изотоп и изотон используются
также применительно к атомам, содержащим указанные ядра, а также для
характеристики нехимических разновидностей одного химического элемента. Полное
количество нуклонов в ядре называется его массовым числом
. Ядра с одинаковым числом протонов и разным числом
нейтронов называются изотопами. Ядра с одинаковым числом нейтронов, но разным
числом протонов - называются изотонами. Термины изотоп и изотон используются
также применительно к атомам, содержащим указанные ядра, а также для
характеристики нехимических разновидностей одного химического элемента. Полное
количество нуклонов в ядре называется его массовым числом  (
( ) и приблизительно
равно средней массе атома, указанной в таблице Менделеева. Нуклиды с одинаковым
массовым числом, но разным протон-нейтронным составом принято называть
изобарами.
) и приблизительно
равно средней массе атома, указанной в таблице Менделеева. Нуклиды с одинаковым
массовым числом, но разным протон-нейтронным составом принято называть
изобарами.
1. Как и любая квантовая система, ядра могут находиться в
метастабильном возбуждённом состоянии, причём в отдельных случаях время
жизнитакого состояния исчисляется годами. Такие возбуждённые состояния ядер
называются ядерными изомерами. [Бор, Моттельсон. 1971-1977.]
Изотопы - разновидности атомов (и ядер) какого-либо химического элемента,
которые имеют одинаковый атомный номер, но при этом разные массовые числа.
Название связано с тем, что все изотопы одного атома помещаются в одно и то же
место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от
строения электронной оболочки, которая, в свою очередь, определяется в основном
зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его
массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все
изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом
нейтронов. Обычно изотоп обозначается символом химического элемента, к которому
он относится, с добавлением верхнего левого индекса, означающего массовое число
(например, 12C, 222Rn). Можно также написать название элемента с добавлением
через дефис массового числа (например, углерод-12, радон-222). Некоторые
изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Пример изотопов: 168O, 178O, 188O
- три стабильных изотопа кислорода.
III. ЗАКРЕПЛЕНИЕ
. Электронная формула внешнего энергетического
уровня атома кремния
А. 3s23p2 Б. 3s23p4 В. 4s24p2 Г. 4s24p4
. Порядковый номер элемента в Периодической
системе определяется:. Зарядом ядра атома. Б. Числом электронов в наружном слое
атома. . Числом электронных слоев в атоме. Г. Числом нейтронов в атоме.
. Электронная формула атома 1s22s22p63s23p2.
Химический знак и формула водородного соединения этого элемента
А. C и CH4 Б. О и Н2О В. Si и
SiH4 Г. S и H2S
. Пара элементов, имеющих сходное строение
внешнего и предвнешнего энергетических уровней:
А. В и Si. Б. S и Se. В. К и Са. Г. Мn и Fe.
. s-элементом является:
А. Барий. Б. Галлий. В. Америций. Г. Ванадий.
Урок 2. Неметаллы
Цель урока: продолжить формирование знаний по теме «Неметаллы: атомы и
простые вещества. Воздух. Кислород. Озон»; создать условия для усвоения
обучающимися знаний о неметаллах; ввести понятие электроотрицательности как
меры неметалличности; рассмотреть: различные примеры зависимости строения
атомов, свойств и применения неметаллов от их положения в ПСХЭ Д.И.Менделеева,
относительность понятий «металл» - «неметалл», особенности свойств неметаллов,
причины аллотропии; содействовать развитию познавательного интереса, внимания,
логического мышления через установление причинно-следственных связей «строение
вещества - свойства вещества - применение вещества», коммуникативные навыками,
способности к самостоятельному приобретению знаний.
Тип урока: формирование новых знаний и умений.
ХОД УРОКА.. ОРГАНИЗАЦИОННЫЙ МОМЕНТ
II. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА
Неметаллы - химические элементы с типично
неметаллическими свойствами, которые занимают правый верхний угол Периодической
системы. Расположение их в главных подгруппах соответствующих периодов
следующее:
Таблица 1
|
Группа
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
|
2-й период
|
B
|
C
|
N
|
O
|
F
|
Ne
|
|
3-й период
|
|
Si
|
P
|
S
|
Cl
|
Ar
|
|
4-й период
|
|
|
As
|
Se
|
Br
|
Kr
|
|
5-й период
|
|
|
|
Te
|
I
|
Xe
|
|
6-й период
|
|
|
|
|
At
|
Rn
|
Кроме того, к неметаллам относят также водород и
гелий.
Характерной особенностью неметаллов является большее
(по сравнению с металлами) число электронов на внешнем энергетическом уровне их
атомов. Это определяет их большую способность к присоединению дополнительных
электронов, и проявлению более высокой окислительной активности, чем у
металлов.
Неметаллы имеют высокие значения сродства к электрону,
большую электроотрицательность и высокий окислительно-восстановительный
потенциал.
Благодаря высоким значениям энергии ионизации
неметаллов, их атомы могут образовывать ковалентные химические связи с атомами
других неметаллов и амфотерных элементов. В отличие от преимущественно ионной
природы строения соединений типичных металлов, простые неметаллические
вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные
неметаллические простые вещества - фтор, хлор, кислород, азот, водород,
инертные газы, твёрдые - иод, астат, сера, селен, теллур, фосфор, мышьяк,
углерод, кремний, бор, при комнатной температуре в жидком состоянии существует
бром.
У некоторых неметаллов наблюдается проявление
аллотропии. Так, для газообразного кислорода характерны две аллотропных
модификации - кислород (O2) и озон (O3), у твёрдого
углерода множество форм - алмаз, астралены, графен, графан, графит, карбин,
лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры
(нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты,
а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе
встречаются азот, кислород и сера. Чаще неметаллы находятся в химически
связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты,
бораты. По распространённости в земной коре неметаллы существенно различаются.
Наиболее распространёнными являются кислород, кремний, водород; наиболее
редкими - мышьяк, селен, иод.. Закрепление
. Электронная конфигурация атома элемента
главной подгруппы VII группы 4-го периода Периодической системы:
A….3s23p63d104s24p4.
Б. ...3s23p5.
B….3s23р63d104s24р5. Г. ...3s23p63d104s24p3.
. Высший оксид и гидроксид элемента главной
подгруппы VI группы Периодической системы соответствуют общим формулам:
А. ЭО2 и Н2ЭО3. Б. Э2О5
и Н3ЭО4. В. Э03 и Н2ЭО4.
Г. Э2О7 и НЭО4
. Окислительные свойства усиливаются в ряду
элементов:
А. С-N-Р-As. Б. F-О-N-С. В. Si-С-N-О. Г. Р-Si-С-В.
. Ковалентная неполярная связь образуется в
соединении, формула которого:
А. СС14. Б. S8. В. КВг. Г. Н2О.
. Валентность и степень окисления азота в ионе
аммония соответственно равны:
А. Четыре и -4. Б. Три и -3. В. Четыре и -3. Г. Три и
+3.
Урок 3. Физические и химические явления. Химические реакции.
Цели: Формирование знаний о химических и физических явлениях;
способствовать развитию логического мышления; Воспитывать любовь к химии,
бережное отношение к природе.
Тип урока: изучение нового материала.
Ход урока.. Организационный момент.. Изучение нового материала
Человек, и все, что его окружает - живая и неживая природа непрерывно
изменяются. Вся живая и неживая природа состоит из веществ. Изменения,
происходящие с веществами называются явлениями.
Вещество может быть измельчено в порошок, расплавлено, растворено, вновь
выделено из раствора. При этом оно останется тем же самым веществом.
При испарении вода переходит в пар. Водяной пар - это вода в газообразном
состоянии. При охлаждении вода превращается в лед. Лед - это вода в твердом
состоянии. Мельчайшая частичка воды - это молекула воды. Жидкая вода, лед и пар
не разные вещества, а одно и то же вода в разных агрегатных состояниях.
Любой металл можно не только расплавить - перевести в жидкое состояние,
но и превратить в газ. Во внешней оболочке Солнца, где температура 60000С,
металлы находятся в газообразном состоянии.
Наоборот, газ путем охлаждения, может, переведен в жидкое и твердое
состояние. Например: кислород при обычных условиях бесцветный газ, а при
температуре - 1830 С переходит в жидкое состояние, жидкий кислород -
голубого цвета, при температуре - 2180 С кислород переходит в
твердое состояние - синего цвета.
Во всех этих явлениях образование других веществ не происходит.
Явления, при которых не происходит, превращение одних веществ в другие
называются физическими.
Возьмем бумагу - белое твердое вещество. Разорвем бумагу на клочки, что
происходит? Да, нечего, бумага не изменяется, изменился только форма, размер.
Что происходит если сжечь бумагу? Бумага превращается в пепел.
Возьмем пищевую соду, добавим уксус, что наблюдаем? Шипение, выделение
газа. Во всех случаях мы наблюдаем превращение одних веществ в другие. Ребята,
как вы думаете, из продуктов реакции снова исходные вещества мы можем получить?
Явления, при которых из одних веществ образуются другие вещества,
называются химическими.
Химические явления называются химическими реакциями.. Закрепление
Признаки химических реакций.
1. Изменение цвета
2. Появление запаха
. Выделение газа
. Образование осадка
. Излучение цвета
. Выделение или поглощение теплоты.
Условия, необходимые для возникновения химических реакций.
1. Соприкосновение реагирующих веществ.
2. Нагревание.
а) нагревание только в начале реакции;
б) от начала до конца реакции;
в) без нагревания.
Какие из перечисленных явлений следует отнести к химическим?
1. Образование облаков
2. Подгорание пищи
. Засахаривания варенья
. Прокисание молока
. Протухание куриного яица
. Образование снежинок
. Горение бензина
. Испарение духов.
Урок 4. Кристаллические решетки
Цель урока: Создание условий для формирования информационной и
коммуникативной компетенций; формирование представлений о типах кристаллических
решеток; установление связи между типом кристаллической решётки и свойствами
вещества; обобщить знания о типах химической связи, валентности. Закрепить
навыки составления схем строения химических соединений; совершенствовать умение
определять вещества молекулярного и немолекулярного строения; ознакомить с
типами кристаллических решеток; научить определять свойства веществ в
зависимости от типа кристаллических решёток.
Тип урока: Комбинированный урок
Оборудование: учебник: Таблицы: «Периодическая система химических
элементов Д.И. Менделеева», Виды химической связи», «Типы кристаллических решеток».
Ход урока. Организационный момент.. Изучение нового материала
Ионные кристаллические решётки
Ионными называют кристаллические решетки, в узлах которых находятся ионы
вещества. Сложные вещества, состоящие из элементов с сильно отличающейся
электроотрицательностью, имеют ионный тип связи между частицами (KF, CaF2,
NaCl, CaCl2, и др.). Ионные кристаллические решётки имеют соли,
некоторые оксиды и гидроксиды.
Связи между ионами в кристалле очень прочные, поэтому ионным соединениям
свойственны высокие температуры плавления, малая летучесть, большая твёрдость.
По прочности ионные решётки уступают атомным, но превышают молекулярные.
Атомные кристаллические решётки
Атомными называют кристаллические решётки, в узлах которых находятся
отдельные атомы, которые соединены очень прочными ковалентными связями. В
природе встречается немного веществ с атомной кристаллической решёткой. К ним
относятся кристаллические бор, кремний и германий, также сложные вещества,
например, кварц и горный хрусталь в состав которых входит SiO2. Большинство
веществ с атомной кристаллической решёткой имеют высокие температуры плавления,
обладают повышенной твёрдостью (алмаз - самый твёрдый природный материал),
практически нерастворимы. На рисунке 2 изображена кристаллическая решётка алмаза.
Молекулярные кристаллические решётки
Молекулярными называют кристаллические решётки, в узлах которых
располагаются молекулы. Химические связи в этих молекулах ковалентные, как
полярные, так и неполярные. Атомы внутри молекул связаны очень прочно, но между
молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества
с молекулярной кристаллической решёткой имеют малую твёрдость, плавятся при
низкой температуре, летучие, при обычных условиях находятся в газообразном или
жидком состоянии. Веществ с молекулярной кристаллической решёткой известно
очень много. Это твёрдые водород, хлор, благородные газы, хлороводород,
сероводород, «сухой лёд» - оксид углерода (IV), лёд (твёрдая вода), йод и
другие. Молекулярную кристаллическую решётку имеют большинство органических
веществ.
Металлические кристаллические решётки
Кристаллические решётки, образуемые металлами, называются металлическими.
Кристаллы металлов строятся из атомов элементов, которые имеют один, два или
три внешних (валентных) электрона (редко больше). Электроны утрачивают свою
связь с отдельными атомами и становятся общими для положительно заряженных
частиц. В узлах металлических решёток находятся атомы и положительные ионы
металлов, а валентные электроны передвигаются между ними в различных
направлениях. Совокупность свободных электронов иногда называют электронным
газом. Такое строение решётки обусловливает большую электропроводность,
теплопроводность и высокую пластичность (ковкость) металлов. Температура
плавления и твердость металлов различны, изменяются в широких пределах. Из
первых 104 элементов 75 образуют металлические решетки. Металлы имеют наиболее
плотно построенные решетки.
Кристаллы, минералы (дополнительный материал)
Кристаллы - твёрдые тела, характеризующиеся закономерным периодическим
расположением частиц (молекул, атомов или ионов) в пространстве. Строгая
периодичность расположения частиц в кристалле определяет почти все основные
законы и свойства кристаллов.
Важной особенностью кристаллов является их симметрия-свойство геометрических
фигур в различных положениях приходить в совмещение с первоначальным
положением. Симметрия кристаллов положена в основу их классификации.
Вследствие того что в структуре кристалла в разных направлениях различны
расстояния и силы связи между частицами, большинство свойств кристалла
анизотропно, т. е. различно в разных направлениях, но одинаково в направлениях,
симметричных друг другу. Анизотропной являются и скорость роста кристалла. Если
бы скорость роста была изотропной, кристалл вырастал бы в форме шара. Именно
вследствие того, что скорости роста кристалла различны в разных направлениях и
эти различия симметричны в пространстве, кристалл вырастает в форме
симметричных правильных многогранников. Анизотропность проявляется и в том, что
при воздействии на кристалл какого-либо растворителя скорость химических
реакций различна по различным направлениям.
Аморфные же вещества характеризуются изотропностью (равносвойственностью)
- физические свойства по всем направлениям проявляются одинаково.
Всякий кристалл есть однородное, но в то же время и анизотропное тело.
Наиболее известным внешним признаком кристалла является геометрическая
форма, которую кристалл принимает при образовании в соответствующих условиях.
Все кристаллы одного вещества имеют одну и ту же структуру при одинаковых
условиях кристаллизации (температура, давление). При изменении внешних условий
одно и то же вещество может кристаллизоваться в разных кристаллических решетках
и обладать весьма различными свойствами. Это явление называется полиморфизмом.
Например, известны две полиморфные модификации углерода - алмаз и графит.
Кристаллы одного и того же вещества могут отличаться друг от друга своей
величиной, при неравномерном росте кристаллы получаются сплющенными, вытянутыми
и т.д., но неизменными остаются углы между соответственными гранями растущего
кристалла. Эта особенность кристаллов известна как закон постоянства углов.
Поэтому измерением углов можно доказать принадлежность исследуемого кристалла к
тому или иному веществу. Закон постоянства углов граней объясняется тем, что
все кристаллы одного вещества имеют одну и ту же структуру.
При нагревании кристаллического тела температура повышается до
определенного предела; при дальнейшем же нагревании вещество начинает
плавиться, а температура некоторое время остается постоянной, так как все тепло
идет на разрушение кристаллической решетки. Температура, при которой начинается
плавление, называется температурой плавления.
Аморфные вещества в отличие от кристаллических не имеют четко выраженной
температуры плавления. По этому признаку легко отличить кристаллические
вещества от аморфных.
Минералы - твёрдые, как правило, тела, относительно однородные по составу
и свойствам, возникшие как продукт природных физико-химических процессов,
протекающих на поверхности и в глубинах Земли, Луны и других планет. Минералы
обычно представляют собой составную часть горных пород, руд и метеоритов.
В основу классификации минералов положены различия в типах химических
соединений и кристаллических структур. Известно около 3000 минеральных видов.
Лишь немногие минералы являются простыми телами; таковы, например, алмаз,
графит, самородные Fe, Ni, Pt, Ir, Rh, Ru, Os, Cu, Aq, Hq, Pb, S, As, Sb. Bi,
Pd, Au. В подавляющем большинстве минералы состоят из химических соединений.
Содержание различных минералов в исследованной части земной коры (в
вес.%):
Силикаты...........................................................................................около
75
Оксиды и гидроксиды (в том числе 12,6%
SiO2).............................. ок. 17
Карбонаты.............................................................................................ок.
1,7
Сульфиды,
сульфаты.....................................................................ок.
3,0-4,0
Самородные элементы........................................................................
ок. 0,1
Обычно в природе минералы распространены в виде зёрен неправильной формы;
хорошо образованные кристаллы, ограниченные естественными гранями, встречаются
сравнительно редко. Чаще всего минералы встречаются в виде множества сросшихся
кристаллических зёрен - минеральных агрегатов.
Области применения минералов в народном хозяйстве чрезвычайно широки и
обусловлены их свойствами. Используется около 15% всех минеральных видов.
Минералы служат источником всех металлов (руды черных и цветных металлов,
рудных и рассеянных элементов) и других химических элементов (горно-химическое
сырье), строительных материалов, природных красителей; ряд минералов является
драгоценными и поделочными камнями.
III. Закрепление
. Формула вещества с ионной связью:
А. НС1 Б. КВг В. Р4. Г. СН3ОН.
. Вещество с металлической связью:
А. Оксид калия. В. Кремний. Б. Медь. Г. Гидроксид
магния.
. Химическая связь в молекуле NH3
А. ионная Б. ковалентная полярная В. металлическая Г.
Ковалентная неполярная
. Число общих электронных пар в молекуле
азота:
А. Одна. Б. Две. В. Три. Г. Четыре.
. Полярность химической связи уменьшается в
ряду соединений, формулы которых:
А. С12, H2S, CO2.
Б. NH3, PH3, SO2. В. НС1, HBr, HI. Г. ВН3,
NH3, HF.
Урок 5. Степень окисления
Цели урока: Обобщить и систематизировать знания учащихся о видах
химической связи. Уметь определять вид химической связи и тип кристаллической
решеток; дать первоначальное понятие о степени окисления; уметь определить
степени окисления элементов.. Организационный момент
II. Изучение нового материала
Степень окисления (окислительное число, формальный заряд) -
вспомогательная условная величина для записи процессов окисления,
восстановления и окислительно-восстановительных реакций, численная величина
электрического заряда, приписываемого атому в молекуле в предположении, что
электронные пары, осуществляющие связь, полностью смещены в сторону более
электроотрицательных атомов.
Представления о степени окисления положены в основу классификации и
номенклатуры неорганических соединений.
Степень окисления соответствует заряду иона или
формальному заряду атома в молекуле или в формульной единице, например:

Степень окисления указывается сверху над символом элемента.
В отличие от указания заряда иона, при указании степени окисления первым
ставится знак, а потом численное значение, а не наоборот:
 - степень окисления,
- степень окисления,
 - заряды.
- заряды.
Степень окисления атома в простом веществе равна нулю,
например:
Алгебраическая сумма степеней окисления атомов в
молекуле всегда равна нулю:


Понятие степени окисления вполне применимо и для
нестехиометрических соединений (КС8, Mo5Si3, Nb3B4 и др.). Например в известной
реакции обжига пирита:
FeS2 +11O2 = 2Fe2O3
+ 8SO2,
удобнее всего принять в исходном соединение степень
окисления у железа +3 (хотя реально атом железа смещает от себя 2 электрона, то
есть степень окисления железа +2), а у серы −3/2 (!), что совсем не
противоречит определению степени окисления, как условной единицы и позволяет
так же просто, как и в случае других окислительно-восстановительных процессов,
уравнять реакцию.Суммарная степень окисления атомов в молекуле всегда равна
нулю.
Следует помнить, что степень окисления является сугубо условной
величиной, не имеющей физического смысла, но характеризующей образование
химической связи межатомарного взаимодействия в молекуле.
Степень окисления в ряде случаев не совпадает с валентностью. Например, в
органических соединениях углерод всегда четырёхвалентен, а степень окисления
атома углерода в соединениях метана CH4, метилового спирта CH3OH,
формальдегида HCOH, муравьиной кислоты HCOOH и диоксида углерода CO2,
соответственно, равна −4, −2, 0, +2 и +4.
Степень окисления зачастую не совпадает с фактическим числом электронов,
которые участвуют в образовании связей. Обычно это молекулы с различными
электрондефицитными химическими связями и делокализацией электронной плотности.
Например, в молекуле азотной кислоты степень окисления центрального атома азота
равна +5, тогда как формальная валентность - 4, а координационое число - 3. В
молекуле озона, имеющей сходное с SO2 строение, атомы кислорода
характеризуется нулевой степенью окисления.
Истинные заряды атомов в соединениях, определённые экспериментальным
путём, также не совпадают со степенями окисления этих элементов. Например,
заряды атомов водорода и хлора в молекуле хлороводорода HCl, в
действительности, равны соответственно +0,17 и −0,17, хотя их степени
окисления в этом соединении равны +1 и −1, а в кристаллах сульфида цинка
ZnS заряды атомов цинка и серы равны соответственно +0,86 и −0,86, вместо
степеней окисления +2 и −2.. Закрепление
Рассчитайте степень окисления хлора в веществах
. KCl а) 1,б)+1 в)0
. KClO3 а)+5, б)+3,в) 0
. NaClO а) -2, б)+1, в)-1
. Cl2 а) 0, б)+1,в) -1
. AlCl3 а)+3,б)+1, в) -1
Урок 6. Соли, классификация, физические и химические свойства.
Цель: сформировать знания учащихся о солях как классе неорганических
соединений; развивать у учащихся способность легко различать формулы оксидов,
оснований, кислот и солей; привести в систему знания учащихся о классификации
солей; познакомить со свойствами и применением солей; развить умения и навыки
работы с лабораторным оборудованием и химическими реактивами; правильно
оформлять результаты опытов, составлять уравнения реакций; развивать умения
наблюдать и делать выводы.. Организационный момент
II. Изучение нового материала
Соли - это сложные вещества, которые в водных растворах диссоциируют на
катионы металлов и анионы кислотных остатков. ИЮПАК определяет соли как
химические соединения, состоящие из катионов и анионов. Ещё одно определение
солями называет вещества, которые могут быть получены при взаимодействии кислот
и оснований с выделением воды.
Кроме катионов металлов в солях могут находиться катионы аммония NH4+,
фосфония PH4+ и их органические производные, а также комплексные катионы и т. д.
Анионами в солях выступают анионы кислотного остатка различных кислот Брёнстеда
- как неорганических, так и органических, включая карбанионы и комплексные
анионы.
Если рассматривать соли как продукты протонов в кислотах или
гидроксогрупп в основаниях, то можно выделить следующие типы солей:
· Средние (нормальные) соли - продукты замещения всех катионов
водорода в молекулах кислоты на катионы металла (Na2CO3,
K3PO4).
· Кислые соли - продукты частичного замещения катионов водорода
в кислотах на катионы металла (NaHCO3, K2HPO4).
Они образуются при нейтрализации основания избытком кислоты (то есть в условиях
недостатка основания или избытка кислоты).
· Основные соли - продукты неполного замещения гидроксогрупп
основания (OH-) кислотными остатками ((CuOH)2CO3).
Они образуются в условиях избытка основания или недостатка кислоты.
По числу присутствующих в структуре катионов и анионов выделяют следующие
типы солей:
· Простые соли - соли, состоящие из одного вида катионов и
одного вида анионов (NaCl)
· Двойные соли - соли, содержащие два различных катиона (KAl(SO4)2·12
H2O).
· Смешанные соли - соли, в составе которых присутствует два
различных аниона (Ca(OCl)Cl).
Также различают гидратные соли (кристаллогидраты), в состав которых
входят молекулы кристаллизационной воды, например, Na2SO4·10
H2O, и комплексные соли, содержащие комплексный катион или
комплексный анион (K4[Fe(CN)6], Cu(NH3)4](OH)2.
Внутренние соли образованы биполярными ионами, то есть молекулами, содержащими
как положительно заряженный, так и отрицательно заряженный атом.
Названия солей, как правило, связаны с названиями соответствующих кислот.
Поскольку многие кислоты в русском языке носят тривиальные, или традиционные,
названия, подобные названия (нитраты, фосфаты, карбонаты и др.) также
сохраняются и для солей.
Традиционные названия солей состоят из названий анионов в именительном
падеже и названий катионов в родительном падеже. Названия анионов строятся на
основе русских или латинских названий кислотообразующих элементов. Если
кислотообразующий элемент может иметь одну степень окисления, то к его названию
добавляют суффикс -ат:32- - карбонат,32-
- германат.
Если кислотообразующий элемент может принимать две степени окисления, то
для аниона, образованного этим элементом в более высокой степени окисления,
применяют суффикс -ат, а для аниона с элементов в меньшей степени окисления -
суффикс -ит:42- - сульфат,32- -
сульфит.
Если элемент может принимать три степени окисления, то для высшей,
средней и низшей степени окисления используют соответственно суффиксы -ат, -ит
и суффикс -ит с приставкой гипо-:3- - нитрат,2-
- нитрит,22- - гипонитрит.
Наконец, в случае элементов, принимающих четыре степени окисления, для
высшей степени окисления применяют приставку пер- и суффикс -ат, далее (в
порядке понижения степени окисления) суффикс -ат, суффикс -ит и суффикс -ит с
приставкой гипо-:- - перхлорат,3- - хлорат,2-
- хлорит,- - гипохлорит[9].
Приставки мета-, орто-, поли-, ди-, три-, пероксо- и т. п., традиционно
присутствующие в названиях кислот, сохраняются также и в названиях анионов.
Названия катионов соответствуют названиям элементов, от которых они
образованы: при необходимости указывается число атомов в катионе (катион
диртути(2+) Hg22+, катион тетрамышьяка(2+)
As42+) и степень окисления атома, если она переменная.
Названия кислых солей образуются путём добавления приставки гидро- к
названию аниона. Если на один анион приходится больше одного атома водорода, то
его количество указывают при помощи умножающей приставки (NaHCO3 -
гидрокарбонат натрия, NaH2PO4 - дигидрофосфат натрия).
Аналогично, для образования названий основных солей используются приставки
гидроксо- ((FeOH)NO3 - гидроксонитрат железа(II)).
Кристаллогидратам дают названия, добавляя слово гидрат к традиционному
или систематическому названию соли (Pb(BrO3)2·H2O
- гидрат бромата свинца(II), Na2CO3·10 H2O -
декагидрат карбоната натрия). Если известна структура кристаллогидрата, то
может применяться номенклатура комплексных соединений ([Be(H2O)4]SO4
- сульфат тетрааквабериллия(II)).
Для некоторых классов солей существуют групповые названия, например,
квасцы - для двойных сульфатов общего вида MIMIII(SO4)2·12
H2O, где MI - катионы натрия, калия, рубидия, цезия, таллия или
аммония, а MIII - катионы алюминия, галлия, индия, таллия, титана, ванадия,
хрома, марганца, железа, кобальта, родия или иридия.
Для более сложных или редких солей применяются систематические названия,
образующиеся по правилам номенклатуры комплексных соединений. Согласно данной
номенклатуре, соль подразделяется на внешнюю и внутреннюю сферы (катион и
анион): последняя состоит из центрального атома и лигандов - атомов, связанных
с центральным атомом. Название соли формируют следующим образом. Вначале
записывают название внутренней сферы (аниона) в именительном падеже, состоящее
из названий лигандов (приставок) и центрального элемента (корня) с суффиксом
-ат и указанием его степени окисления. Затем к названию добавляют названия
атомов внешней сферы (катионов) в родительном падеже.3 -
триоксоборат(III) лития2Cr2O7 -
гептаоксодихромат(VI) натрия4 - тетраоксосульфат(VI) водорода-натрия
Номенклатура солей бескислородных кислот.
Для образования названий солей бескислородных кислот пользуются общими
правилами составления названий бинарных соединений: применяются либо
универсальные номенклатурные правила с указанием числовых приставок, либо
способ Штока с указанием степени окисления, причём второй способ является
предпочтительным.
Названия галогенидов составляются из названия галогена с суффиксом -ид и
катиона (NaBr - бромид натрия, SF6 - фторид серы(VI), или
гексафторид серы, Nb6I11 - ундекаиодид гексаниобия).
Кроме того, существует класс псевдогалогенидов - солей, которые содержат анионы
с галогенидоподобными свойствами. Их названия образуются подобным образом
(Fe(CN)2 - цианид железа(II), AgNCS - тиоцианат серебра(I)).
Халькогениды, содержащие в качестве аниона серу, селен и теллур, называют
сульфидами, селенидами и теллуридами. Сероводород и селеноводород могут
образовывать кислые соли, которые называют гидросульфидами и гидроселенидами
соответственно (ZnS - сульфид цинка, SiS2 - дисульфид кремния, NaHS -
гидросульфид натрия). Двойные сульфиды называют, указывая два катиона через
дефис: (FeCu)S2 - дисульфид железа-меди.
Как правило, соли представляют собой кристаллические вещества с ионной
кристаллической решёткой. Например, кристаллы галогенидов щелочных и
щёлочноземельных металлов (NaCl, CsCl, CaF2) построены из анионов,
расположенных по принципу плотнейшей шаровой упаковки, и катионов, занимающих
пустоты в этой упаковке. Ионные кристаллы солей могут быть построены также из
кислотных остатков, объединённых в бесконечные анионные фрагменты и трёхмерные
каркасы с катионами в полостях (силикаты). Подобное строение соответствующим
образом отражается на их физических свойствах: они имеют высокие температуры плавления,
в твёрдом состоянии являются диэлектриками.
Известны также соли молекулярного (ковалентного) строения (например,
хлорид алюминия AlCl3). У многих солей характер химических связей
является промежуточным между ионным и ковалентным.
Особый интерес представляют ионные жидкости - соли с температурой
плавления ниже 100 °С. Кроме аномальной температуры плавления ионные жидкости
имеют практически нулевое давление насыщенного пара и высокую вязкость. Особые
свойства этих солей объясняются низкой симметрией катиона, слабым
взаимодействием между ионами и хорошим распределением заряда катиона.
Важным свойством солей является их растворимость в воде. По данному
критерию выделяют растворимые, мало растворимые и нерастворимые соли.
Диссоциация в водных растворах.
При растворении в воде соли полностью или частично диссоциируют на ионы.
Если диссоциация происходит нацело, то соли являются сильными электролитами,
иначе - слабыми. Примером типичных сильных электролитов могут служить соли
щелочных металлов, которые в растворе существуют в виде сольватированных ионов.
Несмотря на то, что широко распространена теория, утверждающая, что соли в
водном растворе диссоциируют полностью, в реальности для большинства солей
наблюдается частичная диссоциация, например, 0,1 M раствор FeCl3
содержит лишь 10 % катионов Fe3+, а также 42 % катионов FeCl2+,
40 % катионов FeCl2+, 6 % катионов FeOH2+ и 2 % катионов
Fe(OH)2+.
Гидролиз солей.
Некоторые соли в водном растворе способны подвергаться гидролизу. Данная
реакция протекает обратимо для солей слабых кислот (Na2CO3)
или слабых оснований (CuCl2), и необратимо - для солей слабых кислот
и слабых оснований (Al2S3).. Закрепление
. Среда водного
раствора хлорида алюминия) щелочная) кислая) нейтральная) слабощелочная
. Щелочную среду имеет
водный раствор) сульфата алюминия) карбоната калия) сульфата
натрия
. Кислую среду имеет
водный раствор) хлорида железа (III)) карбонат калия) силикат
натрия
. Лакмус краснеет в
растворе соли) FeSO4) KNO3) NaCl) Na2CO3
. Фенолфталеин
приобретёт малиновую окраску в растворе) сульфата меди (II)) хлорида
калия) карбоната натрия) нитрата бария
Урок 7. Электролитическая
диссоциация
Цель урока: изучить сущность
процесса электролитической диссоциации. Показать огромное практическое значение
растворов и процессов растворения в жизни человека, в окружающей природе, быту
и технике. Закрепить практические умения учащихся. Развивать умения
анализировать химический эксперимент, делать выводы. Развивать интерес к
предмету, к химическому экспериментированию. Прививать навыки самостоятельной
работы воспитывать гордость за русских ученых.
Ход урока.. Организационный
момент
II. Изучение нового
материала
Растворы. Растворение -
физико-химический процесс.
Что такое раствор? Это
однородная система, состоящая из растворителя и частиц растворенного в нем
вещества, и продуктов их взаимодействия. Какие вещества являются
растворителями? Вода, спирт, бензин и т.д. растворы и процессы растворения
имеют огромное значение в жизни человека в окружающей природе, быту и технике.
Опыт «Растворение серной
кислоты в воде» выделяется тепло. В результате гидратации, а это взаимодействие
молекул веществ с молекулами воды, выделяется больше энергии, чем ее тратится
на разрушение кристаллов вещества.
Опыт «Растворение аммиачной
селитры в воде». Поглощается тепло.
Опыт «Растворение поваренной
соли в воде» внешних изменений нет.
Вспомним признаки химических
реакций. Изменение окраски, выделение газа, выпадение осадка, выделение или
поглощение тепла. Значит растворение физико-химический процесс. Такое объяснение
сущности процесса растворения было впервые теоретически обосновано великим
русским ученым Д.И.Менделеевым в гидратной теории растворов.
Электролиты. Неэлектролиты.
Из курса физики вы знаете,
что растворы проводят электрический ток. Опыты с использованием прибора для
определения электропроводности. Раствор сахара не проводит электрический ток.
Вещества, растворы которых не проводят электрический ток, называются
неэлектролитами. Это спирт, глюкоза, глицерин и т.д. и так раствор соли
проводит ток. Вещества, растворы которых проводят электрический ток, называются
электролитами. Это растворы солей, щелочей и кислот. Почему растворы проводят
электрический ток?
Теория электролитической
диссоциации.
Шведский ученый Сванте
Аррениус, изучая электропроводность различных веществ, пришел в 1877 году к
выводу, что причиной электропроводности является наличие в растворе ионов
которые образуются при растворении электролитов в воде. Процесс распада
электролита на ионы называется электролитическая диссоциация. Аррениус
придерживался физической теории растворов и считал, что в растворах находятся
ионы. В отличие от него русские химики И.А.Каблуков и В.А.Кистяковский
применили химическую теорию Д.И.Менделеева и доказали, что в растворе находятся
не свободные ионы а гидратированные т.е. «Одетые в шубку» из молекул воды.
Молекулы - диполь (два полюса). Угол между атомами водорода равен 104,5 0С.
Электролитическая диссоциация хлорида натрия на гидратированные ионы.
Последовательность процесса:
1. Ориентация молекул воды около ионов кристалла.
2. Гидратация (взаимодействие) молекул воды с ионами поверхностного
слоя кристалла
. Диссоциация (распад) кристалла электролита на ионы.
Свойства гидратируемых ионов отличаются от свойств негидратируемых ионов.
Опыт «Растворение безводного сульфата меди в воде» Cu2+ белый в безводном сульфате меди CuSO4 , и голубой Cu2+ nH2O, когда гидратирован. Обобщим сведения об электролитической
диссоциации в виде основных положений.
Электролиты - это вещества которые при растворении в воде или в расплавленном
состоянии распадаются на ионы.
Ионы - это атомы или группы атомов обладающие положительным (катионы) или
отрицательным (анионы) зарядом.
1. Ионы отличаются от атомов, как по строением, так и по свойствам.
Схема строения атома натрия +11Na0 2e, 8e, 1e. Атомы натрия легко отдают наружные электроны, поэтому
химически активны: окисляются на воздухе, реагируют с водой и т.д.
Схема строения иона натрия +11Na0 2e, 8e ионы натрия не отдают электроны,
поэтому не могут окисляться и с водой не реагируют.
В растворе и расплаве электролита ионы движутся хаотически. Под действием
электрического тока положительно заряженные ионы (катионы) движутся к катоду, а
отрицательно заряженные анионы к аноду.
Диссоциация кислот, солей и основания.
По характеру образующих ионов различают три типа электролитов: кислоты,
основания, соли.
Кислоты - это электролиты которые при диссоциации образуют катионы
водорода и анионы кислотного остатка.
HCl=H++Cl- 3=H++NO3-2SO4=2H++SO42- запись на доске
Все кислоты образуют катионы водорода и общие свойства кислот обусловлены
именно катионами водорода (кислый вкус, изменение цвета индикатора).
Основания - это электролиты, которые при диссоциации образуют катионы
металла и анионы гидрокса групп.
NaOH=Na++OH-
Ca(OH)2=Ca2++2OH- запись на доске
Все общие свойства оснований (это мылкость на ощупь, изменение окраски
индикатора) обусловлены гидроксид ионами.
Соли - это электролиты которые при диссоциации образуют катионы металла
(или аммония NH4+) и анионы кислотных остатков:
K3PO4=3K++PO43-
NH4NO3=NH4++NO3- запись на доске
Свойства солей определяется как катионами, так и анионами.
Свойства кислот, оснований и солей с точки зрения электролитической
диссоциации.
Таблица 1
|
Электролиты
|
Характерные общие ионы
|
Характерные свойства
|
|
Кислоты
|
H+
|
Действуют на индикаторы и реагируют с ионами ОН- с
образованием воды Н++ОН- =Н2О
|
|
Основания
|
ОН-
|
Действуют на индикаторы и реагируют с ионами Н+ с
образованием воды: ОН- +Н+=Н2О
|
|
Соли
|
Общих ионов нет
|
Отсутствуют общие свойства обусловленные наличием общих
ионов
|
III. Закрепление
1. Распад электролита на ионы при растворении или расплавлении
называется:
А) электролитическая диссоциация
Б) электролиз
В) электролит
. Вещества распадающиеся на ионы в растворе или расплаве называются:
А) неэлектролиты
Б) электролиты
В) ионы
. Лакмус в кислотах приобретает окраску
А) синюю
Б) красную
В) желтую
. При растворении в воде хлороводородной кислоты образуются ионы:
А) Н+
Б) S2-
В) Cl-
Г) OH-
5. Соли это:
А) соленые вещества
Б) соединения серы
В) электролиты диссоциирующие с образование ионов металлов и кислотных
остатков