Реакції відновлення у біологічних системах
ДЕРЖАВНИЙ
ВИЩИЙ НАВЧАЛЬНИЙ ЗАКЛАД
"ЗАПОРІЗЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ"
МІНІСТЕРСТВА ОСВІТИ І НАУКИ
Індивідуальна
робота
з
дисципліни "біоорганічна хімія"
на
тему "Реакції відновлення у біологічних системах"
Виконав:
Безкоровайний Д. О.
Перевірив:
доцент кафедри біохімії
Завгородній М.П.
ЗАПОРІЖЖЯ
2013
Зміст
1. Реакції відновлення в біоорганічній хімії
2. Коферменти (відновники) які беруть участь у
окисно-відновних реакціях в біологічних системах
2.1 Окислювально-відновні коферменти
2.2 НАДН
2.3 НАДФ • H
2.4 Флавінаденіндинуклеотид (ФАДН2)
3. Реакції відновлення у складі окисно-відновних
процесів в біологічних системах
3.1 Редокс-потенціал як основна характеристика
окисно-відновних реакцій в біологічних системах
3.2 Реакції відновлення у фотосинтезі
3.3 Реакції відновлення у процесі гліколізу (під час
спиртового бродіння)
Висновки
Контрольні запитання
Тестові завдання
Відповіді на тестові запитання
Перелік використаної літератури
1.
Реакції відновлення в біоорганічній хімії
В біоорганічній хімії велике значення мають реакції
відновлення, які є складовою частиною різних біохімічних процесів в біологічних
системах, а в промисловості використовуються для синтезу цінних біоорганічних
сполук.
Відновлення - це процес, що супроводжується утворенням нових
зв’язків з гідрогеном і включає в себе перенесення електронів до органічного
субстрату.
Відновлення є протилежним процесу окиснення, тобто процесу
видалення гідрогену з утворенням кратного зв’язку або нового зв’язку між атомом
вуглецю і гетероатомом, більш електронегативним ніж гідроген, наприклад атомами
оксисену, нітрогену, сульфуру.
В окисно-відновних процесах змінюється ступінь окиснення
атому вуглецю.
Збільшення ступені окиснення атому вуглецю в сполуках

Для відновлення органічних сполук можуть бути використані
майже всі відновники. Частіше за все використовують водень (Н2) в присутності
гетерогенних каталізаторів, гідриди металів та активні метали (Na або Zn). В біологічних системах роль донору водню грають різноманітні
коферменти, наприклад НАДН, НАДФН та ФАДН2.
Найбільш загальним способом відновлення ненасичених
вуглець-вуглецевих зв’язків є каталітичне гідрування:

В біологічних системах часто протікають реакції відновлення
різних азотовмісних сполук, наприклад нітрилів і амідів карбонових кислот, в
результаті яких утворюються первині аміни:

В деяких яскраво забарвлених харчових продуктах можуть бути
барвники на основі аніліну. Постійне вживання в їжу таких продуктів може
призвести до серйозних наслідків, оскільки анілін - яскраво виражений
відновник, має високу біохімічну активність; окислюючись він утворює в
організмі людини різні токсичні сполуки. Промислове добування аніліну з
нітробензолу є типовою реакцією відновлення (більш відома як реакція Зініна) :
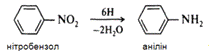
Одним з учасників ферментативних процесів відновлення є
похідне 1,4-дигідропиридина - НАДН, що в при відновленні утворює НАД+ в
різних окисно-відновних реакціях у складі таких складних циклах як цикл Кребса,
Кальвіна та ін. Наприклад, при участі НАДН протікає in vivo реакція перетворення альдегідів у
спирти:

Взагалі відновлення карбонільних сполук (альдегідів, кетонів,
складних естерів) призводить до утворення відповідних спиртів:

Чільне місце в біоорганічній хімії займає відновлення моносахаридів
(альдоз, кетоз). При відновленні альдоз отримується лиш один поліол, кетоз -
суміш двох поліолів. Наприклад, при відновленні D-фруктози борогідридом натрію (NaBH4) утворюються D-глюцит (сорбіт) і D-маніт:

Досить важливою є реакція відновлювального амінування, яка
протікає в організмі в процесі біосинтезу α-амінокислот. Процес протікає
за схемою приєднання - відщеплення і полягає в отриманні α-амінокислот з альдегідів та
кетонів, з утворенням проміжного продукту - іміну, який потім відновлюється до
аміну:

2. Коферменти(відновники) які беруть
участь у окисно-відновних реакціях в біологічних системах
В біологічних системах існують спеціальні буферні сполуки або
системи, що мають здатність приймати і віддавати гідроген (донори гідрогену).
Це різноманітні коферменти.
2.1
Окислювально- відновні коферменти
Всі оксидоредуктази потребують коферментів. Вони можуть діяти
в розчинній формі (Р) або у вигляді простетичної групи (П). Окислювально- відновні реакції, поряд
з переносом електронів, часто включають перенесення одного або двох протонів.
Тому зазвичай прийнято говорити про перенесення відновлювальних еквівалентів .
Стандартний потенціал Eo ' простетичної групи може значно відрізнятися в
залежності від оточення в молекулі ферменту.
Піридиннуклеотиди НАД + (NAD+) і
НАДФ + (NADP+) широко поширені як коферменти дегідрогеназ . Вони переносять
гідрид - іон (2е- і 1 H+ + і діють завжди в розчинній формі.
НАД + передає відновлювальний еквівалент з катаболического шляху вдихательная
ланцюг і тим самим бере участь в енергетичному обміні. HАДФ +, навпаки, є
найважливішим відновником при біосинтезі.
Флавінові коферменти ФМН і ФАД знайдені в дегідрогеназі, оксидазі і монооксигеназі . Зазвичай
обидва з'єднання ковалентно пов'язані з ферментами. Активною групою обох
коферментів є флавін (ізоалоксазіна),
що має сполучену систему з трьох кілець, яка може при відновленні приймати два
електрони і два протона. У ФМН до флавіну приєднаний фосфорильований поліол
рібіт . ФАД складається з ФМН, пов'язаного з АМФ. Обидва сполуки є
функціонально близькими коферментами .
У ліпоєвої кислоті функцію окислювально-відновного центру виконує
внутрішньомолекулярний дисульфідний
місток . Активна ліпоєва кислота ковалентно пов'язана із залишком лізину (R')
молекули ферменту. Ліпоєва кислота насамперед бере участь в окислювальному
декарбоксилюванні 2 -кетокислот.
Дисульфідний місток також міститься в пептидному
коферменті глутатіоні.
Функція убихинона (коферментуQ4) як переносника відновного еквівалента в дихальному ланцюзі має велике значення для живих організмів. При відновленні хинон
перетворюється на ароматичний гідрохінон (убіхінол). Подібні системи хинон /
гідрохінон беруть участь в реакціях фотосинтезу. До цього класу
окислювально-відновних систем належать також вітаміни Е і К.
Група гема є окислювально-відновним кофактором в дихального ланцюга,
фотосинтезу, а також може бути у складі монооксигенази і пероксидази . На відміну від
гемоглобіну в цих випадках іон заліза змінює валентність.
2.2
НАДН
Нікотінамідаденіндінуклеотід (НАДН, NADН) - кофермент,
присутній у всіх живих клітинах, входить до складу ферментів групи
дегідрогеназ, які каталізують окислювально-відновні реакції; виконує функцію
переносника електронів і водню, які приймає від окислюваних речовин. Відновлена
форма (NADH) здатна
переносити їх на інші речовини. Відмінність його від іншого найважливішого
коферменту - никотінамідаденіндінуклеотідфосфата, або NADP, в тому, що останній
містить в молекулі ще один залишок фосфорної кислоти, пов'язаної з
21-вуглецевим атомом рибози.

2.3
НАДФ • H
НАДФ • H - оксидаза, або NADPH - оксидаза (NOX) - клітинний
мембрано-зв'язаний мультимолекулярний ферментний комплекс, що локалізується на
плазматичній мембрані і в деяких органелах . Особливо збагачені цим ферментом
фагоцитарні клітини, такі як макрофаги. Ці оксидази беруть участь у клітинній
протимікробній захисній системі, а також у клітинної проліферації,
диференціювання і регуляції експресії генів. Існує ціла група NADPH - оксидаз,
які розрізняються по складу субодиниць,клітинної специфічності, регуляції та
іншими параметрами.

Реакція, що каталізується NADPH - оксидазою, полягає в окисленні
НАДФ • H до НАДФ + всередині клітини з перенесенням електронів на інший бік
клітинної мембрани і утворення на зовнішній стороні клітини супероксидного
радикала з кисню середовища .оксидаза - це мультикомпонентного ферментний
комплекс . Типовий і найбільш досліджений представник NOX2 складається з двох
мембранних субодиниць gp91phox (α - субодиниця, продукт гена
CYBA) і p22phox (β - субодиниця), трьох цитозольних
компонентів p40phox, p47phox, p67phox і низькомолекулярного G- білка Rac1
(моноцити) або Rac2 (гранулоцити) . Розподіл двох груп компонентів у
субклітинних компартментах гарантує неактивний стан ферменту в спочиває клітці.
Центральним компонентом NADPH оксидази є комплекс gp91phox і p22phox, або
флавоцітохром b558 (по довжині хвилі поглинання цитохрому), або флавоцітохром b
- 245, (по нормальному відновного потенціалу гема - 245 мВ при рН 7.0) . Він
розташований в плазматичної мембрані і в мембрані специфічних гранул, також
може вбудовуватися в клітинну стінку вакуолей фагоцитів, де формує канал для
електронів, закачуваних NADPH оксидазой з цитозолю в вакуоль.
.4
Флавінаденіндинуклеотид (ФАДН2)
хімія кофермент окисний відновний
ФАД -
кофермент, що бере участь в окисно-відновних метаболічних процесах. У якості простетичної групи входить до
складу багатьох ферментів флавінопротеїнів (флавопротеїни можуть містити інший
флавіновий кофермент - ФМН).
ФАД утворюється із вітаміну В2 (рибофлавіну) шляхом
конденсації із АДФ (аденозидифосфатом)
Ізоалоксазинове кільце ФАД може приєднувати електрони та протони, завдяки
чому коферемент виконує функцію переносника. Це можливе за рахунок зруйнування
нестійких π-зв’язків в піримідиновому ядрі (складова частина
ізоалоксазинового кільця).
На відміну від іншого переносника електронів НАД, ФАД може
відновлюватись повністю до ФАДH2,
приєднуючи два електрони та два протони або частково відновлюючись у ході
реакції до семіхінону ФАД•, приєднуючи тільки один електрон і протон:
хімія кофермент окисний відновний

Це дозволяє ФАД виконувати ширший спектр функцій, ніж НАД.
Окиснення та відновлення ФАД можна відстежити за зміною спектру
поглинання:
семіхінон ФАД• - при 370 нм;
окиснена форма ФАД - два піки при 370 та 440 нм.
Ще однією особливістю ФАД у порівнянні з НАД, є те, що він не переносить
електронів дифундуючи від одного ферменту до іншого. Флавінаденіндинуклеотид
переважно міцно, інколи навіть ковалентно (як у випадку сукцинатдегідрогенази),
приєднаний до білка і надає йому можливість утримувати електрони під час їх
перенесення від донора до акцептора.
В залежності від того, з яким білком зв'язаний ФАД його окисно-відновний
потенціал може змінюватись. Для вільного
коферменту він становить −0,219 В, у складі сукцинатдегідрогенази -
близкий до 0,0 В, для інших флавопротеїнів змінюється у діапазоні від +0,06 до −0,4
В.
Деякі із ферментів, що містять у своєму складі ФАД:
Ацил-КоА дегідрогеназа, яка бере участь у β-окисненні жирних кислот;
Дигідроліпоїлдегідрогеназа - складова піруватдегідрогеназного комплексу;
Сукцинатдегідрогеназа - один із ферментів циклу Кребса, окиснення ФАДH2,
утвореного в реакції каталізованій сукцинатдегідрогеназою, спряжене із синтезом
1,5 молекул АТФ;
Гліцерол-3-фосфат дегідрогеназа, що бере участь у транспорті відновних
еквівалентів із цитозолю в мітохондрії у скелетних м'язах та мозку;
Тіоредоксин редуктаза, потрібна для відновлення багатьох сполук в
організмі, зокрема синтезу дезоксирибонуклеотидів із рибонуклеотидів.
3. Реакції відновлення у складі
окисно-відновних процесів в біологічних системах
Реакції відновлення завжди протікають у складі дуже важливих
метаболічних процесів, циклів в біологічних системах. Перш за все це метаболічні
процеси . Для порівнювання окисно - відновних реакцій в біологічних системах
існує така величина як редокс-потенціал .
3.1
Редокс-потенціал як основна характеристика окисно-відновних реакцій в
біологічних системах
Здатність відновника віддавати електрони окиснику виражається
величиною окисно-відновного потенціалу (стандартного відновного потенціалу),
або редокс-потенціалу. Як стандарт в усьому світі прийнятий редокс-потенціал
реакції
Н2 = 2Н+ + 2е-
який при тиску газоподібного водню в 1 атмосферу при
концентрації іонів Н+ рівній 1 моль / літр (що відповідає рН = 0) і
при 25оС умовно прийнятий за нуль. В умовах значення рН, прийнятого в якості
стандарту при біохімічних розрахунках, тобто при рН 7,0, редокс-потенціал (Ео
') водневого електрода (системи Н2 - 2Н +) дорівнює - 0,42 В.
Наводимо значення редокс-потенціалу (Ео') для деяких
окислювально-відновних пар, що грають важливу роль при переносі електронів в
біологічних системах:
|
Відновник
|
Окисник
|
Ео´, В
|
|
Н2
|
2Н+
|
- 0,42
|
|
НАД • Н + Н+
|
НАД+
|
- 0,32
|
|
НАДФ • Н + Н+
|
НАДФ+
|
- 0,32
|
|
Флавопротеїн
(відновл.)
|
Флавопротеїн
(окисл.)
|
- 0,12
|
|
Кофермент Q •
Н2
|
Кофермент Q
|
+ 0,04
|
|
Цитохром в (Fe2+)
|
Цитохром в (Fe3+)
|
+ 0,07
|
|
Цитохром C1 (Fe2+)
|
Цитохром C1 (Fe3+)
|
+ 0,23
|
|
Відновник
|
Окисник
|
Ео´, В
|
|
Цитохром а (Fe2+)
|
Цитохром а (Fe3+)
|
+ 0,29
|
|
Цитохром а3 (Fe2+)
|
Цитохром а3 (Fe3+)
|
+0,55
|
|
Н2О
|
½ О2
|
+ 0,82
|
Система з більш негативним редокс- потенціалом має більшу
здатність віддавати електрони системі з більш позитивним редокс- потенціалом.
Наприклад, пара НАД • Н / НАД +, редокс- потенціал якої дорівнює - 0,32 В
віддаватиме свої електрони окислювально- відновної парі флавопротеїнів
(восстановл.) / флавопротеїнів (окіслен.), що має потенціал -0,12 В, тобто
більш позитивний. Велика позитивна величина редокс- потенціалу окисно- відновної
пари вода / кисень (+0,82 В) вказує на те, що у цієї пари здатність віддавати
електрони (тобто здатність утворювати молекулярний кисень) виражена дуже слабо.
Інакше можна сказати, що у молекулярного кисню дуже велику спорідненість до
електронів або водневих атомів.
.2 Реакції
відновлення у фотосинтезі
Реакції відновлення беруть участь в окисно-відновних циклах в
процесі фотосинтезу.
Фотоси́нтез - процес
синтезуорганічних сполук з вуглекислого газу та води з використанням енергії
світла й за участю фотосинтетичних пігментів . Загальне рівняння фотосинтезу
виглядає так:

Темнова фаза фотосинтезу (більш відома як цикл Кальвіну) є
складним циклом перетворення.
Цикл Кальвіна складається з трьох стадій:
· Карбоксиляція
· Відновлення
· Регенерація акцептора CО2

Однією з найважливіших реакцій цього
циклу є реакція відновлення дифосфогліцеринової кислоти під дією ферменту
тризофосфатдегідрогенази за рахунок НАДФ• Н з утворенням 3-фосфогліцеринового
альдегіду:

Потім під дією гліцеральдегід-1,3-фосфатдегідрогенази
біфосфогліцеринова кислота відновлюється НАД (Ф) · H (у рослин і ціанобактерій;
у пурпурних і зелених бактерій відновником є НАД · H) паралельно з відщепленням
одного залишку фосфорної кислоти. Утворюється гліцеральдегід-3-фосфат
(фосфогліцеральдегід, ФГА, тріозофосфат) Таким чином 3-фосфогліцериновый
альдегид в результаті складних реакцій, які каталізуються ферментами іде на
синтез фруктозо-6-фосфату (основний продукт фотосинтезу попередник глюкози) та
рібулозо-5-фосфату, який в свою чергу перетворюється на рібулозо-1,5-дифосфат,
котрий приєднує СО2 і цикл повторюється.
.3 Реакції відновлення у процесі
гліколізу (під час спиртового бродіння)
Гліко́ліз - це цикл окисно-відновних реакцій
який призводить до перетворення глюкози в піруватз утворенням АТФ та НАДН. Загальне рівняння гліколізу
виглядає так:
С6Н12О6 + 2НАД+ + 2Н3РО4
+ 2АДФ → 2ПВК + 2АТФ + 2 НАД · Н + 2Н2О
Окремим випадком гліколізу, що протікає в біологічній системі
дріжджів в анаеробних умовах є спиртове бродіння. Під час спиртового бродіння
розщеплення глюкози починається гліколітичним шляхом (за винятком бактерії Zymomonas mobilis, у якої глюкоза метаболізує по шляху Ентнера-Дудорова). У
гліколітичних реакціях глюкоза розщеплюється і окиснюється до двох молекул
пірувату, відбувається сусбтратне фосфорилювання двох молекул АДФ із утворенням
АТФ, а також відновлюються до НАДH дві молекули НАД+. За аеробних умов НАДH знову окиснюється віддаючи електрони
через ряд посередників на молекулярний кисень, і тоді знову може бути
використаний у процесі гліколізу. В анаеробних умовах регенерація НАД+
відбувається у кінцевих етапах бродіння, під час яких акцептором електронів є - ацетальдегід, який утворюється із пірувату шляхом декарбоксилювання, яке
каталізується піруватдекарбоксилазою. Цей фермент потребує присутності іонів Mg2+ і містить ковалентно приєднаний кофермент тіамінпірофосфат. Наступним кроком є
відновлення ацетальдегіду до етилового спирту завдяки перенесенню гідрид іона із
НАДH, утвореного у гліколізі].Реакція
відбувається за участі ферменту алкогольдегідрогенази, що містить в активному
центрі іон цинку, який поляризує карбонільну групу субстрату полегшуючи
приєднання гідриду:

Найважливішою реакцією є відновлення ацетальдегіду до
етанолу за участі ферменту алкогольдегідрогенази, активной
групою якої є відновлювальний комплекс НАД×Н2:

Відновлення - це процес, що супроводжується утворенням нових
зв’язків з гідрогеном і включає в себе перенесення електронів до органічного
субстрату. Відновні реакції в біологічних системах протікають у складі
окисно-відновних реакцій. Основною характеристикою окисно-відновних реакцій є
редокс-потенціал. Основними окисно-відновними реагентами є коферменти.
Ці реакції приймають участь у таких важливих для живих
організмів метаболічних процесах як гліколіз, спиртове бродіння (як окремий
випадок гліколізу, що відбувається в анаеробних умовах), фотосинтез (там
реакції відновлення є складовою частиною циклу Кальвіна), цикл Кребса.
Контрольні
запитання
. Що представляють собою реакції відновлення у
біоорганічній хімії?
. Які сполуки утворюються при відновленні
моносахаридів у біологічних системах?
. Що таке коферменти ?
. Які коферменти є відновниками в біохімічних
реакціях, що протікають у живих організмах?
. Що представляє собою НАД • Н і чим цей кофермент
відрізняється від ФАДН2?
. Яка роль кофермента Q в реакціях відновлення, що протікають
в біологічних системах?
. Що таке редокс-потенціал і як він характеризує
окисно - відновні реакції біологічних систем?
. Які відновні реакції протікають під час фотосинтезу?
. Який кофермент бере участь у відновних реакціях у
циклі Кальвіна?
. Яка відновна реакція відбувається під час
спиртового бродіння глюкози?
Тестові
завдання
1. Реакції відновлення - це хімічний процес що полягає у :
А) приєднанні водню;
Б) приєднанні води;
В) приєднанні кисню.
. Які сполуки утворюються при відновленні амідів і нітрилів?
А) уреїди;
Б) діазосполуки;
В) аміни.
. Який кофермент є основним відновником у біологічних
системах?
А) ФАД;
Б) НАДН;
В) НАДФН.
. Яке кільце зумовлює властивості ФМН та ФАД?
А) пуринове;
Б) акридинове;
В) ізоалоксазінове.
. Основною характеристикою окисно - відновних реакцій є
А) різниця потенціалів;
Б) резистентність;
В) редокс-потенціал;
. Цикл Кальвіну це складова частина:
А) гліколізу;
Б) фотосинтезу;
В) хемосинтезу.
7. На якому етапі циклу Кальвіна відбувається відновлення
А) на першому;
Б) на другому;
В) на третьому;
. Яка сполука утворюється з 3-фосфогліцеринової кислоти у
реакції відновлення в циклі Кальвіна
А) 3-фосфогліцериновий альдегід;
Б) 3-фосфогліцериновий спирт;
В) 3-фосфогліцериновий кетон.
. Який кофермент бере участь у реакціях відновлення в циклі
Кальвіна
А)ФАДН2;
Б) НАДФ• Н;
В) НАДН;
. В ході гліколізу в окисно - відновних реакціях
використовується кофермент:
А)НАДН;
Б) НАДФ• Н;
В) ФАД.
Відповіді
на тестові запитання
1. А)
. В)
. Б)
. В)
. В)
. Б)
. Б)
. А)
. Б)
. А)
Перелік
використаної літератури
1. Тюкавкіна Н.А. Бауков Ю. І. "Біоорганічна
хімія", Москва "Дрофа" 2004 - 244с .
. Тюкавкіна Н. А., Артем’єва Н.Н. "Керівництво до
лабораторних робіт з біоорганічної хімії", Москва, "Дрофа" 2008
- 318с.
. Корольов А.П., Грідіна С.Б., Зінкевич Є.П.
"Основи біохімії, частина 4: учбовий посібник Кемеровського технологічного
інституту харчової промисловості" Кемерово, 2004.- 92с.
. Ю. А.Овчинніков "Біоорганічна хімія"
Москва "Просвещение"1987 - 816c.
. Є.С. Сєвєрін. "Біохімія підручник для
ВУЗів" Москва 2003. - 779 с.
6. Маррі Р., Греннер Д.. Биохимия человека - М., "Мир", 1993. - 1-2 т.
7. Комов В.П., Шведова В.Н. Біохимія / В.П. Комов - М., Дрофа, 2004
8. Біохімия / під
ред. Є.С. Сєвєріна - Москва, "ГЭОТАР-Медиа", 2005