Физико-химические методы подготовки воды
Алматинский
университет энергетики и связи
Расчетно-графическая работа
по курсу: Физико-химические
методы подготовки воды
Алматы, 2013
Задание
1. Технологические показатели качества
воды.
Решите
задачу. Считая, что в воде содержаться, только соли  и
и  рассчитайте:
рассчитайте:
а) солесодержания и рН исходной воды;
б) массу осадка после термического умягчения воды;
в) количество реагентов, необходимых для умягчения воды методом осаждения
(расчет вести на 100% - ные растворы умягчающих реагентов);
г) солесодержания и рН воды после Na-катионирования;
д) солесодержания и рН воды после Н-катионирования;
е) солесодержания и рН воды после Н-катионирования и ОН-анионирования.
1. Технологические показатели
качества воды
В зависимости от характера использования
воды различными потребителями определяются и показатели, необходимые для
качественной и количественной характеристики воды. Важнейшими показателями
качества воды для использования ее в теплоэнергетике являются:
1)
концентрация
грубодисперсных веществ (ГДП);
2)
концентрация
истинно растворенных примесей (ионный состав);
3)
концентрация
коррозионно-активных газов;
4)
концентрация
ионов водорода;
5)
технологические
показатели, в которые входят сухой и прокаленный остаток, окисляемость,
жесткость, щелочность, кремнесодержание, удельная электропроводимость и т. д.
Концентрация
грубодисперсных веществ в воде может быть достаточно точно определена фильтрованием воды
через бумажный фильтр с последующим его высушиванием при температуре 378-383 К
до постоянной массы. Однако на практике предпочитают использовать методы
определения грубодисперсных веществ по прозрачности и мутности воды.
Прозрачность воды определяют при
повышенных концентрациях ГДП в воде при помощи стеклянной трубки, залитой
водой, на дне которой расположен шрифт или крест с шириной линий 1 мм. Высота
столба воды, при которой определяется хорошая видимость шрифта или креста,
является количественной оценкой прозрачности воды. При малых концентрациях ГДП
(<3 мг/кг) используют нефелометрический метод, основанный на сравнении
мутности анализируемой воды с соответствующим эталоном. Концентрация ГДП может
быть также определена по разности значений плотного и сухого остатков,
полученных при упаривании 1 кг соответственно не фильтрованной и фильтрованной
воды.
Сухой остаток позволяет косвенно
судить о солесодержании воды, т. е. о сумме всех анионов и катионов в воде, за
исключением ионов Н+ и ОН- . Однако при образовании сухого
остатка несколько изменяется ионный состав примесей за счет разложения
бикарбонатов. В сухой остаток входит также часть органических и коллоидных
примесей. Прокаливание сухого остатка при 1073 К приводит к сгоранию
органических примесей и распаду карбонатов. Поэтому разность значений плотного
и сухого остатков позволяет лишь ориентировочно оценить концентрацию.
Органических примесей в воде. На практике
предпочитают определять концентрацию органических примесей в воде косвенным
методом, используя сильные окислители (например, КМпО4). Поэтому
концентрацию органических примесей называют окисляемостью воды и выражают через
расход окислителя, необходимого в стандартных условиях для окисления
органических примесей, содержащихся в 1 кг воды.
Концентрации отдельных
ионов в
воде, мг/кг (или мг-экв/кг), определяют методами химического анализа.
Правильность проведения анализа должна подтверждаться выполнением закона
электронейтральности мг-экв/кг. Возможная ошибка при этом не должна превышать
1%:

Если ошибка превышает 1%, то следует проверить качество анализа
отдельных ионов или повторить весь анализ.
Суммарная концентрация всех катионов и анионов в воде составляет
солесодержание воды, при этом не учитываются анионы кремниевой кислоты из-за
неопределенности сведений об их концентрации в ионной форме, полуторные оксиды
и ионы Н+ и ОН-. В случае крепких растворов ионы Н +
и ОН- следует учитывать при подсчете солесодержания.
Жесткость воды является одним из
важнейших показателей, определяющих пути использования воды в теплоэнергетике.
Общей жесткостью воды Жо называется суммарная концентрация ионов
кальция и магния, выражаемая в мг-экв/кг, а при малых значениях - в мкг-экв/кг.
По определяющему катиону общая жесткость воды подразделяется на кальциевую ЖСа
и магниевую ЖMg. Часть общей жесткости, эквивалентная концентрации
бикарбонат ионов и карбонат ионов в воде, называется карбонатной жесткостью Жк,
а остальная часть, эквивалентная содержащимся в воде другим анионам (С1-,SO4 и др.), называется
некарбонатной жесткостью Жик:

Общей щелочностью воды Що,
мг-экв/кг, называется суммарная концентрация всех анионов слабых кислот и ионов
гидроксила за вычетом концентрации ионов водорода:

Характер анионов слабых кислот, обусловливающих общую щелочность,
позволяет подразделять ее на гидратную щелочность (равную концентрации ионов ОН-),
бикарбонатную (НСОз), карбонатную (СОз), силикатную (HSiO4, SiO3) и фосфатную (Н2РО4, НРО4, РО4).
Обычно в природных водах бикарбонатная
щелочность, существенно преобладает над другими видами щелочности, поэтому ее
значение без большой погрешности выражает общую щелочность воды. Поправка на
концентрацию ионов Н+ при определении щелочности вводится при
присутствии в воде слабых кислот в свободном состоянии, так как при их
диссоциации образуются в эквивалентных количествах анионы слабых кислот и
анионы Н +.
Удельная
электропроводимость воды, См/см, характеризуется электрической проводимостью слоя
воды, находящегося между двумя противоположными гранями куба с ребром, равным
10-2 м. Она косвенно связана с суммарной концентрацией примесей в
истинно-растворенном состоянии (солесодержанием). В чистой воде, не содержащей
примесей, перенос зарядов осуществляется лишь ионами Н+ и ОН-.
Удельная электропроводимость такой воды при 293К составляет 0,04 мкСм/см. В
растворах связь между электропроводимостью и концентрацией ионных примесей
зависит от множества факторов, в том числе от температуры, вида ионов, степени
диссоциации, что существенно затрудняет измерения. Более определенная связь
существует в растворах при постоянной температуре и степени диссоциации. катионирование умягчение
вода солесодержание
Концентрация растворенных
газов в
воде зависит от множества факторов: природы газа, температуры воды, степени
минерализации воды, парциального давления газа над водой, рН воды и т. п. Это
во многих случаях существенно затрудняет их аналитическое определение в
технологических процессах и требует специальных методов анализа. Концентрация
СО2 в природной воде существенно зависит от степени углекислотного
равновесия и составляет примерно 0,5 мг/кг (105 моль/кг) при 293 К.
Концентрация О2 в значительной степени зависит от содержания в воде
органических веществ и температуры. При увеличении температуры от 273 до 308 К
концентрация кислорода в чистой воде уменьшается от 14,6 до 6,5 мг/кг.
Окисляемость в некоторой мере
характеризует загрязненность воды органическими веществами. Она обычно
выражается количеством миллиграммов кислорода, потребных для окисления в
определенных условиях органических веществ, содержащихся в 1 кг исследуемой
воды, и обозначается мг/кг О2. Окисляемость не отвечает (не
идентична) содержанию в воде органических веществ, так как при условиях ее
определения не происходит полного разрушения (окисления) всех органических
веществ. Окисляемость может быть выражена также количеством мг/кг КМпО4,
израсходованного на окисление органических веществ.
Под кремнесодержанием понимается концентрация
кремниевой кислоты (кремнекислоты, H2SiO3) в пересчете на двуокись кремния (SiO2), находящуюся в исходной
воде. Присутствие SiO2 в питательной воде котельных агрегатов, особенно давлением 4,0
МПа и выше, при некоторых условиях приводит, как показывает опыт, к ряду
затруднений в эксплуатации: образуются силикатные накипи, обладающие низкой
теплопроводностью; возникает занос проточной части турбин аналогичными
соединениями. Поэтому технология обработки исходной воды нередко включает и
процесс ее частичного или полного обескремнивания. В настоящее время
обескремнивание исходной воды производится с использованием ионитов.
Концентрация SiО2 в природных
водах изменяется в широких пределах (от 5-10 до 90 мг/л). Она уменьшается с
увеличением солесодержания (минерализации) воды. Маломинерализованные воды
северных районов СНГ, как правило, содержат высокие концентрации кремнекислоты.
В исходных природных водах кремнекислота
находится как в ионном (HSiO3), так и в коллоидном состоянии. Это
обстоятельство усложняет задачу обескремнивания и химического контроля водного
режима котельных агрегатов, так как при ионообменных процессах и химическом
контроле в реакцию вступает только ионодисперсная форма кремнекислоты, что
следует иметь в виду.
2. Решение задачи
Дано:
Ж0=1,5 ммоль-экв/л
Жнк=0,8 ммоль-экв/л
V=25 м3
=25000 л
а) Солесодержания и рН исходной воды.
Солесодержания - суммарная концентрация растворенных в воде солей.



 ЖкVMэ=0,7*25*81=1417 г
ЖкVMэ=0,7*25*81=1417 г
 ЖнкVMэ=0,8*25*55,5=
1110 г
ЖнкVMэ=0,8*25*55,5=
1110 г

Соль
 образована сильным основанием и сильной кислотой. Её
раствор в воде имеет нейтральную реакцию среды рН=7.
образована сильным основанием и сильной кислотой. Её
раствор в воде имеет нейтральную реакцию среды рН=7.
Соль
 образованная сильным основанием
образованная сильным основанием  и слабой кислотой
и слабой кислотой  при
растворении в воде подвергается гидролизу
при
растворении в воде подвергается гидролизу

Константа
равновесия этого процесса, помноженная на молярную концентрацию воды,
называется константой гидролиза соли. Её можно вычислить по формуле:

где
Кв=10-14 - ионное произведение воды;  - константа диссоциации
- константа диссоциации  по 1-ой ступени.
по 1-ой ступени.

Уравнения
диссоциации соли бикарбаната кальция

Исходная
концентрация ионов  :
:
 2m/(MV)=2*1417/(162*25000)=
6,998*10-4моль/л
2m/(MV)=2*1417/(162*25000)=
6,998*10-4моль/л
Определим
степень гидролиза соли 



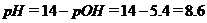 основная
реакция среды
основная
реакция среды
б)
Масса осадка после термического умягчения воды
При
термическом умягчении воды происходит снижение карбонатной жесткости в
соответствии с реакцией

Массу
образовавшегося карбоната кальция  можно
определить по закону эквивалентов:
можно
определить по закону эквивалентов:
Молярная
масса 


Тогда

Определим
, сколько  растворяется в 25000 л воды
растворяется в 25000 л воды
 произведение растворимости.
произведение растворимости.
 моль/л
моль/л
Предельная
масса растворенного в 25000 л воды  :
:
 г
г
Таким
образом, в осадок при термическом умягчении воды выпадает:
 г
г
Остаточная
жесткость воды равна некарбонатной жесткости т.е.
 ммоль-экв/л
ммоль-экв/л
в) Количество реагентов, необходимых для умягчения
воды методом осаждения (расчет вести на 100% - ные растворы умягчающих
реагентов)
Умягчения
воды методом осаждения - это обработка воды химическими реагентами содой и
известью. В результате образуются трудно растворимые вещества  и
и  выводимые
в дальнейшем фильтром.
выводимые
в дальнейшем фильтром.
)
При добавления в воду извести снижается карбонатная жесткость воды.

2)
При добавления в воду соды снижается некарбонатная жесткость воды

Массу
использованных реагентов можно определить по закону эквивалентов:

Молярные
массы эквивалентов реагентов


Определим
массы реагентов для умягчения воды.

г)
Солесодержания и рН воды после Na-катионирования
При
Na - катионировании исходная вода пропускается через
слой Na - катионита. При этом ионы Са+ из
природной воды обмениваются на ионы Na+ из катионита:

Обмен
происходит по закону эквивалентов т.е.
 или
или 
Молярные
массы эквивалентов солей жесткости и солей натрия:

Тогда
солесодержание Na - катионированной воды будет определяться содержанием
в воде солей Na+

д)
Солесодержания и рН воды после Н-катионирования
При
Н - катионировании природная вода пропускается через слой Н - катионита. При
этом katn+ из
обрабатываемой воды обмениваются на ионы Н+ из катионита.

После
полного Н - катионирования в обработанной воде практически не остается
растворенных солей, т.е. солесодержание и жесткость становится близко к нулю:  и
и  . Однако
обработанная вода в результате образовавшегося избытка ионов Н+
становиться более коррезионно-агресивной, так как уменьшается рН - среды
. Однако
обработанная вода в результате образовавшегося избытка ионов Н+
становиться более коррезионно-агресивной, так как уменьшается рН - среды
Обмен
катионов происходит по закону эквивалентов:

концентрация
ионов Н+ в обработанной воде

Определим
рН обработанной воды:
 среда
кислая
среда
кислая
е)
солесодержания и рН воды после Н-катионирования и ОН-анионирования
При
Н - катионировании и ОН - анионирования рН=7 т.к. остаются только Н+
и ОН-, они дают чистую воду  .
.

Солесодержание
будет:

Список
использованной литературы
1.
Задачи и
упражнения по общей химии. Под ред. Н.В. Коровина. М: Высшая школа,2006 - 255с.
2.
Коровин Н.В.
Общая химия. - М: Высшая школа, 2005.
3.
Водоподготовка:
процессы и аппараты. Громогласов А.А., Копылов А.С., Пильшиков А.П.
4.
Водоподготовка.
Белан Ф. И.