Соматотропный гормон (СТГ, гормон роста, соматотропин)
Федеральное государственное
образовательное учреждение высшего профессионального образования
«Московская государственная академия
ветеринарной медицины и биотехнологии имени К.И. Скрябина»
Кафедра органической и биологической
химии
Курсовая работа
по дисциплине «Молекулярные механизмы
гормональной регуляции»
Тема: Соматотропный гормон (СТГ,
гормон роста, соматотропин)
Выполнил
студент 4-го курса
-й группы ВБФ
Чудаков Д.Б.
Научный руководитель
К.б.н., доцент
Джафаров М.Х.
Москва 2012
Содержание
Введение
. История вопроса
. Структура и синтез гормона роста
. Секреция гормона роста
. Гормон роста в крови
. Молекулярный механизм действия и биологические эффекты
гормона роста
.1 Рецептор гормона роста и сопряжённые с ним белки
.2 Сигнальные пути, активируемые гормоном роста
.3 Соматомедины, их секреция, рецепторы и биологические
эффекты
.4 Суммарные биологические эффекты гормона роста
. Эндокринные патологии, связанные с гормоном роста и их
лечение
.1 Болезни, связанные с недостаточностью гормона роста
.2 Болезни, связанные с избытком гормона роста
Заключение
Список литературы
Введение
Эндокринная система организма совместно с нервной и иммунной системой
контролируют ход различных физиологических процессов в организме. Важнейшим
процессом в онтогенезе организма является процесс его роста и развития, в том
числе и в постнатальный период. Этот процесс регулируется многими гормонами,
одним из главных (если не самым главным) в этом процессе является гормон роста,
иначе именуемый соматотропином.
Молекулярные механизмы действия гормона - ключ к пониманию природы его
биологических эффектов, к управлению ими и часто к устранению основных
патологий, связанных с данным гормоном. Поэтому знание данного вопроса
необходимо, а изучение его актуально как с теоретической, так и с практической
точки зрения, особенно в отношении соматотропина - одного из ключевых тропных
гипофизарных гормонов человека и животных.
Целью моей работы является описание основных известных на сегодняшний
день молекулярных механизмов регуляции синтеза и секреции гормона роста,
описание химической структуры этого гормона и молекулярных механизмов его
действия, включая описание его рецепторов, сигнальных путей, через него
активируемых гормоном, и примеры некоторых белков, синтез которых им индуцируется.
В работе я привожу также основные физиологические эффекты гормона роста и
возможные их молекулярные механизмы на основе обобщённых данных. В конце работы
кратко опишу основные патологии, развитие которых так или иначе связано с
гормоном роста.
Для написания данной работы планирую использовать как русскоязычные
источники, так и англоязычные, включающие некоторые новые данные.
1. История
вопроса
Как орган гипофиз был открыт весьма давно, его анатомия и гистология у
животных и человека были подробно изучены к началу XX века, однако изучение биохимии, физиологии и патологии
гормонов, вырабатываемых им, началось сравнительно недавно.
Патологии, связанные с гормоном роста, известны уже давно, например
акромегалию как болезнь впервые описал П.Марри в 1886 году, а год
спустя Минковски доказал, что патология связана с гормонпродуцирующей
активностью передней доли гипофиза. В отечественной литературе первой сообщение
об акромегалии сделал Б.М.Шапошников в 1889 году. Таким образом уже на
рубеже XIX-XX веков было известно, что гипофиз вырабатывает некоторое
вещество, гормон, ответственный за стимуляцию роста тела [1]. Однако впервые
удалось выделить гормон роста, или соматотропин, лишь в 1956 году Ли и Паркоффом,
а установить его первичную структуру - Нейлу в 1971 году. С этого
времени гормон роста и начали изучать с биохимической точки зрения [2].
Вот перечень некоторых основных открытий, связанных с соматотропином и
сделанных в 70-80-х годах XX
века (года по времени опубликования статей). В 1973 году П. Бразоу и Р. Бургус
изолировали и установили первичную структуру соматостатина. Исследования
1976-1981 годов выявили пульсовой ритм секреции гормона роста у многих видов
млекопитающих и половой диморфизм этих ритмов (Саундерс, Мартин, Стейнер,
Танненбаум, Терри и другие исследователи). В 1977 году С.Питерз и Х.Г. Фризен
доказали наличие в плазме крови белка, связывающего гормон роста с высокой
аффинностью. В том же году Бовер с коллегами доказал, что высвобождение гормона
роста может стимулироваться эндорфинами и энкефалинами. В 1978 году Левис с
коллегами выделили новую изоформу гормона роста, 20-КДа, в 1978-81 годах
открыта способность гормона роста образовывать олигомерные структуры в крови
(Левис, Шарман и др.), В 1982 году из крови двух пациентов с панкреатической
опухолью и акромегалией был выделен соматолиберин, усиливающий синтез и
секрецию гормона роста. В 1987 году был клонирован ген и изучена структура
рецептора гормона роста у кролика и человека (Д.В. Леунг, С.А. Спенцер,
Г.Кахианес и другие). К концу 1980-х годов уже были накоплены достаточные
сведения о соматомединах, уже было известно о белках, связывающих их в плазме
крови. В 1989 году был предложен механизм образования этого белка в результате
альтернативного сплайсинга гена рецептора гормона роста. В 1989-90 годах
открыта плацентарная гликозилированная изоформа гормона роста [2-6].
В 90-х годах исследования, касающиеся гормона роста и молекулярных
механизмов его действия продолжались. В 1990 году впервые предложена модель
димеризации рецептора гормона роста при связывании его с гормоном роста. К 1992
году стало понятно, что рецептор гормона роста при активации активирует
МАР-каскад. В 1993 году доказан механизм образования белка, связывающего гормон
роста, через протеолиз его рецептора, установлена способность гормона роста
активировать транскрипционный фактор сывороточного ответа, уже до того
известный своей способностью активировать транскрипцию некоторых мышечных
белков. Тогда же стала известна способность гормона роста активировать
реорганизацию актинового цитоскелета и миграцию моноцитов. Установили, что
сигнальные пути, активируемые гормоном роста, начинаются с активации
Янус-киназы JAK-2. В 1994 году открыли активацию
через рецептор гормоном роста сигнального пути с участием IRS-белков. В том же году открыли его
способность активировать STAT
белки. В 1995 году доказано, что гормон роста может связываться α2 - макроглобулином в крови; установлены приблизительно
сайты цитоплазматического домена гормона роста, фосфорилирующиеся при его
активации. В 1999 году был изолирован кишечный фактор, стимулирующий секрецию
гормона роста (грелин). К 1996 году расшифровали доменную структуру рецептора
гормона роста и установили приблизительно функцию каждого из доменов;
обнаружили способность гормона роста стимулировать вход кальция в клетку,
зависимый от активации протеинкиназы С. В 1998 году обнаружено, что рецептор
гормон роста стимулирует реорганизацию актинового цитоскелета через фокальную
адгезионную киназу. К 1999 году доказана активация транскрипции гена ИФР-1
гормоном роста через активацию STAT-5.
В 2000 году установлен в общих чертах молекулярный механизм действия
соматотропина на синтез гормона роста [2-6].
В начале XXI века по
настоящее время проводятся уточнения молекулярного механизма действия гормона
роста. В 2001 году предложена модель мультипротеинового комплекса,
образующегося при активации гормоном роста его рецептора при цитоплазматическом
домене его рецептора. В 2002-2005 годах появились данные о возможности
существования рецептора гормона роста в димерной форме и в отсутствии самого
гормона. К 2003 году стало известно, что помимо JAK-2 рецептор гормона роста способен напрямую
активировать и Lyn-киназу. В 2006
году предложена модель активации JAK-2
при связывании гормона с рецептором [7-8].
2.
Структура и синтез гормона роста
Основным местом синтеза соматотропина, или гормона роста, является
аденогипофиз (передняя доля гипофиза), а точнее - специальная разновидность
хромофильных ацидофильных клеток - соматотрофы, накапливающие данный
гормон в виде гранул внутри своей цитоплазмы, они наиболее многочисленны в
передней доле гипофиза [9-10]. Однако в последнее время открыто, что это место
синтеза - не единственное.
Гормон роста - это типичный белковый гормон. В литературе обычно
говорится, что он представляет из себя белок молекулярной массой 22кДа, имеющий
в своём составе 191 аминокислоту и 2 внутримолекулярных дисульфидных связи (у
человека между остатками цистеина 52-165 и 183-189) [10]. Однако в последнее
время стало понятно, что дело обстоит несколько сложнее и интереснее.
Гормон роста - гетерогенный белок. Имеется два гена гормонов роста, оба
располагаются у человека в локусе 17q24.2. (на длинном плече 17-й хромосомы).
Весь кластер, занимаемый этими генами, а также тремя другими, имеет размер
46800 килобаз [2] (тысяч пар нуклеотидов). Рассмотрим эти гены и их продукты.
Два разных гена (обозначаемых GH1 и GH2, от
английского «growth hormone» - гормон роста) кодируют два разных варианта гормона
роста - соответственно основной вариант, или GH-N, и минорный вариант, или GH-V. Главный продукт
экспрессии гена GH1 - это и есть
типичная изоформа гормона роста, имеющая в составе 191 аминокислотный остаток и
молекулярную массу 22129Да, иначе именуемая 22К-GH, образуемый через стадию прогормона
молекулярной массой 28кДа, структура показана на рисунке №1. Это - наиболее
распространённая изоформа соматотропина, составляющая 55% от его общего
количества в гипофизе и 45% его содержания в крови. Однако мРНК-продукт этого
же гена подвержена альтернативному сплайсингу, обусловленному наличием в экзоне
3 гена альернативного сайта сплайсинга (всего в этом гене и других генах этого
кластера по 5 экзонов и 4 интрона), в результате которого получается более
короткий вариант соматотропина, отличающийся от канонического выпадением
аминокислотных остатков 32-46. В этом случае получающийся вариант, включающий
176 аминокислотных остатков и имеющий молекулярную массу 20274Да - это 20К-GH (скорее, также образуется через
прогормон, аналогично укороченный). Эта изоформа имеет более низкое процентное
содержание как в гипофизе (6% от всего гормона роста), так и в плазме крови (у
человека 5%). Иногда происходит ещё большее укорочение молекулы - при
альтернативном сплайсинге выпадает весь экзон 3 (аминокислотные остатки 32-71)
и образуется изоформа массой 17483Да, но она в значительном количестве
обнаружена лишь у некоторых пациентов с генетическим дефицитом гормона роста II типа. Кроме того, белки - продукты GH1 - гена могут агрегировать и
образовывать димеры и даже олигомеры, существование которых отмечено как в
самом гипофизе, так и в плазме крови. При этом встречаются диссоциабельные ди-
и олигомеры, в которых мономерные молекулы гормона связаны нековалентными
связями, и недиссоциабельные, в основном связанные при помощи дисульфидных
связей. Например, содержание в гипофизе диссоциабельных димеров составляет 10%
от всего количества соматотропина, диссоциабельных олигомеров - 5%; в плазме
крови концентрация таких 22К-GH
димеров составляет 14%, 20К-GH
димеров - 3%, олигомеров разных вариантов около 9%. Что касается димеров и
олигомеров, в которых молекулы мономеров соматотропина связаны дисульфидными
связями, их концентрации меньше и составляют следующие значения: в гипофизе
димеры, образованные при связывании мономеров друг с другом S-S мостиками - 7%, такого же рода олигомеры - 2%; в плазме
крови 22К-GH аналогичного типа димеры - 6%, 20К-GH - 2%, олигомеры - 4%. Кроме того
часть этих белков проходит дополнительные посттрансляционные модификации,
происходящие скорее всего неферментативно. Точно установлен пока факт
дезаминирования in vivo остатков глутамина-137 и
аспарагина-152 (считая по нумерации в 22К-GH). При этом образуются так называемые «кислые» изоформы
соматотропина. Форма с дезаминированным аспарагином встречается в гипофизе с
частотой 6% от всего количества гормона, с дезаминированным глутамином - 2%.
Мономерные дезаминированные формы присутствуют в крови в концентрации до 5%,
димерные дезаминированные формы - 2%, олигомерные дезаминированные формы - 2%
[2].

Рисунок 1. Химическая структура гормона роста на примере основной
изоформы, 22кДа
Последовательность аминокислот, выделенная жирной линией (32-46),
отсутствует в 20кДа изоформе, двумя звёздочками показаны возможные сайты
дезаминирования гормона, остатки, подписанные сбоку, соответствуют
аминокислотным заменам в GH-V изоформе по сравнению с основной.
Древовидным знаком показан остаток Асн-140, гликозилированный лишь в GH-V изоформе; показаны жирными линиями внутримолекулярные
дисульфидные связи [2].
Обобщая вышесказанное, гипофизарный вариант гормона роста GH-N содержится преимущественно в 22К-GH изоформе (от 58 до 82%, в среднем около 72% от концентрации
всего гормона роста, считая как его мономеры, так ди- и олигомеры), и в меньшей
степени в виде 20К-GH (3-15%, в
среднем 5,2%, мономеры, ди- и олигомеры) [2].
Продукт гена GH2 - это белок GH-V. Эта изоформа гормона роста экспрессируется
предпочтительно, если не исключительно в синцитиотрофобласте плаценты и поэтому
называется «плацентарным гормоном роста». Гормон освобождается в материнский
(но не плодный) кровоток, тормозит биосинтез GH-N изоформы в
гипофизе. Наличие его отмечено только в крови беременных женщин (самок
млекопитающих), у женщины начинает продуцироваться на 5-8 неделе беременности и
достигает максимальной за 4 недели до окончания срока беременности, когда его
концентрация в крови достигает 13-22нг/л. Сразу нужно отметить, что его синтез
и секреция, в отличие от синтеза и секреции GH-N изоформы
находится не под гипоталамическим контролем и регуляторы этого процесса пока
неизвестны. По первичной структуре GH-V изоформа гормона роста отличается от
гипофизарной по 13 аминокислотным остаткам, имеются следующие замены:
гистидин-18 заменен на аргинин, гистидин-21 на тирозин, фенилаланин-25 на
тирозин, пролин-37 на лейцин, глутамат-65 на валин, глутамат-66 на лизин,
фенилаланин-92 на лейцин, аспартат-112 на аргинин, лейцин-113 на гистидин,
глутамат-126 на триптофан, лизин-140 на аспарагин, треонин-142 на серин,
аспартат-150 на лизин. Особое значение, по-видимому, имеет замена лизина-140
аспарагином, поскольку этот аминокислотный остаток у GH-V часто
гликозилирован, а GH-N гликозилируется лишь в следовых
количествах. О тенденции GH-V к олигомеризации известно очень мало
[2].
В кластере есть ещё три гена. Два из них кодируют близкие к гормону роста
по структуре белки - два варианта хорионического соматомаммотропина, или
плацентарного лактогена (CS1 и CS2), а при экспрессии последнего гена кластера
получается CS-подобный пептид, его обнаруживают в
крови в следовых концентрациях. Не исключено, что этот последний ген является
псевдогеном без определённой биологической функции. Все пять геном кластера
возникли в эволюции, скорее всего, путём неоднократной дупликации одного и того
же гена [2], о чём говорят крайне высокая гомология их первичной структуры,
расположенность в одном локусе хромосомы, одинаковой число интронов (четыре) и
экзонов (пять).
Несмотря на наличие столь большого числа изоформ, считают, что все они
имеют примерно одинаковую третичную структуру, включающую 4 α-спирали, хотя в 20К-GH конец первой (с N-конца) α-спирали и часть пели между первой и
второй спиралями отсутствует [2].
Синтез гипофизарного гормона роста регулируют, по-видимому, многие
факторы, в том числе вещества пептидной природы и нейромедиаторы, а также он
сам по «короткой петле» отрицательной обратной связи. К настоящему моменту
времени наиболее прояснён механизм регуляции синтеза гормона роста через
регуляцию транскрипции его GH1
гена соматотропин-релизинг гормоном (соматолиберином). Этот гормон
представляет собой пептид из 40 или 44 аминокислот, синтезируемый в аркуатном
(воронкообразном) и вентромедиальном ядрах гипоталамуса. Соматотропин-релизинг
гормон принадлежит к семейству «мозго- кишечных» (brain-gut)
пептидных гормонов, как и большинство из них имеет остаток гистидина на N- и изолейцина на С-конце. Аркуатное
и вентромедиальное ядра иннервируется дофамин- и холинергическими нейронами.
Аксоны этого ядра идут в так называемые срединные возвышения гипоталамуса, где
из них в портальную сосудистую систему высвобождается соматотропин-релизинг
гормон. Портальная сеть включает в себя первичную капиллярную сеть, которая
контактирует с терминалями нейронов многих ядер гипоталамуса, в том числе и
вышеназванных, и переходит в портальные вены, идущие вдоль гипофизарной ножки в
аденогипофиз, где распадаются на вторую капиллярную сеть, вены от которой уже
идут в общий кровоток. Соматотропин-релизинг гормон поступает в эту портальную
сеть и по ней достигает соматотрофоцитов, связываясь на них со своим
специфическим рецептором, обозначаемым сокращённо GHRHR (от growth hormone
releasing hormone receptor). Этот рецептор представляет из себя
трансмембранный белок, включающий 7 трансмембранных доменов (423 аминокислотных
остатка), N-конец внеклеточный и
гликозилированный, а С-конец цитоплазматический, белок имеет пальмитолированный
остаток цистеина вблизи С-конца [3].
Рецептор GHRHR сопряжён
с Gs - белком [4]. G-белки - это гетеротримеры, связанные
с цитоплазматической мембраной клеток-мишеней (со стороны цитоплазмы), состоят
из α-цепи (молекулярная масса 40-50кДа),
непрочно связанной с димером βγ, где β-субъединица имеет молекулярную массу
35кДа, прочно связана с γ-субъединицей (8кДа). Именно α-субъединица определяет специфичность
взаимодействия белка с рецептором и эффектором [5]. При активации G-белка посредством его взаимодействия
с комплексом рецептор-агонист (в данном случае GHRHR-GHRH)
происходи обмен ГДФ в активном центре α-субъединицы на ГТФ, и она теряет
сродство к βγ-комплексу. Субъединица α белка Gs при активации отходит от βγ-комплекса (но остаётся связанной с
плазматической мембраной, поскольку её конец N-миристилирован, миристиловая кислота заякоривает белок в
мембране) и активирует аденилатциклазу [10].
Почти все гормонрегулируемые аденилатциклазы - интегральные белки
плазматической мембраны, гликопротеины с молекулярной массой от 110 до 180кДа
(известно минимум 8 их изоформ). Белки имеют 12 трансмембранных доменов,
сгруппированных в две группы (по 6 в каждом, обозначаются как домены М1 и М2),
между которыми лежит С1 - цитоплазматический домен, в котором за связывание АТФ
ответственен субдомен С1a.
После М2 - домена идёт цитоплазматический С-концевой С2 домен, его субдомен С2а
взаимодействуя с С1а образует сайт, катализирующий реакцию образования цАМФ из
АТФ [5]. Таким образом GHRHR,
связываясь с соматотропин-релизинг гормоном, через Gs - белок активирует аденилатциклазу и
повышает в клетке концентрацию цАМФ. В результате активируется протеинкиназа А.
Этот белок прикреплён к мембране (с помощью остатка миристиловой кислоты или AKAP - cAMP dependent protein kinase anchoring protein) и имеет две регуляторные и две каталитические
субъединицы. В присутствии регуляторных субъединиц каталитические субъединицы
протеинкиназы не фосфорилируют белки-мишени, но в присутствии цАМФ регуляторные
субъединицы, связываясь с ним, теряют сродство к каталитическим и те могут
фосфорилировать белки-мишени [11].
После увеличения концентрации цАМФ в клетках соматотрофоцитов происходит
увеличение входящего Na+ - тока и деполяризация мембраны
(скорее всего Na+ - каналы этих клеток являются мишенью протеинкиназы
А). Деполяризация открывает потенциалзависимые Ca2+ - каналы, что в итоге ведёт к увеличению концентрации Ca2+ в этих клетках и усилению экзоцитоза
везикул с соматотропином, то есть к увеличению его секреции. Но что даже более
важно, протеинкиназа А фосфорилирует и активирует CREB - транскрипционный фактор (cAMP response element binding protein, то есть белок, связывающий элементы цАМФ-ответа, имеются
в виду элементы ДНК). Именно этот транскрипционный фактор ответственен за
усиление продукции гормона роста и рецептора к соматотропин-релизинг гормону de novo в соматотрофоцитах [3].

Рисунок 2. Молекулярный механизм действия соматотропин-релизинг гормона (GHRH) на синтез и секрецию гормона роста
(GH)
Здесь GHRHR - рецептор соматотропин-релизинг
гормона (и его ген), Gsα - α-субъединица G-белка, стимулирующая аденилатциклазу, PKA - протеинкиназа А, GH1 - ген основной изоформы гормона
роста, CREB - белок, связывающий элементы
цАМФ-ответа [3].
Антагонистом соматотропин-релизинг гормона является соматостатин.
Соматостатин действует через свой специфический рецептор, угнетая синтез и
секрецию гормона роста. Исходя из данных [3] механизм действия соматостатина
заключается, скорее всего, в том, что его связанный с агонистом рецептор через Gi - белок ингибирует аденилатциклазу.
Интересно, что помимо CREB
синтез транскрипцию гена гормона роста играет другой фактор - PIT1 (или POU1F1), член белков семейства POU - транскрипционных факторов,
участвующих в регуляции транскрипции не только гена соматотропина, но и
пролактина, β-субъединицы тиреотропного гормона. В свою очередь в раннем
эмбриогенезе экспрессия РIT-1
связана с PROP-1 (Prophet of PIT-1, «предсказатель PIT-1»). PROP-1 в эмбриогенезе важен как триггер, запускающий
синтез гормона роста [3].
Все остальные эффекторы влияют в большей степени именно на секрецию
гормона роста, поэтому их целесообразнее рассмотреть далее.
3.
Секреция гормона роста
Секреция гормона роста осуществляется по механизму экзоцитоза секреторных
везикул [9]. Секреция гормона роста соматотрофоцитов имеет ту характерную
особенность, что она носит пульсирующий характер, причём это явление, как
считается вызвано не особенностями метаболической регуляции секреции гормона
роста, а связано с регуляцией его секреции гипоталамусом, активация медиальной преоптической
области которого (нейроны вырабатывают соматостатин) ингибирует секрецию
гормона роста, а активация аркуатного и вентромедиального ядра
(вырабатывают соматотропин-релизинг гормон) активируют. Пульсовая активность же
этих ядер может быть связана с особенностями их регуляции ядрами ствола мозга и
лимбической системой [12].
Наиболее полно изучен ритм секреции у крыс. Здесь особенность состоит ещё
и в разных ритмах секреции гормона у самцов и самок. У самцов крыс гормон
секретируется строго периодически, с подъёмами каждые 3-4 часа, причём во время
этих всплесков концентрация гормона в крови может доходить до 500-1000нг/мл, но
после такого скачка следует период 30-90 минут, во время которого концентрация
гормона роста в крови опускалась ниже 5нг/мл, то есть разница между периодом
пика и спада достигает более двух порядков. Секреторный профиль соматотропина у
самок имел менее регулярный характер, пики наблюдались каждые 1-2 часа, но были
весьма различны по величине. Более того обнаружено. что у самок крыс во время
этих пиков концентрация гормона роста не превосходила 300нг/мл, но зато в
межпиковые состояния концентрация гормона роста была выше, чем в аналогичные
периоды у самцов - 10-20нг/мл, да и сами периоды между пиками были короче
(15-30 минут). То есть при схожем периодизме секреции соматотропина у самцов
всплески были более резкими и частота их была меньше. чем у самок [12].
У остальных животных (мыши. кролики, собаки, макаки-резусы, бабуины) и у
людей также наблюдается пульсовая секреция гормона роста. Причём отмечены
аналогичные различия между самцами и самками, хотя и не такие явные, как у
крыс. Хотя пульсовая секреция гормона роста определяется гипоталамусом, на неё
влияют половые стероидные гормоны. Так у кастрированных самцов крыс паттерн
секретиции был близок к таковому у самок, причём чем раньше была проведена
кастрация, тем больше был этот эффект, а в случае кастрации во взрослом
состоянии паттерн секреции гормона у самцов не менялся. Из этого и некоторых
других данных заключают, что стероидные гормоны меняют в раннем периоде
развития (на всю дальнейшую жизнь) чувствительность соматотрофоцитов к гормону
роста [12] (то есть к механизму регуляции его секреции по короткой петле
обратной связи).
Физиологическое значение разных паттернов секреции самцов и самок не
ясно. Возможно, оно необходимо для детерминации длины тела и веса взрослых
животных [12], согласно другому предположению оно необходимо для транскрипции в
органах-мишенях генов цитохрома Р-450 изоформ 2С11 и 3А10 у самцов, в то время
как секреция в менее «резком» пульсовом режиме у самок приводит к транскрипции
преимущественно генов изоформы Р-450 2С12 [4].
У человека гормон роста также секретируется в пульсовом режиме, интервалы
составляют 20-30 минут, один из наибольших пиков отмечается вскоре после
засыпания. У нерастущих взрослых людей концентрация гормона роста в крови
обычно до 10нг/мл. хотя под влиянием белковой диеты и физических упражнений
может повышаться до 30-100нг/мл [10].
Кроме соматотропин-релизинг гормона и соматостатина на процесс секреции,
как оказалось, влияют и другие вещества. Одно из них - это грелин.
Довольно давно было замечено, что морфин, эндорфины и энкефалины
увеличивают секрецию гормона роста. Но сравнительно недавно (в 1999 году) были
прояснены сведения по поводу специфических рецепторов на соматотрофоцитах,
через которые осуществляется их влияние, и об естественном лиганде этих
рецепторов. Оказалось, что в различных отделах желудочно-кишечного тракта
человека, и в значительно меньшей мере в аркуатном и вентромедиальном ядрах
гипоталамуса синтезируется небольшой 28-аминокислотный пептид грелин.
Синтез его идёт через более длинный предшественник из 117 аминокислот, ген его
у человека располагается в 3-й хромосоме (3q25-26). В результате
альтернативного сплайсинга может вырабатываться и его 27-аминокислотный
вариант. Интересно, что по третьей аминокислоте его происходит необычная
посттрансляционная модификация - октаноирование (присоединение остатка
октановой, или каприловой кислоты), совершенно необходимое для проявления его
биологической активности [3].
Рецептор грелина соматотрофоцитов (GHSR, growth hormone secretagogue receptor, то есть рецептор стимулятора
секреции гормона роста) - белок с 6-7 трансмембранными доменами (есть две
изоформы рецептора - длинная, с 7 трансмембранными доменами и 366
аминокислотными остатками, GHSR1a, и более короткая, скорее с 6 трансмембранными
доменами и 289 аминокислотными остатками, GHSR1b,
большую роль в регуляции секреции гормона роста имеет длинная изоформа). Ещё
пока полностью не прояснён молекулярный механизм действия грелина через свой
рецептор, но уже многое точно ясно, например что его эффекты Mg2+ и ГТФ-зависимы. Есть данные, что
рецептор грелина сопряжён с G-белком,
стимулирующим фосфолипазу С, которая гидролизует
фосфатидилинозитол-4,5-бисфосфат до диацилглицерола и
инозитол-1,4,5-бисфосфата, последний является Ca2+ - высвобождающим (из эндоплазматического ретикулума)
агентом, а диацилглицерол и Ca2+ активируют протеинкиназу С.
Протеинкиназа С - мономерный белок, который в неактивном состоянии
находится в цитозоле. а в активном прикреплён к мембране. Существует около 12
различных изоформ протеинкиназы, наиболее часто встречающиеся - это α, β1, β2 и γ. Последовательность различных
доменов в их молекулах следующая: с N-конца идёт небольшой домен, так называемый «псевдосубстрат»; далее идёт
более длинный С1-домен, его функция заключается в связывании диацилглицерола, в
этом домене вторичная структура образует так называемый «цинковый палец»,
представляющий из себя структуру из 20 аминокислотных остатков, в которой на
ближних N- и C-концах находятся соответственно два остатка цистеина и два
остатка гистидина, связывающиеся с одним ионом Zn2+, средняя же часть данной структуры образует α-спиральный участок, связывающий
лиганд (здесь диацилглицерол), так называемый «палец». Сразу же за доменом С1
следует домен С2, главная функция которого - связывать Ca2+, причём после его связывания он приобретает сродство к
фосфатидилсерину плазматической мембраны. С3 и С4 домены, расположенные ближе к
С-концу, это собственно каталитический центр фермента, причё С3 ответственен за
связывание АТФ, а С4 - за сам процесс фосфорилирования. В отсутствии Ca2+ фермент находится в неактивной
форме. поскольку доступ субстрата к каталитическому сайту закрывает
«псевдосубстратный» домен, но при увеличении концентрации Ca2+ домен С2, присоединяя его и приобретая
сродство к фосфатидилсерину, опосредует связывание белка с плазматической
мембраной; далее С1-домен связывает диацилглицерол в мембране, что ещё больше
увеличивает сродство фермента к мембране и его активность, поскольку изменяет
конформацию белка так. что его «псевдосубстратный» домен больше не может
блокировать каталитический центр; фермент переходит в активную форму [10-11].
Протеинкиназа С фосфорилирует в соматотрофоцитах некие белки-мишени, в
любом случае конечный эффект грелина, опосредованный ею, заключается в усилении
экзоцитоза секреторных везикул. Точно установлено, что грелин не индуцирует
транскрипцию гена GH1 в
соматотрофоцитах, он влияет лишь на секрецию гормона роста, а не на его
биосинтез [3], в отличие от соматолиберина.
Нейромедиаторы через нейроны гипоталамуса регулируют секрецию гормона
роста. Норадреналинэргические нейроны в гипоталамусе присутствуют в паравентрикулярном,
медиальном преоптическом, переднем гипоталамическом, супрахиазматическом и
некоторых других ядрах. Норадреналин и его агонисты через гипоталамус
стимулируют секрецию гормона роста, причём большое значение играют α-адренергические механизмы. Дофаминовые
нейроны в гипоталамусе располагаются в аруатном и паравентрикулярном ядре. Их
возбуждение стимулирует секрецию гормона роста, но внутривенное введение
дофамина и его агонистов ингибирует секрецию. Поэтому некоторые из агонистов
дофамина (апоморфин, L-допа,
бромокриптин) используют в лечении акромегалии. Возможно их прямое влияние на
гипофиз. Серотонин через гипоталамус стимулирует секрецию гормона роста, а
гистамин ингибирует [12].
4. Гормон
роста в крови
Из капиллярной сети гипофиза гормон роста поступает в общий кровоток и
перераспределяется в нём. Как было сказано выше. гормон роста гипофиза имеет
две основные изоформы - 22К-GH и
20K-GH, и кроме того может присутствовать в крови в виде
олигомеров. Как оказалось, T1/2 20K-GH несколько
больше, чем 22К-GH у человека и
крыс, хотя для морской свинки это не было отмечено. Но больше T1/2 (период полужизни гормона в плазме
крови) зависит от олигомеризованности. Для мономера он равен 19 минутам, для
димера 26,5 минутам, для олигомеров около 45 минут [2].
Но самое интересное оказалось, что значительная часть фракции гормона
роста в крови находится в связанном состоянии с так называемым GHBP - growth hormone binding protein (белок, связывающий гормон роста). Впервые данных,
говорящие об этом, были получены ещё в 1960-х годах. но подвергнуты критике,
поскольку считалось. что все белковые и пептидные гормоны должны находиться в
крови лишь в свободном состоянии. Но позже существование GHBP пришлось признать. Оказалось, что
имеются два белка, связывающих гормон роста. Один из них связывает его с низкой
активностью, это низкоаффинный GHBP,
он идентичен α2
- макроглобулину [2,4,13]. Концентрация этого α2 - глобулина в крови 2,6г/л [10], но связывает он
гормон роста с Ка порядка нескольких милимоль. Второй белок - высокоаффинный GHBP, или просто GHBP [13]. Остановлюсь подробней именно на нём.
Этот белок оказался идентичен внеклеточному (N-концевому) домену белка - рецептора к гормону роста (GHR - growth hormone receptor). Соответственно он кодируется одним
с ним геном. У людей есть две разновидности GHBP, отличающиеся на 21 аминокислотный остаток.
Молекулярная масса GHBP человека
60-65кДа, а у цыплёнка всего 28кДа. Белок человека очень сильно гликозилирован,
собственно полипептидная цепь в нём имеет массу лишь 28-30кДа. Белок обнаружен
не только в крови. но и в моче, амниотической жидкости, молоке, семенной
жидкости, но не в цереброспинальной. Но даже в крови белок находится в низких
концентрациях, поэтому преимущественно формирует комплекс с соматотропином в
соотношении 1:1. GHBP образуется по
двум основным механизмам: в результате альтернативного сплайсинга гена
рецептора GHR или в результате протеолитического
расщепления уже встроенного в плазматическую мембрану рецептора GHR [13].
У крыс, мышей, коров, свиней идёт механизм образования GHBP альтернативным сплайсингом. К крыс и
мышей ген GHR содержит между экзонами 7 и 8 в
интроне специальный встроенный экзон 8А, кодирующий гидрофильную
последовательность аминокислот (27 у крыс и 17 у мышей), и при сплайсинге
возможно «отрезание» от мРНК участка после 8А-экзона, поэтому белок рецептора
синтезируется не только укороченным (без цитоплазматического), но и с заменой
гидрофобного трансмембранного домена на гидрофильный. что и позволяет ему
секретироваться в кровь. У макак-резусов экзона 8А не найдено, продукция GHR у них возможна при прочитывании
сразу после экзона 7 части интрона 7/8, при этом трансмембранного домена при
трансляции такой мРНК вновь не образуется (у макак-резусов установлен и
протеолитический механизм образования GHBP) [13].
У людей, кроликов и некоторых других видов преобладает протеолитический
механизм образования GHBP.
На включённый в мембрану (в плазматическую, хотя не исключают возможность
прохождения процесса и во внутриклеточных компартментах) действует особая металлопротеиназа
TACE (TNFα - converting enzyme, синоним ADAM-17), которая осущесвляет протеолитическое расщепление рецептора в
примембранном участке внеклеточного его домена (точное место расщепления ещё не
установлено, но ясно, что важную роль здесь играет остаток цистеина-241
молекулы рецептора), в результате чего внеклеточный домен рецептора как бы
«сбрасывается», «сбривается» (процесс «shedding»). Этот домен становится свободным и
уходит в кровоток (межклеточную среду) и становится собственно GHBP. Остальная часть рецептора, уже
нефункционабельная, остаётся связанной с мембраной. TACE-протеаза может осуществлять ограниченный протеолиз и
других цитокиновых рецепторов [13].
С высокоаффинным GHBP в
среднем у человека связано 47% 22К-GH мономера, 10% 20K-GH мономера. С α2-макроглобулином (низкоаффинным GHBP) соответственно 4% и 40%. Для ди- и
олигомеров эти проценты не ясны [13]. Поскольку 22К-GH изоформа гормона преобладающая, то получается, что гормон
роста связан в основном с высокоаффинным GHBP, хотя его 20К изоформа связывается преимущественно с α2 - макроглобулином. В целом у человека 45% всего
гормона роста связано с GHBP,
но на пике секреции гормона это количество может достигнуть 80% [13].
/3 гормона роста элиминируется через почки, но в проксимальных извитых
канальцах нефрона идёт его интенсивная реабсорбция и деградация (поэтому гормон
роста хотя и присутствует в моче, но в очень малых количествах) [2], но
комплекс GH-GHBP слишком громоздкий (молекулярная масса 85кДа) для
того чтобы попасть в первичную мочу, и поэтому элиминируется медленнее из
крови. Поэтому средняя продолжительность существования мономера GH в крови человека 19 минут как бы
среднее из двух Т1/2 - периода полужизни не связанного с GHBP гормона - 7 минут, и периода полужизни
связанного с GHBP - 27 минут [13].
В виду вышеназванного скорее всего основная роль GHBP состоит в «забуферивании» концентраций активного
гормона роста, что предотвращает её чрезмерные колебания при пульсовой секреции
и что более важно - в пролонгировании действия гормона роста. Интересно, что у
самок млекопитающих (больше для крыс, в меньшей степени это характерно для
мышей, кроликов и людей) установлено более высокое содержание GHBP плазме крови, чем у самцов того же
вида [13].
GHBP
является внеклеточной частью GHR,
который может существовать в плазматической мембране органов-мишеней гормона
роста в мономерной и димерной форме. К передаче сигнала внутрь клетки способен
лишь полноценный димер. Между внеклеточными частями GHR в димере есть нековалентные взаимодействия. Поэтому GHBP может вступать в аналогичные
взаимодействия с внеклеточными доменами GHR на мембранах, например клеток печени, что приводит к
формированию «неполноценных» рецепторов соматотропина, которые могут его
связывать, но к внутриклеточной передаче сигнала не способны. Поэтому синтез GHBP может служить механизмом
отрицательного регулирования действия гормона роста. Важно и то, что связанная
в данный момент с GHBP молекула
гормона роста не может взаимодействовать одновременно со своим рецептором из-за
конкуренции за участки связывания на молекуле гормона роста для GHR и GHBP [13].
У крыс (да, скорее всего и у других млекопитающих) основной источник GHBP - это печень. Предполагается, что
его может вырабатывать и висцеральная жировая ткань. У всех исследованных по
этому поводу млекопитающих GHBP
секретируется больше у юных животных и при переедании. Действие других факторов
у разных видов неоднозначно. Например, эстрогены у крыс повышают, а у кроликов
понижают количество GHBP в плазме
крови; гонадолиберин повышает его количество у человека, а у крыс понижает.
Инсулин и гормон роста потенцируют его синтез у грызунов, но не у человека
[13].
Теперь можно перейти к молекулярным механизмам действия соматотропина.
5.
Молекулярный механизм действия и биологические эффекты гормона роста
5.1
Рецептор гормона роста и сопряжённые с ним белки
Рецептор гормона роста на клетках - мишенях представляет собой
интегральный белок плазматической мембраны клеток-мишеней с одним
трансмембранным доменом, N-
конец расположен вне клетки, С-конец внутриклеточный. Этот рецептор принадлежит
к суперсемейству белков - рецепторов цитокинов/гемопоэтинов, куда помимо него
относятся, например, рецепторы к пролактину. эритропоэтину, гранулоцитарному
колониестимулирующему фактору, гранулоцит-макрофагальному колониестимулирующему
фактору, интерлейкинам 2, 3, 4, 5, 6, 7, 9, 11, 12 и некоторые другие [4].
Рецептор гормона роста имеет молекулярную массу (мономер) 130кДа, 6
потенциальных сайтов для гликозилирования во внеклеточном домене, 6 остатков
цистеина там же, связанных между собой S-S связями и один
свободный остаток цистеина. Существует две точки зрения на организацию
рецептора в мембране, согласно традиционной в отсутствие гормона рецептор
представляет собой мономер, а при связывании гормона роста димеризуется (два
рецептора связывают одну молекулу гормона) [4,7,10], но в последнее время
приводятся сведения о том, что и в отсутствие гормона рецептор находится в
димерном состоянии [7].
Внеклеточные участки рецептора гормона роста имеют два фибронектиновых
домена III типа, это домены β-складчатой сендвичевой структуры,
соединённые коротким подвижным линкерным участком [7]. Эти два домена занимают
аминокислотные участки в молекуле с 43-го по 218-й, причём образуют они как бы
два обособленных в первичной структуре, но по-видимому представляющих в
третичной структуре единый сайт связывания, включают они по 33 и 31
аминокислотных остатка. При этом вначале при связывании соматотропина участвует
лишь первый (из 33 аминокислотных остатков) сайт связывания, а затем второй
[4]. В димере гормона роста один из мономеров связывает гормон с сильной
аффинностью, а другой - со слабой [7]. Для проведения сигнала внутрь клетки
димеризация рецептора (смотри рисунок №3) крайне необходима. По этой причине
гормона роста в больших концентрациях может быть «самоантагонистом» [4],
поскольку стехиометрические соотношения его и его рецептора будут не 1:2, а
например 1:1, то есть каждая его молекула свяжется лишь с одной рецепторной
молекулой и не будет проводить сигнал в клетку-мишень, хотя если рецептор
является димером изначально, то «самоантагонизм» не будет наблюдаться.
Как и все белки семейства рецепторов цитокинов/гемопоэтинов, рецептор
гормона роста вблизи трансмембранного домена во внеклеточной части имеет так
называемый WSXWS-мотив (последовательность аминокислотных
остатков триптофан-серин-Х-триптофан-серин, где Х - любая аминокислота).
Присутствие его совершенно необходимо как для связывания гормона роста, так и
для дальнейшей передачи сигнала, причём критическими для передачи сигнала
являются первый остаток триптофана и последний серина. У цыплят при мутации
рецептора гормона роста, приводящей к замене этого серина на изолейцин,
рецептор теряет сродство к гормону и развивается синдром карликовости цыплят,
сцепленный с полом [4].
Выше были кратко охарактеризованы несколько изоформ гормона роста.
Несмотря на то, что у них третичная структура всё же несколько различается,
хотя и незначительно, пока не выявлено какого-либо существенного отличия в их
биологических эффектах, все они связываются одинаково с рецептором гормона
роста, хотя есть сведения [3], что 20K-GH имеет меньшее сродство к рецептору,
чем 22K-GH. 20K-GH у человека при связывании с
рецептором в клетках-мишенях осуществляет в основном те же биологические
эффекты, что 22K-GH, единственное что пока не полностью
доказана его способность индуцировать пролиферацию, в то время как для 22K-GH это один из основных биологических эффектов. Аффинность GH-V изоформы к рецептору гормона роста сопоставима с аффинностью
22K-GH, но он в меньшей степени стимулирует родственные
пролактиновые рецепторы. Насчёт ди- и олигомерных форм гормона роста данные о
их биологической активности варьируют, называют числа от 20 до 100% активности
мономерной формы [2].
Во внутриклеточной части рецептора наиболее важны для передачи сигнала
следующие домены (по направлению к С-концу): Lyn, box1 и
box2 [9,10] (рисунок №3). Lyn - домен практически вплотную прилегает к
трансмембранному домену. При активации рецептора этот домен активирует Lyn-киназу, белок из семейства Src - киназ. Данная киназа с участием
малых ГТФазных белков RalA и
RalB активируют киназы ERK1/2 (p44/42MAPK),
а те далее транскрипционный фактор Elk-1. Было также показано, что одновременно происходит активация и других
регуляторных малых ГТФаз - Rap1 и
Rap2, ингибирующих дальнейшую активацию ERK1/2 [10]. Бокс 1 в молекуле рецептора
расположен ближе к С-концу, он имеет характерную для подобных рецепторов
последовательность аминокислот Ψ-X-X-X-Али-Про-Х-Про, где Про - пролин, Али
- алифатическая аминокислота, Х - любая аминокислота, Ψ - гидрофобная аминокислота. Например
в рецепторе гормона роста млекопитающих последовательность эта следующая:
изолейцин-лейцин-пролин-пролин-валин-пролин-валин-пролин. Бокс 2, располагающийся
ещё далее, по первичной структуре характеризуется наличием кластера гидрофобных
аминокислотных остатков, разбросанных среди кислых, и кончается двумя
положительно заряженными остатками [4].

Рисунок 3. Структура рецептора гормона роста (димерная форма)
Фиолетовым изображены внеклеточные домены, синим - связанная молекула
гормона роста, Y - остатки
тирозина, важные для передачи сигнала внутрь клетки; показаны некоторые (не
все) белки сигнальных путей, связанные с внутриклеточными участками рецептора
[7].
Бокс 1 у цитокин/гемопоэтиновых рецепторов служит для связывания Янус-киназ (JAK), тирозиновых киназ [7,14].
Интересно рассмотреть сами молекулы Янус-киназ (JAK). Особенностью этих киназ является отсутствие в них SH2 или SH3-доменов в отличие от других нерецепторных тирозинкиназ. В
их молекулах вместо этого присутствуют семь консервативных JH-доменов (JH 1-7, считая с С- к N-концу). Из них JH1
домен выполняет собственно каталитическую роль, а JH2 - роль псевдокиназного домена. В отсутствии активирующего
стимула JH2 плотно контактирует с JH1-доменом, ингибируя его работу.
Интересно, что их ближайший к N-концу
JH7-домен по структуре похож на
небольшой примембранный цитоскелетный белок эритроцитов - белок полосы 4.1., в некоторых
других белках (эрзине, радиксине, моэзине) и в FAK (Focal adhesion
kinase), ассоциированной с рецептором
гормона роста через JAK-2. Значение
этого домена в функционировании Янус-киназ пока не ясно, но установлено, что он
может связывать фосфорилированные производные фосфоинозитола (фосфоинозитиды)
[8].
Показано, что связанный с лигандом гормон роста активирует именно JAK-2 киназу, хотя нельзя полностью
исключать и активацию в небольшой степени других подобных киназ (JAK1, JAK3 и tyk2).
Димеризованный при связывании с гормоном рецептор гормона роста также
активирует две молекулы JAK-2
[4].
Исходя из данных [7] JAK2
киназа связана с рецептором гормона роста и тогда, когда он не связан с
лигандом, но при этом JH2 её
домен (JAK2-pseudokinase domain) контактирует с её каталитическим JH1 - киназным (ближайшем к С-концу JAK2) доменом и ингибирует её, что
блокирует работу этой киназы. При связывании же с рецептором гормона роста две
субъединицы его димера претерпевают конформационные изменения и, кроме того,
поворачиваются друг относительно друга, что приводит к тому, что JAK2 - киназа активируется, её
псевдокиназный домен уже не блокирует домен каталитический [10]. При эактивации
JAK2 происходит реакция
«трансфосфорилирования», то есть две молекулы JAK2, связанные с рецептором, фосфорилируют друг друга и
молекулу рецептора. Критическим для связывания с рецептором гормона роста у JAK2 является её N-концевая часть 1/3 полипептидной
цепи. Мышиная JAK2 содержит 48 остатков тирозина в
своем составе, но какие из них подвергаются фосфорилированию - пока точно не
ясно. Более полно изучены сайты, фосфорилирующиеся на молекуле гормона роста.
Так, у крыс в большей степени фосфорилируются остатки тирозинов 333 и 338
внутриклеточного домена гормона роста, у свиней чаще всего фосфорилирование
идёт по тирозину 534 [4].
JAK2
киназа при фосфорилировании активируется и активирует следующие основные
сигнальные мессенджеры: МАР-киназы; IRS-белки; протеинкиназу С; Stat-белки
[4]. Рассмотрим их кратко далее.
5.2
Сигнальные пути, активируемые гормоном роста
Src-опосредованный сигнальный путь. Как было сказано выше, связавшись с
лигандом, рецептор гормона роста через свой Lyn - домен активирует Lyn - киназу. Это - член семейства Src-киназ (тирозинкиназ), названные так
потому, что впервые они были обнаружены в саркоме (sarcoma). В настоящее время известно около 9 таких киназ - Src, Fyn, Yes, Fgr, Lck, Hck, Lyn, Blk. В этих киназах, как и в других тирозиновых киназах,
есть SH2 - домен, состоящий примерно из 100
аминокислотных остатков. Этот домен представляет собой «карман», к которому
должен подходить фосфорилированный остаток тирозина. Показано, что этот домен
после аутофосфорилировании рецептора связывается с его фосфорилированным
тирозином, что приводит к активации Src-киназы. В данной киназе есть и очень похожий SH3-домен (около 60 аминокислотных остатков), который после
активации киназы осуществляет активацию следующей киназы путём её
фосфорилирования. Согласно данным [7] далее этот белок при участии малых ГТФаз RalA и RalB активируют киназы ERK1/2 (Extracellular regulated kinases), хотя в [15] непосредственным
субстратом Src должен быть белок SHC. Белок SHC, скорее всего, активирует киназу MEK1 (MAP kinase/extracellular
signal-regulated kinase), иначе
именуемую как MAPKK (MAP konase kinase), которая в этом случае активирует MAP (рисунок №4), а та (естественно,
путём фосфорилирования) ERK1
(синоним p42/44 MAPK). Так или иначе, ERK1 активирует уже в ядре транскрипционный фактор Elk1 (а возможно, и другие, например Ets, Tcf, ATF2),
которые обычно запускают транскрипцию генов «раннего ответа», и при
действии гормона роста, скорее всего, происходит то же самое. Продукты данных
генов названы так потому, что в клеточной культуре после действия митогена их
концентрация достигает максимальной уже через 30 минут. Сами по себе продукты
этих генов FOS и JUN - это также транскрипционные факторы, но специфичные
в отношении уже так называемых «генов замедленного ответа». Среди
продуктов этих генов в основном регуляторы клеточного цикла, например циклин D, Cdk4, Myc, Cdk25a.
Целесообразно здесь же рассмотреть функции этих белков. Центральную роль
в регуляции клеточного цикла играют циклины и циклинзависимые киназы (Cdk, cyclin-dependent kinase).
Циклинзависимые киназы - это те ферменты, которые фосфорилированием различных
белков-мишеней регулируют ход митоза. Это - односубъединичные белки,
находящиеся в неактивном состоянии вплоть до момента, когда с ними свяжется
специальный белок - циклин. Название «циклин» пошло от того, что концентрация
этих белков в клетке меняется циклически во время всего клеточного цикла.
Циклин, связываясь с Cdk,
не только активирует её, но и придаёт ей субстратную специфичность. Каждая
циклинзависимая киназа образует комплекс со своим циклином [15]. Комплекс
циклин D - Cdk4 запускает клеточный цикл следующим образом. В
неделящихся клетках присутствует белок pRb (от «ретинобластома» - опухоль, развивающаяся при его
мутации), который в нефосфорилированном виде ингибирует комплекс двух
транскрипционных факторов E2F-DP. Комплекс циклин D - Cdk4 фосфорилирует данный белок, и тот
теряет сродство к комплексу транскрипционных факторов E2F-DP. Далее эти транскрипционные факторы,
связываясь с промоторами соответствующих генов, индуцируют транскрипцию генов:
ферментов синтеза и репликации ДНК (дигидрофолатредуктазы, тимидинкиназы,
ДНК-полимеразы α, белка PCNA,
закрепляющего комплекс полимераз на реплицируемой ДНК); циклинов Е и А, Cdk2 и Cdk1; ген самого транскрипционного фактора E2F; гены транскрипционных факторов для гена циклина В. Кроме
того циклин D-Cdk4 комплекс фосфорилирует белок APC (anaphase-promoting complex), являющегося убиквитинлигазой, специфичной к циклину
В. Фосфорилирование Cdk4 блокирует APC, предотвращая стимулируемое им
разрушение циклина В. В синтетическом периоде клеточного цикла комплекс циклин
Е-Cdc2 фосфорилирует и тем самым
инактивирует ещё одни ингибиторы пролиферации - белки семейства KIP1 (p21, p27, p57), которые связываются с уже
сформировавшимися комплексами циклин-Cdc и служат для предупреждения преждевременной репликации ДНК. Циклин А-Cdc2 комплекс фосфорилирует, как
предположено в [15], некоторые белки формирующееся в точке начала репликации
комплекса, ответственного за инициацию репликации ДНК, и репликация начинается.
Что касается белка циклина В, то он образует комплекс с Cdk1, который для краткости обозначают
как MPF - mitosis promoting factor - фактор, обеспечивающий митоз. Если говорить кратко,
его работа заключается в фосфорилировании белков-мишеней, после чего начинается
профаза митоза, переходящая в дальнейшие стадии его. Например, MPF фосфорилирует гистон H1, особые белки SMS (structural maintenance of chromosomes, белки, необходимые для поддержания
структуры конденсированных хромосом) и, скорее всего, какие-то ещё белки, после
чего начинается перестройка хроматина, его уплотнение и конденсация, что
присуще стадии профазы. Также MPF
фосфорилирует мономеры ламинов (белков, образующих ядерные филаменты,
поддерживающие ядерную оболочку) и мономеры тубулина (из них при полимеризации
образуются микротрубочки); первое приводит в конечном итоге к распаду ядерной
оболочки и началу формирования веретена деления (конец профазы) [15].
Функция белка Myc, также
относящегося к продуктам гена «замедленного ответа», состоит в работе как
транскрипционного фактора, активирующего транскрипцию гена Cdc25a, кодирующего специфическую фосфатазу, с участием которой
происходит дополнительная активация Cdc4 и Cdc2, и ингибирующего транскрипцию гена p27 - одного из ингибиторов комплексов
циклин-Cdc [15].
Конечно, это лишь краткое перечисление тех эффектов, которые наблюдают
при активации генов FOS и JUN, но и их примеры достаточны, чтобы
понять, что продукты этих генов являются митогенами и запускают клеточный цикл,
а значит, что гормон роста, действуя через свои специфические рецепторы,
способен через Src-опосредованный
сигнальный путь активировать пролиферацию клеток, что важно в таких его
биологических эффектах, как например стимуляция общего роста тела и стимуляция
роста трубчатых костей в длину, роста хрящевой ткани.

Рисунок 4. Основные сигнальные пути, активируемые гормоном рост через
свой рецептор и JAK2
гормон рост патология соматотропин
Представлен Ras-MAP киназный путь, Stat-сигнальный путь, опосредованный IRS-белками путь, опосредованный
фосфолипазой С путь. Расшифровки аббревиатур в тексте [4].
Транскрипция генов раннего ответа FOS и JUN
может запускаться и по-другому, через каскад MAP-киназ (Mitogen-activated protein
kinase). При действии гормона роста на
клетки-мишени через свои рецепторы происходит активация и этого каскада.
Доказано, что JAK-2 киназа после активации сама, или
через активацию SHC-белка,
активирует фосфорилированием белок Grb [4]. дальнейшие события, строго говоря, для проведения сигнала от
рецептора гормона роста ещё точно не доказаны, но из имеющихся сведений о
сигнальном каскаде MAP с очень
большой долей вероятности предполагают следующее. Grb2 (белок с молекулярной массой 24кДа, имеющий один SH2 и два SH3 домена)при активации присоединяет к себе (оставаясь связанным
с рецептором) один из GEF-белков
(guaninenucleotide exchange factor), в данном случае SOS-белок (название произошло от мутации у дрозофилы,
связанной с недоразвитием нервных клеток сетчатки, son of sevenless). Образующийся комплекс стимулирует
обмен ГДФ на ГТФ в Ras-белке. Ras-белок - это небольшая (21кДа)
мембраносвязанная ГТФаза, относится к группе мономерных ГТФаз, или так
называемых «молекулярных переключателей». При замене в этом белке ГДФ на ГТФ
происходит активация белка до того момента, пока на него не подействует GAP (GTPase-accelerating protein), белок,
стимулирующий ГТФазную активность. Но за это время активный Ras-белок успевает передать сигнал
далее. Первый белок, активируемый им - Raf-1. Это внутриклеточная серин/треонинкиназа, первый
компонент собственно MAP-каскада.
Синоним названия Raf-1 - MAPKKK, то есть киназа киназы МАР-киназы.
Эта киназа фосфорилирует белок MAPKK
(MEK), уже упомянавшийся выше. MAPKK уникален тем, что самостоятельно
способен фосфорилировать регуляторные остатки серина и треонина в своём
субстрате. Как только он осуществит фосфорилирование тирозина-185, а затем
треонина-183 в MAPK, он
инактивируется специфической фосфатазой. Известны три изоформы MAPK - MAPK, Erk-1
и Erk-2, но все три имеют примерно
одинаковые функции - фосфорилировать и тем самым активировать транскрипционные
факторы, а также и некоторые цитоплазматические белки, среди которых
регуляторные белки цитоскелета и собственные пусковые молекулы - Raf-1 и SOS (регуляция по положительной обратной связи) [14].
Основные гены, транскрипцию которых активируют МАР-киназы, опять таки гены
раннего ответа FOS и JUN [15]. Их активация приводит к уже
описанным выше событиям.
Кроме того согласно [4] ещё одними из важных субстратов
митогенактивируемых протеинкиназ являеются так называемые S6 - киназы, к которым относятся
киназы p70rsk и p90rsk, особенно важна по-видимому вторая из них, которая фосфорилирует SRF-белок (serum response factor, так называемый «фактор сывороточного ответа»). Этот
фактор запускает транскрипцию генов «сывороточного ответа» (SRE, serum response elements) с c-fos промоторами.
Названы они так, поскольку транскрипция генов, содержащих эти элементы,
значительно повышалась при добавлении к культурам клеток сыворотки и (или)
ростовых факторов [5]. В промоторах генов сывороточного ответа находится А-Т
богатая последовательность, с обоих сторон ограниченная инвертированными
повторами типа ЦЦАТАТТАГГ. Сам по себе SRE - белок, состоящий из 508 аминокислотных остатков и
имеющий молекулярную массу около 67кДа. Для связывания с ДНК наиболее важен
домен его, располагающийся в центре полипептидной цепочки между 133 и 222
аминокислотным остатком. Аналогичный по структуре ДНК - связывающий домен был
найден в белках MCM-1 дрожжей,
белках агамоус и дефициенс (Agamous
и Deficiens) растений и SRF млекопитающих и назван MADS-доменом. При взаимодействии с участком ДНК происходит
димеризация фактора. Домен, ответственный за активацию транскрипции, находится
на С-конце белка (с 339 по 508 аминокислотные остатки). Данный транскрипционный
фактор может активироваться через тот же MAP-каскад и иначе, при помощи ERKбелков (от Extracellular-signal regulated kinase). В этом процессе может быть задействован и белок,
называемый TCF (Ternary cimplex factor), фосфорилирование (скорее с помощью ERK или MAPKK) и связывание которого с SRE необходима для активации последнего. Сейчас
идентифицировано около 30 генов, содержащих в промоторе элементы «сывороточного
ответа». Среди них опять же гены раннего ответа, такие как с-fos, FosB, JunB,
но не только они. SRE-белок
активирует и транскрипцию и генов, продукты которых необходимы для развития
мышечной ткани и её функционирования - α-актина скелетных и сердечных мышц,
тяжёлых цепей миозина, лёгких цепей миозина, SERCA (Ca2+ - АТФаза саркоплазматического
ретикулума), тропонина Т и тропомиозина, дистрофина, винкулина, креатинкиназы М
и даже некоторых белков нервной ткани (Nurr1 и Nur77,
связанные с орфановыми ядерными рецепторами) и других тканей, например
немышечный β-актин и γ-актин гладких мышц [5]. В виду этого
можно объяснить, почему гормон роста стимулирует увеличение массы мышечной
ткани за счёт в первую очередь её рабочей части как в период позднего
эмбриогенеза, так в постнатальный период развития. Через активацию МАР-каскада
он активирует SRF - транскрипционный фактор, что
приводит к индукции синтеза вышеназванных мышечных белков, что является
наиболее важным моментом в процессе увеличения мышечной массы за счёт
гипертрофии мышечной ткани.
Ещё одним субстратом для MAP-киназы
является фосфолипаза А2. Цитозольные фосфолипазы А2
- Ca2+ - зависимые белки молекулярной
массой 85кДа, активируются кальцием в низких, субмикромолярных концентрациях, а
также при фосфорилировании протеинкиназой С. Скорее всего в данном случае
фосфорилирование также их активирует. Фосфолипазы А2 гидролизуют
сложноэфирную связь в sn-2
положении в фосфолипидах, при этом образуется лизофосфолипид и остаток жирной
кислоты. В этом положении в фосфолипидах чаще содержатся непредельные жирные
кислоты. например арахидоновая. Поэтому повышение активности фосфолипазы А 2
ведёт и к увеличению концентрации арахидоновой кислоты в клетке. Это
автоматически приводит к росту концентрации её метаболитов в клетке, которые (а
возможно и сама арахидоновая кислота) активируют специальные Ca2+ - каналы в мембране клеток-мишеней,
что может привести через активацию кальцием некоторых вторичных посредников и
транскрипционных факторов к активации транскрипции некоторых генов, среди
которых гены цитохромов Р-450 2С12 и 3А10 изоформ.
Весьма важный (возможно, важнейший) сигнальный путь, активируемый
гормоном роста, это путь с участием STAT-белков (Signal transducers and activators of transcription). Эти белки относятся к так
называемым «латентным факторам транскрипции», которые в неактивном состоянии находятся
в цитоплазме, а при активации димеризуются и транспортируются в ядро клетки,
где и выполняют свою функцию [4,10,14,16]. На сегодняшний день известно минимум
7 различных STAT-белков (рисунок №4). Гормон роста
через свой специфический рецептор активирует STAT-1, STAT-3,
SNAN-5A и STAT-5B [4,16]. Происходит это путём
фосфорилирования данных белков. Скорее всего фосфорилирование осуществляется JAK-2 киназой, активированной при
связывании рецептора гормона роста со своим лигандом, причём JAK-2 киназа, как уже было выше сказано,
не отходит от рецептора. Фосфорилируются в STAT-белках их тирозиновые остатки. При этом большую роль
играют, опять-таки, SH2 - домены STAT-белков, связывающиеся с
фосфорилированными тирозинами JAK-2
[16]. В JAK-2 установлены соответственно один и
два связывающих сайта Для STAN-1
и 3. Однако есть данные, что STAT-5,
в отличие от STAT-1 и STAT-3, связывается напрямую с фосфорилированным
рецептором гормона роста, при этом, например у свиньи, играют роль
фосфорилированные остатки тирозинов 534, 566 и 627 в цитоплазматической части
рецептора гормона роста [4,16]. Однако, как стало известно недавно, STAT-белки могут фосфорилироваться не
только по тирозину, но и по серину (треонину), при этом для STAT-1 и 3 было показано увеличение
сродство к ДНК, правда такое фосфорилирование осуществляется не JAK-2, а МАР-киназой [16]. Процесс
активации STAT усложняется тем, что в нём участвуют
дополнительные регуляторные белки. Регулируют они фосфорилирование STAT через JAK-2. Например, стимулирующее влияние на
фосфорилирование JAK-2 STAT-белков оказывает так называемый SH2-доменсодержащий белок SH2-Bβ. Он стимулирует фосфорилирование и
активацию STAT-3 и STAT-5B.
Протеинфосфатазы SHP-1 и SHP-2, также относящиеся к SH2-доменсодержащим белкам, блокируют
процесс, первая путём прямого дефосфорилирования JAK-2 (а она лишь в фосфорилированном состоянии активна),
а вторая взаимодействуя с самим рецептором гормона роста (его
цитоплазматическим доменом). Возможна роль здесь и других фосфатаз, например
серин/треонинкиназного ингибитора Н7. Имеются также белки SOCS-семейства (suppressors of cytokine signaling). В этой группе четыре белка - SOCS-1, 2, 3 и CIS. Эти белки блокируют работу комплекса
цитоплазматического домена рецептора гормона роста (или другого гормона,
цитокина) с JAK-киназой. Белки содержат SH2 - домены. При этом SOCS-1 может ингибировать работу
фосфорилированной JAK-2 в растворе,
а SOCS-3 и CIS - только JAK-2 в комплексе с цитоплазматическим доменом рецептора. Эти белки играют
важную роль в данном случае, поскольку их транскрипция индуцируется, в том
числе, и гормоном роста по STAT-зависимому
механизму, то есть белки блокируют тот сигнальный путь (и все другие,
начинающиеся с рецептора гормона роста и JAK-2 киназы), активация которого вызвала их транскрипцию,
осуществляя регуляцию сигнального пути по принципу отрицательной обратной связи
[16].
После фосфорилирования STAT-белки
образуют димеры (причём не обязательно гомодимеры, могут быть и гетеродимеры) и
транспортируются в ядро через ядерные поры. При этом показано, что в такой
транспортировке их в ядро играет роль импортины α/β и RAN - белок. При этом структурный домен, распознающийся
импортинами, образуется, скорее всего, при димеризации STAT - белков, а не присутствует в них изначально [16].
Как транскрипционные факторы STAT-1 и 3 активируют транскрипцию гена c-fos,
протоонкогена, принадлежащего к выше охарактеризованным генам «раннего ответа»,
«запускающим» клеточный цикл, связываясь с Sis-индуцибельным элементом (SIE, Sis-inducible element) в его промоторе. Опыты с мышами показали, что
отсутствие STAT-1 транскрипционного фактора не ведёт
к существенному уменьшению роста тела, поэтому он, скорее всего, не является
важным транскрипционным фактором для генов, ответственных за рост тела; дефицит
STAT-3 приводил к высокой эмбриональной
смертности по неясным причинам, что показывает, что STAT-1 и 3 имеют несколько разную роль в молекулярном
механизме действия гормона роста.
Роль STAT-5 несколько иная. Наиболее интересно
то, что он, а точнее STAT-5B, ответственен за тот физиологический
эффект, который оказывают разные паттерны (ритмы) секреции гормона роста у
самок и самцов. У самок, как было сказано выше, секреция идёт в пульсовом
режиме, но концентрации гормона в пиках секреции его менее высокие, чем у самцов,
а в периоды между пиками - более высокие, чем у самцов, у которых разница между
концентрацией гормона в крови во время пика секреции и в межпиковый период
может достигать двух порядков. То есть у самок количество гормона роста в крови
более постоянно, чем у самцов, его действие на рецепторы более пролонгировано. STAT-5B связывается с так называемыми GAS-like (GAS-подобными) элементами в промоторах
многих генов, активируя их транскрипцию. Среди них гены ферментов цитохромов
Р-450 (CYP) семейств CYP2 и CYP3.
Эти цитохромы отвечают за метаболизм эндогенных стероидов организма. Опыты на
крысах показали, что «резкий» ритм пульсовой секреции гормона роста с чётко
выраженными пиками и малой «базовой» секрецией гормона между пиками у самцов
ведёт к преимущественной экспрессии генов CYP2C11
(андроген 16α- и 2α-гидроксилаза), CYP3A2
(стероид 6β-гидроксилаза), CYP2A4 (тестостерон 15α-гидроксилаза) и CYP4A2 (ω-гидроксилаза жирных кислот); у хомяков GAS-like элемент, связывающий STAT-5, идентифицирован в гене CYP3A10 (6β-гидроксилаза). У самок в условиях
более «плавного» ритма секреции гормона роста экспрессируется преимущественно
ген CYP2C12 (стероид 15β-гидроксилаза). Наблюдения за мышами,
дефицитными по STAT-5B, у которых был удалён гипофиз,
показали, что за более интенсивный рост самцов, обусловленный специфическим для
них ритмом секреции гормона роста, ответственен именно STAT-5B.
Косвенно подтверждает это то, что за время между двумя пульсами секреции
гормона роста (2 часа) способность к новому фосфорилированию именно STAT-5B, а не у других факторов, восстанавливается. При этом
серин/треонинкиназный ингибитор Н7 ускоряет процесс регенерации данного
фактора, но точно роль его точно не известна, как неизвестно и ключевое отличие
в механизмах регуляции активности STAT-5B по сравнению с другими STAT-белками, приводящими к тому, что
именно через него происходит передача влияния более «резкой» пульсовой секреции
гормона на транскрипцию генов специфических для самцов цитохромов Р-450 [4,16].
Считают, что STAT-5 является
тем транскрипционным фактором, который обуславливает индуцированное гормоном
роста увеличение роста и массы тела, а также продукцию инсулиноподобного
фактора роста-1 (ИФР-1). В одной из клеточных культур β-клеток островков Лангерганса
соматотропин посредством STAT-5
и при увеличении концентрации внутриклеточного Ca2+ стимулировал синтез и секрецию инсулина (объяснение, почему
при избытке гормона роста возможна гиперинсулинемия), а в некоторых других
клеточных линиях через STAT-5
гормон роста активировал транскрипцию гена β-казеина (хотя последнее больше
присуще пролактину). Услиление общего липогенеза в организме также может быть
обусловлено усилением транскрипции специфических генов STAT-5.
Гормон роста в первое время действия на клетки может вызывать в них
инсулиноподобные эффекты, так например, как и инсулин, он на какое-то время
активирует транспорт аминокислот в клетки, транспорт глюкозы и липогенез [4,8].
В связи с этим было предположено, что гормон роста может активировать некоторые
сигнальные пути, активируемые и инсулином. И это в действительности оказалось
правдой. Оказалось, что гормон роста может активировать фосфорилирование IRS-белков (Insuline receptor substrate), точно это доказано для IRS-1, 2 и 3 (но не IRS-4) [8]. Эти белки в случае связывания
инсулина со своим специфическим рецептором, обладающим тирозинкиназной
активностью, взаимодействуют с его цитоплазматическим доменом и фосфорилируются
по остаткам тирозина. Но в случае гормона роста эти белки активируются иначе.
Согласно последним данным активация этих белков идёт посредством JAK-2 киназы, а возможно для этого также
требуются и некоторые адаптерные белки, потенциальные кандидаты на роль которых
- Grb2 и CrkII [8]. Одной из мишеней для IRS-белков является регуляторная субъединица p85 фосфатидилинозитол-3-киназы (PI3K), которая фосфорилирует фосфатидилинозитол и увеличивает
количество в клетке его фосфорилированных производных:
фосфатидилинозитол-3-фосфата, фосфатидилинозитол-3,4-бисфосфата,
фосфатидилинозитол-3,4,5-трифосфата. Хотя приводятся также данные, что возможна
активация фосфоинозитол-3-киназы и без участия IRS-белков, при прямом связывании её регуляторных
субъединиц с цитоплазматической частью рецептора гормона роста при связывании
его с гормоном. Фосфатидилинозитол-3,4,5-трифосфат - главный из
фосфатидилинозитолов, требующихся для активации таких ферментов, как PDK-1 (piruvate dehydrogenase kinase, фермент, фосфорилирующий пируватдегидрогеназный
комплекс и инактивирующий его), протеинкиназы В (PKB, синоним Akt-белок, это серин/треониновая киназа), киназ p70S6K (активирует гены
раннего ответа, через её активацию гормон роста стимулирует дифференцировку
адипоцитов) и p90RSK, некоторых протеинкиназ С (например δ,
ε и ν-изоформ). Другие субстраты этой
протеинкиназы - 6-фосфофруктокиназа и ГЛЮТ-4, фосфорилирование последнего
скорее всего потенцирует его транслокацию в плазматическую мембрану, с чем и
связан кратковременный инсулиноподобный эффект гормона роста на потребление
клеткой глюкозы [8]. И наконец, весьма важный субстрат PKB - это фосфодиэстераза, активируемая фосфорилированием
и гидролизующая цАМФ до АМФ, уменьшение количества цАМФ в клетке. Этот эффект,
вероятно, способствует смещению равновесия в жировой ткани в сторону
липогенеза, поскольку цАМФ стимулирует протеинкиназу А, которая поддерживает в
активном (фосфорилированном) состоянии гормончувствительную
триацилглицероллипазу жировой ткани; при падении концентрации цАМФ в клетке
адипоцита падает и активность этого фермента, что приводит к ингибированию
всего процесса липолиза [8,10]. PI3-киназа
может также фосфорилировать белки IRS-1 и STAT3 (но по серинам, а не тирозинам),
биологическое значение этого ещё не известно [8].
Отдельно важно сказать про протеинкиназу С. Структура фермента была
описана выше, важно отметить, что при активации гормона роста в основном
стимулируется протеинкиназа ε, возможно δ
и ν [4,8]. Специфичный для этого пути
эффект - активация L-типа Ca2+ - каналов в клетках-мишенях гормона
рост (рисунок №4)а. По всей вероятности эти каналы являются мишенями для протеинкиназы
С, и фосфорилирование приводит к их активации [4,8]. Возможен однако и другой
механизм, согласно которому через JAK-2 киназу происходит активация фосфолипазы С γ-изоформы (PLC-γ), мобилизация кальция из
внутриклеточного депо с участием инозитолтрифосфата и активация протеинкиназы С
[8]. Возрастание концентрации внутриклеточного кальция может приводить к
активации транскрипции некоторых генов, например гена цитохрома P4502C12 [4,8],
к реорганизации актинового цитоскелета, активации клеточной пролиферации и
другим эффектам [8].
Не так давно было высказано предположение, что с JAK-2 киназой связана (и активируется ею) FAK (Focal Adhesion kinase), или p125FAK, которая как оказалось участвует в
проведении сигналов внутрь клетки не только от интегринов, но и от некоторых
цитокиновых рецепторов, к суперсемейству которых принадлежит и рецептор гормона
роста. Эта киназа относится к пролинбогатым тирозиновым киназам (proline-rich
tyrosine kinase), подсемейству нерецепторных тирозинкиназ. Данная киназа участвует
в активации PI3-киназы, при этом происходит её
активация фосфорилированием и аутофосфорилирование самой FAK. Кроме того белок фосфорилируется Shc-киназой, после чего с ней
ассоциируется белок Grb-2 и SOS, про которые было сказано выше. FAK может быть ответственна в активации MAP-каскада, и что весьма интересно,
может фосфорилировать белки паксиллин и тензин - белки, связанные с актиновым
цитоскелетом. Фосфорилирование их стимулирует распад существующих в цитоплазме
под мембраной сети актиновых филаментов с последующей их реполимеризацией, что
сопровождается движениями разных участков плазматической мембраны друг
относительно друга, что может объяснить, почему действие гормона роста на
моноциты (и наверное не только на них, но и на некоторые другие клетки иммунной
системы) сопровождается стимулированием их миграции и хемотаксической
активности [8].
Как видно, при активации рецептора гормона роста и связанной с этим
активации JAK-2 запускаются одновременно несколько
внутриклеточных сигнальных путей, которые могут частично «перекрываться» друг
другом.

Рисунок 5. Структура мультибелкового комплекса, образующегося при
ассоциации с JAK-2 киназой, ассоциированной в внутриклеточным доменом рецептора
гормона роста, прочих белков, связанных с цитоскелетом или инициирующим разные
сигнальные пути [8]
Это, а также то, что практически все сигнальные пути от рецептора гормона
роста начинаются с непосредственной ассоциации белка-посредника с JAK-2 киназой, натолкнула исследователей
на мысль о том, что при активации рецептора гормона роста и связанной с его
цитоплазматическим участком JAK-2
образуется мультибелковый комплекс, в котором с JAK-2 киназой ассоциированы FAK и IRS-1
белки, а через них - белки, запускающие синальные пути, такие как p85PI3K, SHC, Grb-2, причём в этом принимают участие некоторые
«адаптерные» белки, такие как Nck, CrkII, p130GAS, c-Cbl. Поскольку о них не было подробно сказано выше,
целесообразно кратко охарактеризовать их [8].
CrkII - белок, имеющий в своём составе SH2 и SH3-домены,
который активирует PI3-киназу и кроме
того участвует в активации STAT-5
в комплексе с ещё одним белком (C3G). Этот белок важен для осуществления
индуцируемой гормоном роста реарранжировке актиновых филаментов и в проведении
митогенных сигналов от его рецепторов. Белок p130GAS по
видимому связан с этим комплексом и выполняет смежные функции. Nck может участвовать в проведении
сигнала по пути, связанным с IRS-белками,
а c-Cbl может участвовать в негативной регуляции сигнализации
от гормона роста. Этот белок на N-конце
имеет PTB-домен (Phosphotyrosine-binding
domain, домен, связывающий фосфорилированные тирозины), а на С-конце домен RING-finger (домен «безымянный палец»), в составе которого есть
пролинобогащённая область и Zn2+ - связывающий домен типа
«застёжка-молния», что роднит его с ферментами убиквитинлигазами, которые
присоединяя убиквитин к белку-мишени стимулируют деградацию данного белка.
Скорее всего, c-Cbl и есть такая убиквитинлигаза, специфичная к рецептору
гормона роста и являющаяся терминатором сигнальных путей, им активируемых [8].
5.3
Соматомедины, их секреция, рецепторы и биологические эффекты
Гормон роста в клетках и тканях организма стимулирует продукцию
инсулиноподобных факторов роста, или соматомединов, которые ответственны за
некоторые биологические эффекты, вызываемые им [10], поэтому для полного
понимания механизма действия гормона роста целесообразно кратко
охарактеризовать эти вещества.
Инсулиноподобный фактор роста-1 (IGF-1, ИФР-1), или соматомедин С - это одноцепочечный
пептид основного характера, состоящий из 70 аминокислотных остатков. Инсулиноподобный
фактор роста-2 (IGF-2, ИФР-2), или
соматомедин А - также одноцепочечный пептид, но кислотного характера,
включающий в себя 67 аминокислотных остатков. По первичной структуре белки
гомологичны между собой и с проинсулином, откуда и пошло их название [10].
Синтез их стимулируется через регуляцию транскрипции их генов через активацию
гормоном роста латентных транскрипционных факторов - STAT-белков, связывающихся с GAS-like
элементами в промоторах многих генов, в том числе гена ИФР-1, активируя их
транскрипцию. При этом, по-видимому, наибольшую роль играет STAT-5B белок [8,16]. Считается, что у человека и других
млекопитающих главное место синтеза соматомединов - печень, хотя обнаружена их
секреция и в других местах, например ИФР-1 секретируется в человеческих
дермальных фибробластах, крысиных хондроцитах, в клетках теки фолликул яичника,
ИФР-2 - в клетках гранулёзы яичников [6].
Считается, что секреция ИФР-2 менее зависима от концентрации в крови
гормона роста, чем секреция ИФР-1 [10]. Кроме гормона роста на их синтез и
секрецию влияют: стимулирующее - паратиреоидный гормон в остеобластах в
отношении ИФР-1, но не ИФР-2; эстрогены - могут стимулировать их синтез в яичнике;
холикальцитриол - стимулирует синтез ИФР-2, но ингибирует синтез ИФР-1 [6].
У людей уровень транскрипции гена ИФР-1 в печени, почках и сердце мал по
сравнению с транскрипцией ИФР-2, но растёт с возрастом (в среднем, при
нормальном уровне гормона роста, относительно ИФР-1), в то время как на крысах
было показано, что ИФР-2 экспрессируется больше в плодный период развития, и
его экспрессия после рождения снижается [6].
В крови 95% всего количества соматомединов циркулирует в связанном с
белками виде. Связывающие их белки были названы IGFBP - Insuline growth factor binding proteins (белки, связывающие инсулиноподобные
ростовые факторы). Всего их известно шесть. Они изучены уже достаточно полно, о
них можно сказать следующее. Все они включают в себя 200-300 аминокислотных
остатков, имеют в составе примерно 18 дисульфидных внутримолекулярных связей. IGFBP-1 и 2 имеют на своём С-конце
последовательность аминокислот аргинон-глицин-аспартат, что роднит их с
некоторыми белками межклеточного матрикса. IGFBP-3, 4, 5 и 6 в разной степени гликозилированы. IGFBP-1 связывает ИФР-1 и 2 с примерно
одинаковой аффинностью, причём его аффинность к ним примерно в 5 раз выше, чем
их рецепторов к ним. Белок экспрессируется в почках и печени. IGFBP-2 экспрессируется в основном у плода
и в основном в мозге. Его сродство к ИФР-2 в 3 раза выше, чем к ИФР-1, и в
общем выше к ним, чем у IGFBP-1.
IGFBP-3 в крови находится в составе
некоего 150кДа - связывающего ИФР комплекса (совместно с так называемой
кислотолабильной субъединицей, Acid Labile Subunit), у крыс синтезируется
печенью, почками, плацентой, в матке и яичнике. IGFBP-4 - в фибробластах. IGFBP-3 и 4 связывают с одинаковой аффинностью ИФР-1 и 2. IGFBP-5 - обладает наивысшим сродством к
ИФР, связывая их в 50 раз сильнее, чем их рецепторы, его синтез отмечен в
яичниках, плаценте и клетках остеосаркомы человека. Особенностью IGFBP-6 был обнаружен в цереброспинальной
жидкости, в фибробластах и остеосаркоме, его особенность - в 10-100 раз более
высокое сродство к ИФР-2, чем к ИФР-1. Наибольшая концентрация в крови - у IGFBP-3 (5мкг/мл), 2 (150нг/мл) и 1
(50нг/мл). IGFBP-1,2,4,6 могут образовывать так
называемый 40кДа - связывающий ИФР комплекс [6].
При связывании с IGFBP период полужизни ИФР в крови увеличивается. Так если для свободного
ИФР-1 он составляет 10 минут, то для его же в составе 40кДа - комплекса - 30
минут, а в составе 150кДа - комплекса, куда входит IGFBP-3, даже 10-12 часов [6].
До сих пор не ясно, секретируются ли в крови ИФР и IGFBP по отдельности, или уже в составе единых
комплексов. IGFBP ингибируют взаимодействие ИФР со
своими рецепторами, хотя IGFBP-1
и 2 в опытах стимулировали митогенную активность ИФР-1. На счёт регуляции
синтеза и секреции IGFBP гормоном
роста известно точно лишь то, что тот стимулирует синтез IGFBP-3 [6].
На клетках-мишенях для ИФР есть специфические рецепторы. По видимому
наиболее важен так называемый «рецептор к ИФР-1». Не смотря на название,
он может связывать не только ИФР-1, но и ИФР-2, хотя и с меньшей в 2-10 раз
аффинностью. Рецептор может активироваться и инсулином, но сродство к нему в
100-500 раз ниже, чем к ИФР-1. Этот рецептор очень похож на инсулиновый
рецептор. Он также трансмембранный гетеротетрамер состава α2β2 и тирозинкиназный домен на цитоплазматическом участке
β-субъединицы. Причём как и в случае
инсулинового рецептора, непосредственным субстратом, который он фосфорилирует,
является белок IRS-1 (синоним ppI85). Тот далее по средством своих SH2 доменов активирует PI3-киназу фосфорилированием. Как уже
упоминалось выше применительно к активации этой киназы напрямую гормоном роста
через свой рецептор, PI3-киназа
ответственна за такие биологические эффекты, как усиление потребления глюкозы,
липогенеза, стимуляцию транскрипции некоторых генов, активацию клеточного цикла
[6]. Инсулин также обладает митогенной активностью (действуя через свои
специфические рецепторы), но ИФР-1 стимулирует митогенную активность в меньших,
чем он, концентрациях [10].
Имеется и так называемый «рецептор к ИФР-2». Он ещё плохо изучен,
но уже ясно, что этот трансмембранный белок с большим внеклеточным,
единственным трансмембранным и коротким цитоплазматическим доменом идентичен
катионнезависимому маннозо-6-фосфатному рецептору. Внеклеточный домен имеет
отдельные сайты связывания для остатка маннозо-6-фосфата и ИФР-2. При этом
рецептор сопряжён с Gi2 - белком (ингибирует
аденилатциклазу), связывание рецептора с ИФР-2 активирует Gi2 - белок, а связывание с маннозо-6-фосфатом его
ингибирует [6]. Полагают, что основную часть своих биологических эффектов
соматомедины оказывают через «рецептор к ИФР-1», поскольку эффекты, возникающие
при активации «рецептора к ИФР-2» пока трудно интерпретируемы однозначно. К
основным общим биологическим эффектам соматомединов относят стимуляцию роста
организма, прибавление в весе, рост эпифизов костей и их продольный рост. Но в
этом плане непосредственно сам гормон роста оказывает более существенные
эффекты. Но отмечено, что если гормон роста обуславливает (без соматомединов)
равномерный рост всех частей тела, а также печени, то ИФР-1 более усиливает
рост почек, селезёнки, тимуса и головного мозга. Отмечено, что ИФР-1 влияет и
непосредственно на функции почек, усиливая клубочковую фильтрацию и увеличивая
количество протекающей через почки плазмы крови [6]. Ещё одно важное значение
ИФР-1 в том, что он участвует в петле отрицательной обратной связи регуляции
концентрации гормона роста в крови. Действуя на уровне гипоталамуса, он
стимулирует секрецию соматостатина и ингибирует секрецию соматолиберина, а на
уровне гипофиза ингибирует секрецию гормона роста [10].
5.4
Суммарные биологические эффекты гормона роста
Теперь можно кратко обобщить биологические эффекты гормона роста, связав
их с выше описанными молекулярными механизмами действия гормона роста.
Первичные эффекты гормона роста кратковременны и инсулиноподобны и заключаются
в основном в:
. Усиление потребления глюкозы [4,8, 10,16]. Происходит посредством
активации инсулиновым рецептором через белки IRS-1,2 и 3 фосфатидилинозитол-3-киназы с последующей
активацией протеинкиназы В, которая фосфорилирует ГЛЮТ-4, что активирует его
транслокацию в плазматические мембраны и транспорт глюкозы в клетки [8,10].
. Усиление липогенеза [10]. Та же протеинкиназа В фосфорилирует и
активирует фосфодиэстеразу, уменьшающую концентрацию цАМФ в клетке и таким
образом инактивирующая триацилглицероллипазу, смещая равновесие в сторону
липогенеза [8].
Основные, длительные эффекты гормона роста заключаются в:
. Стимуляция роста тела, стимуляция роста эпифизов трубчатых костей и их
продольного роста, удлинение периода роста, стимуляция увеличения мышечной
массы [2,10]. Связано с активацией гормоном роста через специфические рецепторы
МАР-каскада и STAT-белков, что сопровождается не только
активацией транскрипции генов раннего ответа с последующей стимуляцией клеточного
цикла, но и со стимуляцией через p90rsk SRF-белка, стимулирующего экспрессию многих мышечных
белков (актина, миозина, тропонина, тропомиозина, креатинкиназы и некоторых
других) [5,8]. Данный эффект связан с активацией и синтеза белка вообще
благодаря стимуляции транспорта аминокислот в клетки мышц, печени и т.д. [10]
Гормон роста усиливает эти процессы, особенно на уровне отдельных органов и
тканей, через усиление продукции соматомединов в них [6,10].
. Усиление глюконеогенеза в печени [10]. Скорее всего происходит
благодаря индукции синтеза специфических ферментов (через STAT- MAP-сигнальные пути), например глюкозо-6-фосфатазы,
фруктозо-1,6-бисфосфатазы, фосфоенолпируваткарбоксикиназы. Возможен и механизм,
согласно которому через активацию синтеза фосфатидилинозитол-3,4,5-трифосфатов
происходит активация PDK-1
(киназы пируватдегидрогеназы), фосфорилирующей прируватдегидрогеназный комплекс
и его инактивирующей [8]. Тем самым утилизация пирувата замедляется, что
увеличивает вероятность того, что тот пойдёт на глюконеогенез.
. Усиление липолиза в жировой ткани [10]. Этот эффект противоположен
раннему эффекту и эффекту инсулина. ТАГ-липаза активируется путём
фосфорилирования-дефосфорилирования. Активен фермент в фосфорилированной форме.
Может быть связан с активацией какой-либо протеинкиназы в цитозоле через
МАР-киназный путь, например p90rsk или p70rsk [4],
фосфорилирующие (возможно, с участием дополнительных посредников) этот фермент.
Возможна индукция синтеза фермента с участием STAT-белков.
. Снижение утилизации глюкозы в жировой ткани и мышцах [10]. Связана с
ингибиторным влиянием PDK-1
на прируватдегидрогеназный комплекс [8], возможно репрессией синтеза
соответствующих ферментов (глюкокиназы, фосфофруктокиназы-1, пируваткиназы).
Поскольку за синтез гликогена ответственна гликогенсинтаза, которая при
фосфорилировании кальмодулинзависимой протеинкиназой и киназой фосфорилазы,
зависимой от кальмодулина, инактивируется, то увеличение концентрации Ca2+ в мышечной клетке и связанное с этим
кальмодулинзависимое активирование данных киназ может остановить
гликогеногенез, что автоматически замедлит и потребление клеткой глюкозы. А
гормон роста, в свою очередь, через активацию L-типа Ca2+ - каналов по средством пути, связным
с IRS-белками, PI3K и протеинкиназой
С, либо через освобождение Ca2+
из внутриклеточных
депо через активацию JAK-2
киназой γ-изоформы фосфолипазы С и продукцию
фосфатидилинозитол-1,4.5-бисфосфата может увеличивать концентрацию Ca2+ в клетке [4,8].
. Повышение концентрации глюкозы и жирных кислот в крови [10] - прямое
следствие активации липолиза в жировой ткани и глюконеогенеза в печени.
. Задержка Na+ и неорганических фосфатов [2]. Не
основной, но точно установленный эффект гормона роста. Можно предположить, что
это - сопутствующий эффект при увеличении общего синтеза белков. В клетках
почечных канальцев вместе с другими белками может активироваться синтез Na+ - каналов, транспортирующих эти ионы из почечных
канальцев в их эпителий, и Na+/К+ - АТФазы, переносящей
ионы натрия далее в межклеточное пространство; не исключён и эффект
опосредованный, через ИФР-1. стимулирующий интенсивность фильтрации первичной
мочи в почках [6].
. Гиперплазия β-клеток и стимуляция синтеза инсулина [2,8]. В
организме возможно опосредованное влияние на секрецию инсулина гормоном роста
через повышение им концентрации глюкозы в крови (активация глюконеогенеза в
печени), в случае культуры клеток результат объясним возможным активированием
транскрипции гена инсулина через STAT-5
и повышением концентрации внутриклеточного Ca2+ [4,16].
. Стимуляция иммунитета [2]. Может быть связана с активацией подвижности
клеток моноцитарного ряда (моноциты, макрофаги) через активацию FAK, фосфорилирующую паксиллин и тензин,
что способствует реарранжировке (распаду, а затем вновь сборке по-иному
актиновых филаментов) [8], обуславливающую возможность изменения клеточной
формы и возможность подвижности данных клеток.
Таким образом, в общих чертах ясна картина молекулярных механизмов
действия гормона роста, хотя многие вещи являются ещё не до конца понятыми и
продолжают исследоваться.
6.
Эндокринные патологии, связанные с гормоном роста и их лечение
6.1
Болезни, связанные с недостаточностью гормона роста
Совокупность болезней, связанных с нарушением роста (отставанием в росте)
и физиологического развития организма вследствие нарушений синтеза и секреции
гормона роста, регуляции его синтеза и секреции или чувствительности тканей к
нему принято называть гипофизарным нанизмом (синонимы - карликовость,
наносомия). При этом у большинства пациентов нарушения при этом затрагивают не
только гормон роста, но касаются и других тропных гипофизарных гормонов.
Частота встречаемости данной патологии по разным данным от 1/30000 до 1/3000
[1].
Обычно больные гипофизарным нанизмом начинают отставать в росте в возрасте
с 2 до 4 лет. До появления средств активной терапии карликовым считали рост
женщин менее 120см, а мужчин менее 130см. Кроме абсолютного показателя роста
для диагностики используют и показатель нормативного отклонения
И=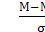 ,
,
где М - рост пациента, Мср - средний нормальный рост для данного пола и
возраста, σ - квадратичное отклонение от Мср. Если И<3 - подозревают
нанизм, если И>3 - гигантизм [1].
Телосложение больных пропорциональное, хотя эти пропорции больше соответствуют
детскому возрасту. Кожа бледная, часто с желтоватым оттенком, иногда
наблюдается цианоз - «мраморность» кожи. Иногда (но не всегда) наблюдается
задержка окостенения и дифференциации скелета. Наблюдают часто недоразвитие
половой системы, хотя пороки её встречаются редко. Возможно нарушение функции
щитовидной железы из-за нарушения преобразования тироксина (Т4) в
трийодтиронин (Т3), вместо него образуется «реверсивный»
трийодтиронин, не активный биологически. Интеллект чаще не нарушен, хотя иногда
наблюдают инфантилизм. При исследовании биоэлектрической активности мозга
отмечают неравномерность α-ритма по амплитуде и частоте, повышенное содержание δ и θ-ритмов. Для углеводного обмена
больных характерно пониженное содержание эндогенного инсулина, но повышенная
чувствительность к экзогенному инсулину; тенденция к гипогликемии натощак и
гипергликемии при физических нагрузках. Часта артериальная гипотония [1].
У человека чаще всего гипофизарный нанизм - наследственное заболевание,
вызываемое разными причинами, причём такая патология чаще встречается в странах
Ближнего и Среднего Востока и в Африке, чем в России и странах ближнего
зарубежья. После подробного изучения этиологии и патогенеза наследственного
гипофизарного нанизма выяснилось, что это не одно, а группа заболеваний. Вот
краткая характеристика некоторых из них (на примере заболеваний у человека)
[1].
Наследственная изолированная недостаточность гормона роста. Может быть
четырёх типов. I тип связан с
делецией гена гормона роста и наследуется по аутосомному рецессивному типу. II тип связан с нарушением регуляции
секреции соматотропина на уровне гипоталамуса и также передаётся по аутосомному
рецессивному типу. III тип -
нарушение синтеза гормона роста, связанное с самим гипофизом, передаётся по
аутосомному доминантному типу. IV тип
- недостаточность гормона роста с неизвестной этиологией, передающаяся сцеплено
с Х-хромосомой. При I типе
изолированной недостаточности гормона роста его практически не обнаруживают в
крови, при всех остальных - содержание его сильно понижено. Содержание инсулина
при всех данных патологиях понижено (кроме III типа, в этом случае оно повышено). Содержание ИФР-1 в
крови ниже нормы, все четыре формы, чаще всего, могут лечиться введением
соматотропина. Отмечается при всех данных типах: резкая низкорослость,
дифференцировка скелета чаще соответствует возрасту, турецкое седло в
нормальном состоянии, нормальное развитие скелета и половое развитие,
нормальная функция щитовидной железы, хороший интеллект. Иногда, когда говорят
о гипофизарном нанизме в узком смысле, подразумевают из всех его видов именно
наследственную изолированную недостаточность гормона роста [1].
Пангипопитуитаризм. Развивается медленнее изолированной недостаточности
гормона роста. Связан с различными дефектами на уровне гипоталамуса и гипофиза.
Различают два типа заболевания: тип I передаётся по аутосомно-рецессивному механизму, а II - сцеплено с Х-хромосомой.
Концентрации соматотропина, ИФР-1 и инсулина в крови больных понижена, лечение
экзогенным гормоном роста даёт всегда положительные результаты. Основные
отличия от изолированной недостаточности гормона роста разных типов заключается
в том, что имеется не только резкое отставание в росте, но и отставание в
дифференцировке скелета, половом развитии, хотя нарушений развития скелета нет;
к тому же у больных пангипопитуитаризмом снижена функция щитовидной железы,
низкая концентрация АКТГ в крови, низкое содержание гонадотропных гормонов [1].
Биологическая неактивность гормона роста. Вызывается тми мутациями
гормона роста, которые не отражаются на его синтезе и секреции, но понижают его
сродство связывания с рецепторами. Концентрация гормона роста в крови пациентов
нормальная, иногда даже повышенная (дефектный гормон роста не только не
действует на ткани, но и не ингибирует свой синтез по короткой петле обратной
связи), ИФР-1 нормальная или сниженная, введение экзогенного соматотропина даёт
положительный эффект. Кроме нормальной концентрации гормона роста болезнь
практически во всём похожа на наследственную изолированную недостаточность
гормона роста [1].
Нанизм Ларона. Возникает вследствие дефекта рецептора гормона роста на
гепатоцитах и связанному с этим снижению синтеза печенью ИФР-1 и ИФР-2.
Наследуется по аутосомному рецессивному типу. Концентрация гормона роста в
крови повышенная (из-за недостатка ИФР нарушается петля обратной связи
регуляции его секреции). Концентрация инсулина понижена. Что важно, лечение
экзогенным гормоном роста не оказывает эффекта (клетки к нему нечувствительны,
как и к собственному). Отмечается резкое отставание в росте, но при этом
нормальная дифференцировка скелета и нормальное его развитие, половое развитие
не заторможено, либо не сильно заторможено, уровень АКТГ, гонадотропинов и
функция щитовидной железы не нарушается [1,10].
Карликовость африканских пигмеев. Это - результат нарушения передачи
внутриклеточного сигнала от рецептора гормона роста. Заболевание очень похожа
на нанизм Ларона, в том числе и невозможностью лечить его введением экзогенного
соматотропина, и основной клиникой, но в отличие от него наследуется по
аутосомному доминантному типу [1,10].
Возможны и другие причины наследственного гипофизарного нанизма, например
снижение чувствительности к ИФР-1. Нанизм может наблюдаться и при некоторых
других редких наследственных заболеваниях - синдроме Гетчинсона-Гилфорда,
синдроме Рассела-Сильвера, синдромы Секкеля, синдроме Прадера-Вилли, синдроме
Лоуренса-Муна-Барде-Бидля и некоторых других. Низкорослость может наблюдаться и
при синдромах, не связанных напрямую с гормоном роста, например синдроме
Иценко-Кушинга (избыток глюкокортикоидов тормозит секрецию гормона роста),
синдроме Мориака (низкорослость и инфантилизм сопровождают тяжёлую форму
инсулинозависимого сахарного диабета) [1].
Большую группу больных с гипофизарным нанизмом составляют больные с
разыми органическими патологиями ЦНС, возникающими внутриутробно или в детском
возрасте (церебрально-гипофизарный нанизм). Этиология данных патологий связана
с недоразвитием гипофиза, турецкого седла, атрофией его при сдавливании
опухолью (краниофарингиомой, хромофобной аденомой, менингиомой, глиомой),
травматическими повреждениями гипофиза, что часто случается при многоплодной
беременности и патологических родах. Имеют значения и инфекционные повреждения
(у человека - туберкулёз, сифилис, малярия, токсоплазмоз, энцефалиты) [1].
Дополнительные факторы, усугубляющие патогенез нанизма, могут быть
несбалансированное кормление, неблагоприятные условия внешней среды,
гломерулонефрит, цирроз печени (в последних двух случаях из-за нарушения
синтеза соматомединов) [1].
Лечение нанизма довольно длительно. У детей с неясной этиологией болезни
вначале 6-12 месяцев назначают общеукрепляющее лечение: полноценное питание с
увеличенным содержанием животных белков, овощей и фруктов, препараты витаминов
А, D, кальция и фосфора. Лишь при
отсутствии достаточных сдвигов в росте и развитии приступают к гормонотерапии.
Для неё используют в гуманной медицине лишь соматотропин человека и приматов
(поскольку гормон обладает видовой специфичностью). Широко используют препарат,
выделенный из гипофиза людей, умерших от неинфекционных и неопухолевых
болезней, получен и генно-инженерный соматотропин с использованием E. coli. Возрастных ограничений для лечения не установлено.
Минимальные эффективные дозы, используемые в первый период лечения, составляют
30-60мкг/кг массы тела, наиболее эффективные дозы 2-4 мг 3 раза в неделю.
Апробированы два метода лечения: непрерывный и прерывистый с курсами по 2-3
месяца и последующими интервалами между ними. При длительном непрерывном
лечении среднее увеличение роста составило 0,82см/мес., массы тела -
0,38кг/мес. При прерывистом соответственно 0,75см/мес. и 0,4кг/мес. Непрерывный
курс лечения имеет эффект 1-1,5 года, а прерывистый 3-4 года. Важно применение
анаболических стероидов. Лечение проводится несколько лет с заменой одних
препаратов другими, менее активных более активными. Лечение проводится курсами,
одномоментно назначают лишь один препарат, комбинировать их для усиления
ростового действия нецелесообразно. Рекомендуемые дозы препаратов: неробола -
0,1-0,15мг/кг массы тела в сутки перорально, нероболила 1мг/кг внутримышечно
раз в месяц (месячная доза вводится в 2-3 приёма), ретаболила 1мг/кг массы тела
в месяц внутримышечно. При гипотериозе, сопутствующем нанизму, целесообразно
совместно назначать тиреоидные гормоны. С 15-16 лет в случае мальчиков (но не
раньше) начинают применять хорионический гонадотропин, девочкам старше 16 лет -
эстрогены. Целенаправленное и систематическое лечение нанизма даёт выраженные
эффекты. Так согласно исследованиям (на примере 175 больных) в ходе этого
лечения у 21% больных удалось увеличить рост на 30см, у 61% - на 31-50см, у 18%
- на 51-60см и более [1].
6.2
Болезни, связанные с избытком гормона роста
Эти болезни - гигантизм и акромегалия. Гигантизм (макросомия) -
заболевание детей и подростков с незакончившимся физиологическим ростом,
характеризующееся превышающим физиологические границы сравнительно
пропорциональным эпифизарным и периостальным увеличением костей, мелких тканей
и органов. Акромегалия - ускоренный рост тела, но не в длину, а в ширину, что
проявляется в диспропорциональном периостальном увеличении костей скелета и
внутренних органов, которое сочетается с характерными нарушениями обмена
веществ [1].
Как и гипофизарный нанизм, акромегалия может быть наследственной,
примерно у 40% больных обнаруживается мутация в αs - субъединице G-белка плазматической мембраны
соматотрофных клеток, в результате чего последняя теряет ГТФазную активность;
по этой причине развивается продолжительная активация аденилатциклазы,
повышенная концентрация цАМФ в соматотрофоцитах повышает уровень транскрипции
гена гормона роста через активацию его CREB - транскрипционного фактора (фосфорилированием
протеинкиназой А). [1,10] Однако другие данные говорят о том, что в 99% случаев
причина гигантизма и акромегалии - аденомы гипофиза, секретирующие гормон
роста. В 45% случаев подобные опухоли продуцируют только соматотропин, в 30% -
ещё и пролактин, а в 25% случаев и другие гормоны (тиреотропный гормон,
фолликулостимулирующий гормон и др.). Встречаемость заболевания не зависит от
пола и составляет 40-60 случаев на миллион. Кроме того причинами могут быть
первичные патологии гипоталамуса и вышележащих отделов ЦНС, повышение
чувствительности клеток к соматотропину, опухоли, стимулирующие
соматотропин-релизинг гормон [1].
Гигантизм и акромегалия имеют одни и те же этиологические причины, но
гигантизм проявляется у подростков, а акромегалия - у взрослых. Характерные
жалобы при акромегалии - головная боль, изменение внешности, увеличение размеров
кистей и стоп. Головная боль возникает вследствие превышения внутричерепного
давления и (или) компрессией диафрагмы турецкого седла растущей опухолью.
Изменение черт лица проявляются в их огрублении, увеличении надбровных дуг,
скуловых костей, нижней челюсти с нарушением прикуса (прогнатизм) и расширением
межзубных промежутков. Отмечают укрупнение стоп и кистей, гипертрофию мягких
тканей лица - носа, губ и ушей, язык увеличен. Увеличение объёма мышечной ткани
происходит в основном не за счёт самих волокон, а за счёт разрастания
соединительнотканных образований, поэтому развивается миопатия. У больных также
гипертрофируется хрящевая ткань, формируется низкий осиплый голос. Разрастается
паренхима и строма всех внутренних органов: лёгких, сердца, печени,
поджелудочной железы, кишечника, селезёнки. На начальных этапах это почти не
отражается на их функциях, но в дальнейшем проявляются признаки легочной,
сердечной и почечной недостаточности. Наблюдают атеросклеротические изменения
сосудов, повышение артериального давления (30% больных). Из-за нарушения
проводимости дыхательных путей возможен синдром остановки дыхания во время сна
(90% больных). У 30% больных развиваются парестезии, что связано со
сдавливанием нервов гипертрофированными костными структурами или мягкими
тканями, например карпальный синдром, сопровождающийся анемией и потерей
чувствительности пальцев рук. У 25% женщин отмечают галакторею. Разрастание
хрящевой ткани (артралгия) обуславливает нарушение функций суставов, увеличение
количества потовых желёз - повышенную потливость, активация и гипертрофия
сальных желёз - характерный её вид (плотная, утолщённая, с глубокими складками,
более выраженными на волосистой части головы) и утолщение [1,9].
Развитие заболевания включает следующие стадии: преакромегалитическую
(трудно диагностируемые первые признаки), гипертрофическую (гипертрофия и
гиперплазия тканей и органов), опухолевую (опухоль гипофиза сдавливает
окружающие ткани, в результате чего повышается внутричерепное давление, глазные
и неврологические нарушения) и кахектическую (кровоизлияния в опухоль гипофиза
с последующим развитием пангипопитуитаризма) [1].
По анатомо-физиологическому различают гипофизарную и гипоталамическую
формы акромегалии. Для первой характерна автономность опухоли, независимость
секреции ею соматотропина от концентрации глюкозы в крови, препаратов,
действующих на ЦНС. Для второй характерна чувствительность секреции
соматотропина к глюкозе, чувствительность к препаратам, действующим на ЦНС,
сохранение ритмов секреции соматотропина. Выделяют также доброкачественную и
злокачественную формы. Доброкачественная возникает у лиц старше 45 лет,
характеризуется отсутствием выраженных клинико-лабораторных признаков процесса,
может продолжаться 10-30 лет и более. Злокачественная акромегалия возникает в
молодом возрасте, характеризуется значительным развитием клинических признаков,
выходом опухоли гипофиза за пределы турецкого седла, продолжительность жизни
больных без лечения 3-4 года [17].
Акромегалию следует отличать от болезни Педжета, синдрома
Бамбергера-Мари, конституционного высокого роста, синдрома Клайнфелтера [1].
Лечение. Должно быть комплексным. Наиболее распространены различные виды
внешнего облучения (облучение гипофиза рентгеновскими, γ-лучами и протонным пучком, в дозе
45-150Гр в зависимости от размера опухли). Реже имплантируют в гипофиз
радиоактивные изотопы, например Au-198,
Y-90 и криодеструкцию опухоли жидким
азотом. Из хирургических методов в случае, если опухоль не вышла за пределы
турецкого седла, методом выбора является селективная трансназальная
транссфеноидпальная аденоэктомия, осложнения при операции (ликворея, менингит,
геморрагия) редки (менее 1%). При более значительных размерах опухоли
адренэктомия проводится трансфронтальным доступом. Нужно учитывать, что в случае
небольших инкапсулированных аденом оперативное лечение может привести к
ремиссии заболевания, в случае опухоли с экстрацеллюлярным ростом неэффективно.
Фармакологическое лечение заключается в использовании препаратов, влияющих на
моноэргические системы мозга, таких как α-адреноблокаторы (фентоламин) и
антисеротонинергические препараты (ципрогептадин, метисергид), стимуляторы
дофаминовой системы (L-допа,
апоморфин, бромокрептин, норпролак, парлодел). Перспективно применение
соматостатина (и его аналогов - октреотида, ланреотида), но непродолжительность
его действия ограничивает его клиническое применение. Используют и блокаторы
рецепторов гормона роста (пегвисомант), особенно при неэффективности прочих
методов [1,9].
Заключение
Таким образом, понятно, что вопрос, касающийся молекулярных механизмов
синтеза, секреции и биологического действия гормона роста далеко не простой.
Построение общей картины сильно осложняет наличие сложных регуляторных
механизмов синтеза и секреции, нескольких различных, но взаимодействующих между
собой сигнальных путей, активация которых гормоном роста возможна через один и
тот же рецептор, в одной и той же клетке-мишени, большое число генов,
кодирующих самые разнообразные по функциям белки, транскрипция которых
активируется им, наличие дополнительных посредников в цепи механизма
биологического действия гормона на уровне целого организма (соматомединов),
существование в крови белков, связывающих как сам гормон роста, так и эти
соматомедины. Более того как видно из выше приведённого, ранние и поздние
эффекты гормона роста могут быть противоположными (например в отношении
потребления глюкозы и липогенеза). Плюс ко всему имеются отличия в ритмах
секреции у самцов и самок млекопитающих, что приводит к индукции транскрипции у
них различных генов, механизм чего на сегодняшнее время ещё точно не
установлен.
Молекулярные механизмы действия гормона роста в общих чертах ясны, но вот
некоторые тонкие детали этого процесса ещё предстоит описать будущим его
исследователям. В связи с этим исследования данного гормона, молекулярных
механизмов его действия обуславливаемых ими биологических эффектов ещё
продолжаются.
Список
литературы
1.
Клиническая эндокринология: руководство / Г.Ф.Александрова, А.В. Антонов, В.Н.
Бабичев, Э.Н. Базарова, М.И. Бронштейн и др.; под ред. проф. Н.Т. Старковой. - М.: Питер, 2002. - С: 30-62.
.
Gerhard P. Baumann Growth hormone isoforms / Gerhard P. Baumann // Growth
Hormone & IGF Research, 2009. Vol. 19, P. 333-340.
.
Karen Lin-Su Growth Hormone Releasing Hormone (GHRH) and the GHRH Receptor /
Karen Lin-Su, Michael P.Wajnrajch // Reviews in Endocrine & Metabolic
Disorders, 2002. Vol. 3, P. 313-323.
.
Lawrence S. Argetsinger Mechanism of Signaling by Growth Hormone Receptor /
Lawrence S. Argetsinger, Christin Carter-Su // Physiological Reviews, 1996.
Vol. 76, №4. - P. 1089-1107.
Chai
J. Serum response factor: discovery, biochemistry, biological roles and
implications for tissue injury healing / J. Chai, A.S. Tarnawski // Journal of
physiology and pharmacology, 2002. Vol. 53, №2. P. 147-157.
.
Cohick W.S. The insulin-like growth factors / W.S. Cohick, D.R. Clemmons //
Annu. Rev. Physiol., 1993. Vol. 55, P. 131-153.
Andrew
J. Brooks Growth hormone receptor; mechanism of action / Andrew J. Brooks, Jong
Wei Wooh, Kathryn A. Tunny, Michael J. Waters // The International Journal of
Biochemistry & Cell Biology, 2008. Vol. 40, P. 1984-1989.
.
Tao Zhu Signal transduction via the growth hormone receptor / Tao Zhu, Eyleen
L.K. Goh, Ralph Graichen, Ling Ling, Peter E. Lobie // Cellular Signalling,
2001. Vol. 13, P. 599-616.
. Дедов И.И.
Эндокринология; учебник / И.И. Дедов, Г.А. Мельниченко, В.Ф. Фадеев. - М.:
ГЭОТАР-Медиа, 2007. - С: 50-57.
. Биохимия:
учебник / Л.В. Авдеева, Л.Т. Алейникова, Л.Е. Андрианова и др., под ред. чл.-корр.
РАН, проф. Е.С. Северина. - 5-е изд. - М.; ГЭОТАР-Медиа, 2009. - С: 250-258,
548-551.
. Зинченко
В.П. Внутриклеточная сигнализация; учеб. пособие / В.П. Зинченко, Л.П.
Долгачева. - Пущино, электронное издательство «Аналитическая микроскопия»,
2003, С: 25-27; 71-75.
12.
Joseph B. Martin Brain regulation of growth hormone secretion / Joseph B.
Martin, William J. Millard // J. Anim. Sci., 1986, Vol. 63. P. 11-26.
.
Gerhard Baumann Growth Hormone Binding Protein 2001 / Gerhard Baumann //
Journal of Pediatric Lndocrinology & Metabolism, 2001, Vol. 14. P. 355-375.
. Фаллер Д.М.
Молекулярная биология клетки. Руководство для врачей. / Фаллер Д.М., Шилдс Д.
Пер. с англ. под ред. И.Б. Збарского. - М.: «Издательство БИНОМ», 2006, С:
222-227.
. Мушкамбаров
Н.Н. Молекулярная биология: Учебное пособие для студентов медицинских вузов. /
Н.Н. Мушкамбаров, С.Л. Кузнецов. - М.: ООО «Медицинское информационное
агенство», 2007, С:409-438.
16.
Herrington J. The role of STAT proteins in growth hormone signaling / J.
Herrington, L.S. Smit, J. Schwartz, C. Carter-Su // Oncogene, 2000, Vol. 19. P.
2585-2597.