Расчёт процесса горения частицы углерода
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ И НАУКИ,
МОЛОДЁЖИ И
СПОРТА УКРАИНЫ
ГОСУДАРСТВЕННОЕ
ВЫСШЕЕ УЧЕБНОЕ ЗАВЕДЕНИЕ
ДОНЕЦКИЙ
НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра
"Промышленная теплоэнергетика"
КУРСОВАЯ
РАБОТА
по
курсу «Физико-химические процессы в теплоэнергетике»
На
тему «Расчёт процесса горения частицы углерода»
Донецк 2012
г.
ЗАДАНИЕ
Задание:
. Определить область горения частицы топлива в
топке котельного агрегата при заданной температуре.
2. Просчитать время выгорания частиц топлива.
. Рассчитать скорость витания, парциальное
давление кислорода у поверхности частицы и оценить расход кислорода или
углерода в первый период, когда не произошло существенного изменения в размерах
частицы.
. Рассмотреть условия выгорания коксовой частицы
в конечной части прямоточного факела.
. В соответствии со стехиометрическими
уравнениями просчитать константу равновесия реакции.
. Проверить правильность решения, применив
сокращенный метод Владимирова.
Исходные
данные
топливо выгорание коксовый реакция
Топливо: каменный уголь
Марка: Г - газовый






Т,K - температура факела 1300
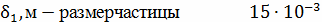
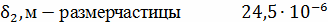
ВВЕДЕНИЕ
В каждой топке подаваемое в неё топливо при
повышении температуры проходит следующие стадии:
предварительный подогрев
подсушку
разложение на летучие
воспламенение
полное или не полное сгорание горючих газов и
пирогенетическое превращение их происходящее в топочной камере, полное или не
полное горение кокса
разложение CO2и H2Oпри высоких температурах в
присутствии углерода
освобождение минеральных примесей из топлива
разложение, окисление и плавление некоторых из
них - образование шлака
выжигание кокса из шлака
Тот или иной характер протекания этих стадий
очень сильно зависит от свойств топлива, способа сжигания, особенностей
топочного устройства и ухода за ним.
Горение топлива в топке начинается после его
воспламенения.в присутствии кислорода любое вещество подвергается окислению
даже при низких температурах. Однако при этом окисление идёт очень медленно. По
мере повышения температуры интенсивность окисления возрастает. Следует
различать по интенсивности окисления две области температур. В первой из них
тепло, выделяющееся при окислении, не в состоянии поддерживать температуру
горючего вещества идущего на горение воздуха или кислорода выше температуры
окружающей среда. В области же высоких температур окисление идёт на столько
интенсивно, что температура поднимается до величины, значительно превышающей
температуру окружающей среды, и поддерживается самим процессом окисления.
Горение кокса идёт в основном по поверхности
кусочков его - в слое, пылинок в факеле угольной пыли или же частичек сажи - в
факеле жидкого топлива. Совершающаяся на поверхности кокса реакция соединения
углерода с кислородом имеет очень большую скорость, и процесс горения твёрдого
кусочка протекал бы весьма быстро, если бы было обеспечено столь же быстрое
питание реакции необходимым ей кислородом и отвод получившихся продуктов
сгорания от поверхности. Подвод кислорода к поверхности и удаление от неё
продуктов сгорания происходит при помощи диффузии, импульсом для которой
является разность концентрации у поверхности горящего кусочка и окружающей
атмосфере. Всё это приводит к тому, что результирующая скорость всего процесса
зависит от скорости подвода к поверхности горящей частицы нужного количества
кислорода.
При расчёте котельного агрегата.а так же при
контроле и наладке его работы, приходится определять объем воздуха,
необходимого для горения, количество продуктов сгорания, их состав, учитывать
влияние неполноты сгорания на количество выделенного тепла.
1. РАСЧЁТ КОНСТАНТ РАВНОВЕССИЯ
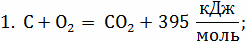
Приняв за единицу измерения 1 кг и
соответственно 1 килограмм-молекулу (моль), получим:
С + 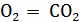 ;
;
кг С + 32 кг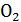 = 44кг
= 44кг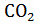 ;
;
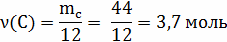

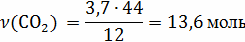
V(
V(C

12кг С + 16 кг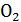 = 28 кг СО
= 28 кг СО

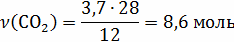
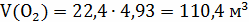

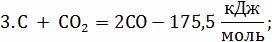
12кг С + 44 кг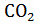 = 56 кг СО;
= 56 кг СО;

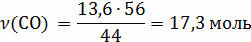
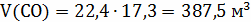

12кг С + 18 кг = 28 кг СО + 2 кг
= 28 кг СО + 2 кг 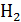 ;
;
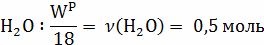
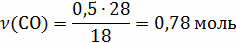
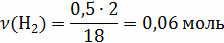
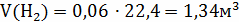

12кг С + 36 кг  =
44 кг С
=
44 кг С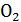 + 4 кг
+ 4 кг 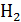 ;
;
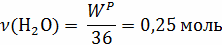
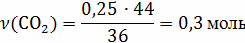
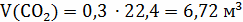

V(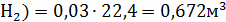
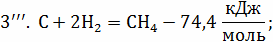
12кг С + 4кг 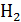 =
16
=
16 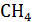
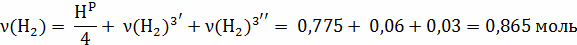
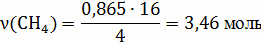
V(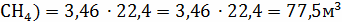
Следующие реакции протекают в газовом объёме и
являются гомогенными, считаем по объёму.
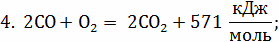
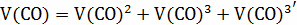




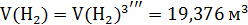
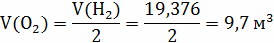


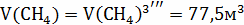
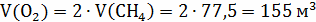

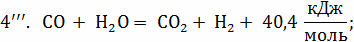

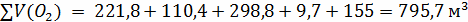
При использовании для горения кислорода воздуха
необходимо учесть, что воздух представляет смесь, состоящую по объёму
приблизительно из 21% кислорода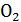 и 79% азота
и 79% азота 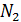 ,
то есть в воздухе содержится на 1 объём кислорода 79:21 = 3,76 объёма азота,
или на 1 моль
,
то есть в воздухе содержится на 1 объём кислорода 79:21 = 3,76 объёма азота,
или на 1 моль 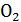 приходится 3,76
моля
приходится 3,76
моля 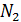 .
Азот без изменения попадает в продукты горения. Поэтому баланс продуктов
горения углерода в воздухе можно условно написать так:
.
Азот без изменения попадает в продукты горения. Поэтому баланс продуктов
горения углерода в воздухе можно условно написать так:
С + 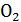 +
3,76
+
3,76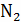 =
=  +
3,76
+
3,76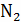 ;
;
1 моль С + 1 моль 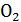 +
3,76 моль
+
3,76 моль 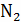 = 1 моль
= 1 моль  +
3,76 моль
+
3,76 моль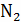 .
.
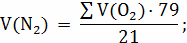
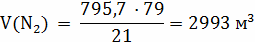
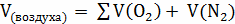 ;
;
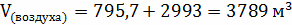
Расчёт констант равновесия по стехеометрическим
формулам:
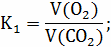

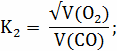

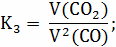
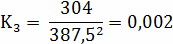

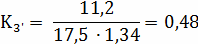
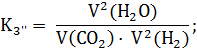
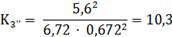
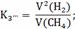



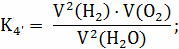
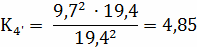

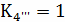
Расчёт по методу Владимирова:
В общем случае для химической реакции
bB+dD=gG+rR
 и
и 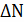 определяются
по формулам:
определяются
по формулам:
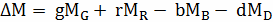 ;
;
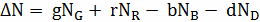 ;
;
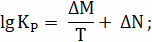


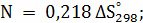
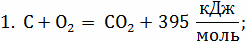
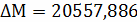
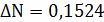 ;
;
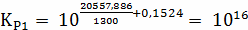

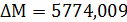 ;
;
 ;
;

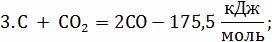
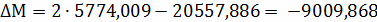 ;
;
 ;
;

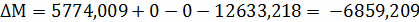 ;
;
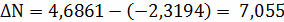 ;
;
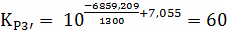

 ;
;
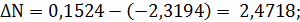
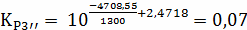
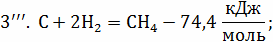
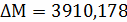 ;
;
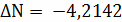 ;
;

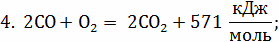
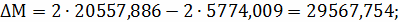
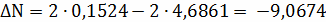 ;
;
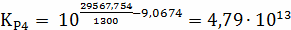

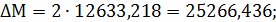
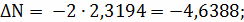
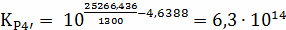




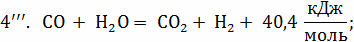
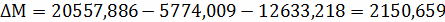 ;
;
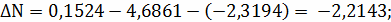
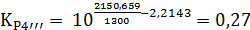
Составим сравнительную таблицу для констант
равновесия, рассчитанных по стехиометрическим формулам и по методу Владимирова:
Таблица 1 - Константы равновесия
|
Реакции
|
По
стехиометрическим формулам
|
По
методу Владимирова
|
|
C+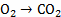
|
0,73
|
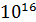
|
|
C+0,5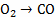
|
0,05
|

|
|
C
+ 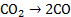
|
0,002
|
169
|
|

|
0,48
|
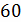
|
|
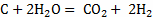
|
10,3
|
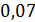
|
|
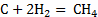
|
4,8
|

|
|
2CO
+ 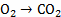
|
298,8
|
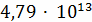
|
|
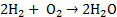
|
4,85
|
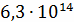
|
|
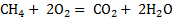
|
1
|
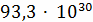
|
|
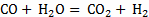
|
1
|
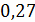
|
Константа равновесия показывает во сколько раз
скорость прямой реакции больше скорости обратной реакции при данной температуре
и концентрациях веществ, которые вступают в реакцию. Из анализа данных, можно
сделать вывод, что скорость прямой реакции c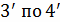 намного
больше скорости обратной. В реакциях
намного
больше скорости обратной. В реакциях 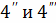 константы
равновесия равны единице, это значит, что скорости прямой и обратной реакции
равны.
константы
равновесия равны единице, это значит, что скорости прямой и обратной реакции
равны.
2. ОПРЕДЕЛЕНИЕ ВРЕМЕНИ ВЫГОРАНИЯ
ЧАСТИЦЫ
Определение k1


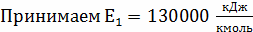 ;
;

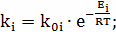
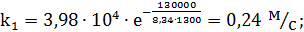

 ;
;
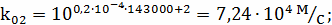
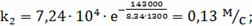
Определение k3
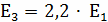 ;
;
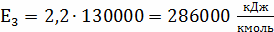 ;
;


Определение 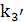
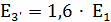 ;
;
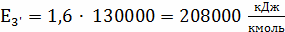 ;
;
 ;
;
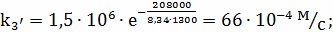
2.5 Определение k4
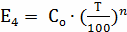 , n = 3
, n = 3
где
 ;
;

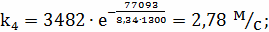
Определение времени выгорания частицы по
формуле:
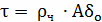 , где
, где
 ;
;
 ;
;
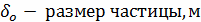
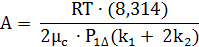

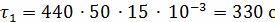 ;
;
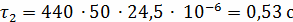
Дальнейший расчёт будем вести для 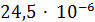 ,
так как вторая частица ушла в механический унос.
,
так как вторая частица ушла в механический унос.
3. РАСЧЁТ СКОРОСТИ ВИТАНИЯ ЧАСТИЦЫ
Определим плотность газового потока:

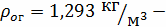 плотность воздуха
при н.у.
плотность воздуха
при н.у.
 ;
;
Находим критерий Кирпичева:

 - кинематическая вязкость;
- кинематическая вязкость;
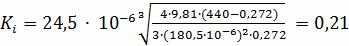 ;
;
Определим критерий Шиллера:

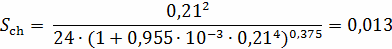

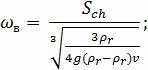
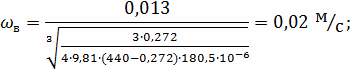
Определение области движения частицы по формуле:


Re = 0,003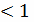 -область
Стокса, т.е. чисто вязкого течения
-область
Стокса, т.е. чисто вязкого течения

С = 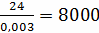
4. ОПРЕДЕЛЕНИЕ ОБЛАСТИ ГОРЕНИЯ
ЧАСТИЦЫ
Рассчитываем коэффициент диффузии по
зависимостям:

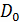 - коэффициент
взаимной диффузии при н.у.,
- коэффициент
взаимной диффузии при н.у., 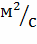
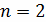 - показатель
степени;
- показатель
степени;
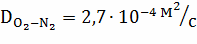 ;
;
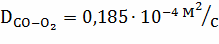 ;
;
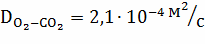 ;
;
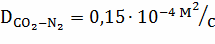 ;
;
Определим коэффициент диффузии в
многокомпонентной смеси:

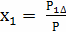 ,
,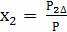 ,
, - молярные доли компонентов в смеси
- молярные доли компонентов в смеси

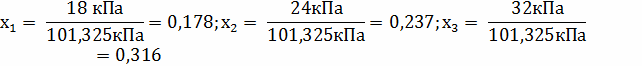
Найдем коэффициент массоотдачи по формуле:
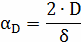
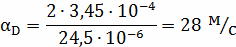
Определим диффузионно-химический критерий:
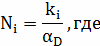
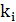 - константа
скорости i-ой реакции,
- константа
скорости i-ой реакции, 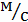

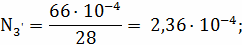
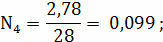
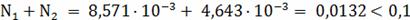 - является
кинематической областью горения.
- является
кинематической областью горения.
Оцениваем влияние реакции  :
:
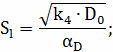
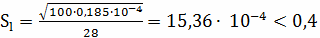
негорящий пограничный слой.
Для скорости выгорания углерода в этих условиях:
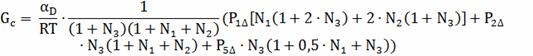
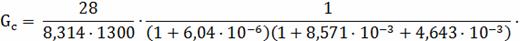
 =
= 
5. ОПРЕДЕЛЕНИЕ ПАРЦИАЛЬНОГО ДАВЛЕНИЯ
КОМПОНЕНТОВ НА ПОВЕРХНОСТИ ЧАСТИЦЫ
Парциальные давления компонентов на поверхности
частицы вычисляем по формулам:


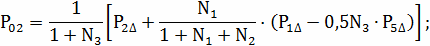
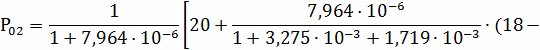

 =
=
 =
=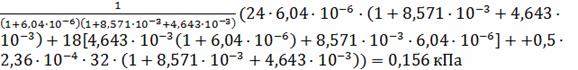
ВЫВОДЫ
В данной курсовой работе мы рассчитывали процесс
горения частицы углерода. Для этого мы рассмотрели реакции и рассчитали
константы равновесия для этих реакций. Затем рассчитали время выгорания частиц
топлива разных размеров, так как одна из частиц ушла в механический унос расчёт
вели для одной частицы. Из расчётной скорости витания видно, что частица
находится в области Стокса. Далее мы определили область горения частицы и
рассчитали парциальное давление компонентов на поверхности частицы.
ПЕРЕЧЕНЬ ССЫЛОК
1.
Е.К. Сафонова, А.Л. Попов «Методические указания для выполнения курсовой работы
для студентов специальностей ТП и ТЭС дневной и заочной форм обучения», Донецк,
ДонНТУ, 2002г-43с.
2.
В.В. Померанцев «Основы практической теории горения».
3.
Конспект по «Теории горения».
4.
Конспект лекций по ФХП для специальности ТП.