Междумолекулярные и межатомные связи между элементарными частицами
Содержание
Вступление
. Межмолекулярные
силы взаимодействия и их
природа
. Расчётная
часть
Вывод
Литература
Вступление
Контактное взаимодействие кристаллических тел
между собой ,а также с газами и жидкостями также сопровождается появлением
междумолекулярных или межатомных связей между элементарными частицами
контактирующих веществ.
Строение вещества определяется не только
взаимным расположением атомов в химических частицах, но и расположением этих
химических частиц в пространстве. Наиболее упорядочено размещение атомов,
молекул и ионов в кристаллах (от греческого "кристаллос" - лед), где
химические частицы (атомы, молекулы, ионы) расположены в определенном порядке,
образуя в пространстве кристаллическую решетку. При определенных условиях образования
они могут иметь естественную форму правильных симметричных многогранников.
Кристаллическое состояние характеризуется наличием дальнего порядка в
расположении частиц и симметрией кристаллической решетки.
1. Межмолекулярные
силы взаимодействия и их
природа
Межмолекулярное взаимодействие - взаимодействие
между электрически нейтральными молекулами или атомами; определяет
существование жидкостей и молекулярных кристаллов, отличие реальных газов от
идеальных и проявляется в разнообразных физических явлениях. Межмолекулярное
взаимодействие зависит от расстояния r между молекулами и, как правило,
описывается потенциальной энергией взаимодействия U(r) (потенциалом М. в.), так
как именно средняя потенциальная энергия взаимодействия определяет состояние и
многие свойства вещества.
Впервые М. в. принял во внимание Я. Д. Ван дер
Ваальс (1873) для объяснения свойств реальных газов и жидкостей. Ван дер Ваальс
предположил, что на малых расстояниях r между молекулами действуют силы
отталкивания, которые с увеличением расстояния сменяются силами притяжения. На
основе этих представлений, даже не рассматривая количественной зависимости
Межмолекулярных взаимодействий от расстояния, он получил так называемое
Ван-дер-Ваальса уравнение состояния реального газа.
Ван-дер-Ваальсовы силы - силы межмолекулярного
взаимодействия с энергией 0,8 - 8,16 кДж/моль. Этим термином первоначально
обозначались все такие силы, но сейчас он обычно применяется к силам,
возникающим при поляризации молекул и образовании диполей.
К Ван-дер-Ваальсовым силам относятся
взаимодействия между диполями (постоянными и индуцированными). Название связано
с тем фактом, что эти силы являются причиной поправки на внутреннее давление в
уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в
основном определяют силы, ответственные за формирование пространственной
структуры биологических макромолекул. Существует три типа Ван-дер-Ваальсовых
сил:
. Ориентационные силы,
. Дисперсионные (лондоновские) силы,
. Индукционные силы.
До сих пор многие авторы исходят из
предположения, что Ван-дер-Ваальсовые силы определяют межслоевое взаимодействие
в слоистых кристаллах, что противоречит экспериментальным данным: масштабу
анизотропии температуры Дебая и, соответственно, масштабу анизотропии
решёточного отражения. Исходя из данного ошибочного предположения построены
многие двумерные модели, "описывающие" свойства, в частности графита
и нитрида бора.
Проявления в природе:
· Сцепление частиц малых астероидов,
кольца Сатурна;
Уравнение состояния газа Ван-дер-Ваальса -
уравнение, связывающее основные термодинамические величины в модели газа
Ван-дер-Ваальса.
Хотя модель идеального газа хорошо описывает
поведение реальных газов при низких давлениях и высоких температурах, в других
условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в
том, что реальные газы могут быть переведены в жидкое и даже в твёрдое
состояние, а идеальные - не могут.
Для более точного описания поведения реальных
газов при низких температурах была создана модель газа Ван-дер-Ваальса,
учитывающая силы межмолекулярного взаимодействия. В этой модели внутренняя
энергия U становится функцией не только температуры, но и объёма.
Термическим уравнением состояния (или, часто,
просто уравнением состояния) называется связь между давлением, объёмом и
температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет
вид:

где
*p - давление,
*V - объём,
*T - абсолютная температура,
*R - универсальная газовая постоянная.
Видно, что это уравнение фактически является
уравнением состояния идеального газа с двумя поправками. Поправка a учитывает
силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть
силы, втягивающие молекулы приграничного слоя внутрь), поправка b - силы
отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
Для ν молей
газа Ван-дер-Ваальса уравнение состояния выглядит так:

Внутренняя энергия газа Ван-дер-Ваальса:
Потенциальная энергия межмолекулярных сил
взаимодействия вычисляется как работа, которую совершают эти силы, при
разведении молекул на бесконечность:

Внутренняя энергия газа Ван-дер-Ваальса
складывается из его кинетической энергии (энергии теплового движения молекул) и
только что нами посчитанной потенциальной. Так, для одного моль газа:

где 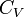 -
молярная теплоёмкость при постоянном объёме, которая предполагается не
зависящей от температуры.
-
молярная теплоёмкость при постоянном объёме, которая предполагается не
зависящей от температуры.
Ориентационные силы действуют между полярными
молекулами, то есть обладающими дипольными электрическими моментами. Сила
притяжения между двумя полярными молекулами максимальна в том случае, когда их
дипольные моменты располагаются вдоль одной линии .Эта сила возникает благодаря
тому, что расстояния между разноимёнными зарядами немного меньше, чем между
одноимёнными. В результате притяжение диполей превосходит их отталкивание.
Взаимодействие диполей зависит от их взаимной ориентации, и поэтому силы
дипольного взаимодействия называются ориентационными. Хаотическое тепловое
движение непрерывно меняет ориентацию полярных молекул, но, как показывает
расчёт, среднее по всевозможным ориентациям значение силы имеет определённую
величину, не равную нулю.
Силы отталкивания:
Силы отталкивания действуют между молекулами на
очень малых расстояниях, когда приходят в соприкосновение заполненные
электронные оболочки атомов, входящих в состав молекул. Существующий в
квантовой механике принцип Паули запрещает проникновение заполненных
электронных оболочек друг в друга. Возникающие при этом силы отталкивания
зависят в большей степени, чем силы притяжения, от индивидуальности молекул.
Индукционные силы
Индукционные (или поляризационные) силы
действуют между полярной и неполярной молекулами. Полярная молекула создаёт
электрическое поле, которое поляризует молекулу с электрическими зарядами,
равномерно распределёнными по объёму. Положительные заряды смещаются по
направлению электрического поля (то есть от положительного полюса), а
отрицательные - против (к положительному полюсу). В результате у неполярной
молекулы индуцируется дипольный момент.
Эта энергия называется индукционной, так как она
появляется благодаря поляризации молекул, вызванной электростатической
индукцией.
Дисперсионные силы
Между неполярными молекулами действует
дисперсионное межмолекулярное взаимодействие. Природа этого взаимодействия была
выяснена полностью только после создания квантовой механики. В атомах и
молекулах электроны сложным образом движутся вокруг ядер. В среднем по времени
дипольные моменты неполярных молекул оказываются равными нулю. Но в каждый
момент электроны занимают какое-то положение. Поэтому мгновенное значение
дипольного момента (например, у атома водорода) отлично от нуля. Мгновенный
диполь создаёт электрическое поле, поляризующее соседние молекулы. В результате
возникает взаимодействие мгновенных диполей. Энергия взаимодействия между
неполярными молекулами есть средний результат взаимодействия всевозможных
мгновенных диполей с дипольными моментами, которые они наводят в соседних
молекулах благодаря индукции.
Межмолекулярное взаимодействие данного типа
называется дисперсионным потому, что дисперсия света в веществе определяется
теми же свойствами молекул, что и это взаимодействие. Дисперсионные силы
действуют между всеми атомами и молекулами, так как механизм их появления не
зависит от того, есть ли у молекул (атомов) постоянные дипольные моменты или
нет. Обычно эти силы превосходят по величине как ориентационные, так и
индукционные. Только при взаимодействии молекул с большими дипольными
моментами, например молекул воды, For > Fdisp (в 3
раза для молекул воды). При взаимодействии же таких полярных молекул, как CO,
HI, HBr и других, дисперсионные силы в десятки и сотни раз превосходят все
остальные.
Природа межмолекулярного взаимодействия
Межмолекулярное взаимодействие имеет
электрическую природу и складывается из сил притяжения (ориентационных,
индукционных и дисперсионных) и сил отталкивания.
Ориентационные силы

Два электрических диполя ab и cd при указанном
взаимном расположении притягиваются, т. к. разноимённые заряды в точках b и с
взаимодействуют сильнее, чем одноимённые заряды в точках а и с (а также в b и
d).
Междумолекулярные силы увеличиваются при
увеличении давления и уменьшаются при увеличении температуры.
Ориентационные силы действуют между полярными
молекулами, то есть обладающими дипольными электрическими моментами. Потенциальная
энергия ориентационного межмолекулярного взаимодействия:

где p1,p2 - дипольные
моменты взаимодействующих молекул.
. Расчётная
часть
Расчеты поверхностной энергии для Ag
в твердой и жидкой фазе,
Исходные данные:
Метал - Ag;
Тип кристаллической решетки - ГЦК;
 = 284.6 кДж/моль
= 284.6 кДж/моль
 = 250.6
кДж/моль
= 250.6
кДж/моль
 10.49 г/см3
10.49 г/см3
 9.30 г/см3
9.30 г/см3
q =42
N = 
)Рассчитаем поверхностную энергию для металла в
твердой фазе:

где:  -
теплота сублимации
-
теплота сублимации

 атомов на 1
атомов на 1 

)Рассчитаем поверхностную энергию для металла в
жидкой фазе:

де:  плотность
металла в твердой и жидкой фазе
плотность
металла в твердой и жидкой фазе

 теплота
сублимации и испарения
теплота
сублимации и испарения


где:
 угол
смачивания твердого тела жидким металлом (Ag)
угол
смачивания твердого тела жидким металлом (Ag)

Вывод
межмолекулярный
дисперсионный индукционный атом
Изучив написанное выше,
можно
сделать вывод, что между
материалами возникают взаимодействия на молекулярном уровне. Они являются
важными факторами при сварке, пайке,
нанесении покрытий и склеивании материалов. Так
же важными факторами при этих процессах являются поверхностная энергия метала в
жидкой и твёрдой фазе, а так же работа
адгезии. Для Ag
поверхностная энергия в жидкой фазе составляет  ,в
твёрдой она равняется
,в
твёрдой она равняется  ,работа адгезии для
серебра =
,работа адгезии для
серебра = .
.
Литература
1. Радченко И. В., Молекулярная
физика, М., 1965;
. Коулсон К., Межатомные силы
- от Максвелла до Шредингера, "Успехи физических наук", 1963.
. Бараш Ю.С. - Силы
Ван-Дер-Ваальса (1988)
4. Ресурсы
интернет:
<http://bse.sci-lib.com/article075079.html>
<http://ru.wikipedia.org/wiki/Силы_Ван-дер-Ваальса>
5. Методичні вказівки та
завдання до виконання розрахунково-графічної роботи №1 для студентів за
напрямком підготовки 6.050504 - "Зварювання"